鲤鱼汤对阿霉素肾病大鼠肾脏MMP-2和TIMP-2表达的影响
2013-08-05齐玉梅郭云良刘宗宝肖慧娟
高 英,齐玉梅,沈 卫,郭云良,刘宗宝,张 宇,肖慧娟
(1天津医科大学公卫学院营养与食品卫生系,天津300070;2天津市第三中心医院;3青岛大学医学院中西医结合中心;4青岛大学医学院松山医院)
阿霉素肾病模型是出现肾病综合征表现并伴有小管间质纤维化和肾小球硬化倾向的一个典型的实验模型[1]。研究表明,非肿瘤性肾脏疾病的病理改变实质均是细胞外基质(ECM)在肾小球和肾间质中异常堆积的结果[2]。ECM的主要成分Ⅳ型胶原构成了肾小球基底膜(GBM)的基本网架结构,也是肾小管基底膜(TBM)中最丰富的成分,主要受ECM的降解酶系基质金属蛋白酶(MMPs)调节,其中MMP-2是降解Ⅳ型胶原最重要的酶之一,而基质金属蛋白酶抑制剂-2(TIMP-2)是MMP-2内源性抑制因子。中医古籍及近年临床报道认为,鲤鱼汤有利尿消肿的作用[3~5]。2011年8~11月,我们观察了鲤鱼汤对阿霉素肾病大鼠肾组织MMP-2和TIMP-2表达的影响,探讨鲤鱼汤利水消肿、改善蛋白尿、缓解肾脏纤维化的作用及其机制。
1 材料与方法
1.1 材料 动物:Wistar大鼠40只,8周龄,体质量(200±20)g,SPF级,购自山东医药有限公司(许可证号:SLXK鲁20080002)。药物及试剂:鲤鱼汤(鲤鱼为购自山东莱西产芝水库8周龄野生鲤鱼,按照鱼水比重1∶4,先文火煎煮至开锅,后武火煎煮60 min,滤除鱼汤;按此法再煎煮第二遍,将两遍鱼汤混合,浓缩至300%。1 mL含鲤鱼3 g)用聚乙烯塑料袋分袋密封包装,置于-20℃冰箱中备用。厄贝沙坦片(批号:1A101,赛诺菲安万特制药)。阿霉素(ADR,批号:110402,浙江海正药业生产)。兔抗MMP-2亲和纯化抗体(批号:bs-0412R)、兔抗TIMP-2亲和纯化抗体(批号:bs-0416R)购自北京博奥森生物技术有限公司。超敏即用型二步法检测试剂盒(PV-9001)购自北京中衫金桥生物技术有限公司。
1.2 实验方法
1.2.1 阿霉素肾病模型制备及分组 大鼠适应性喂养1周。尿蛋白检测阴性后随机取10只作为对照组,其余30只参照 Bertani[6]方法单剂量尾静脉注射阿霉素6.2 mg/kg制作阿霉素肾病模型,制模后随机分为模型组、厄贝沙坦组、鲤鱼汤组,每组各10只。
1.2.2 干预方法 造模后1周对大鼠行灌胃干预。灌胃药物:鲤鱼汤组为300%鲤鱼汤9 mL/kg(按照大鼠与人体表面积的折算系数0.018计算,相当于70 kg正常成人剂量);厄贝沙坦组为厄贝沙坦50 mg/kg(溶解于9 mL/kg的饮用水中);模型组及对照组为9 mL/kg饮用水;均1次/d,共干预8周。
1.2.3 观察项目 ①肾功能指标:收集各组造模前及造模后第1~8周晨尿及12 h尿液,记录尿量并检测尿蛋白浓度。干预后8周各组腹腔注射水合氯醛4 mL/kg全身麻醉,经心脏取血>5 mL,检测血清总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、肌酐(Cr);②肾组织病理变化:干预8周后处死大鼠,取肾脏标本置于4%多聚甲醛中固定;常规脱水、透明、浸蜡、包埋,连续冠状位切片(厚度4 μm),HE染色后光镜下观察肾组织形态学特点,IPP 6.0自动图像分析系统下测定肾小球平均截面积(AG),计算肾小球体积(Vc)。Vc=β/k(AG)3/2(式中β=1.38,k=1.10),百分比评分法计算肾小管损害率,计算10个高倍镜视野(×400)肾皮质中发生病变(包括肾小管萎缩、膨涨、扩张、管型、炎症细胞浸润,纤维化)的肾小管数目占肾小管总数的百分比;③肾皮质MMP-2、TIMP-2表达:干预后第8周采用免疫组化SABC法测定。肾组织石蜡包埋、切片,加抗原修复液(EDTA-T修复液,pH=8.0)行抗原修复,室温冷却30~50 min,PBS冲洗3 min×2次、室温孵育10 min,滴加一抗(MPP-2浓度1∶100;TIMP-2浓度1∶200),再经温室孵育、PBS冲洗;滴加二抗,37℃孵育后PBS冲洗2 min×3次,应用DAB溶液显色10 min;自来水充分冲洗、复染、脱水、透明、中性树胶加盖封片。每张切片随机选4个高倍镜下肾皮质视野(×400),Image-Pro Plus 6.0图像分析软件测定平均光密度值(OD值),每个视野计算10个MOD值的均值作为该片的OD值,代表阳性部位的蛋白表达水平。
1.3 统计学方法 采用SPSS 17.0软件。计量资料用¯x±s表示。尿蛋白与时间交互作用采用重复测量方差分析,多组样本资料两两比较采用单因素方差分析,方差齐采用LSD检验,方差不齐采用Dunnett'T3法检验。P≤0.05为差异有统计学意义。
2 结果
2.1 肾功能指标 造模1周对照组尿蛋白明显低于其余三组(P<0.05),说明造模成功。造模5周、9周厄贝沙坦组、鲤鱼汤组12 h尿蛋白均低于模型组(P<0.05);时间因素与处理因素之间存在交互作用,模型组12 h尿蛋白量呈时间依赖性上升,而鲤鱼汤组、厄贝沙坦组12 h尿蛋白含量随时间降低,明显低于模型组(P均<0.05),鲤鱼汤组、厄贝沙坦组之间差异无统计学意义。见表1。各组TP、ALB、Cr及BUN水平比较见表2。
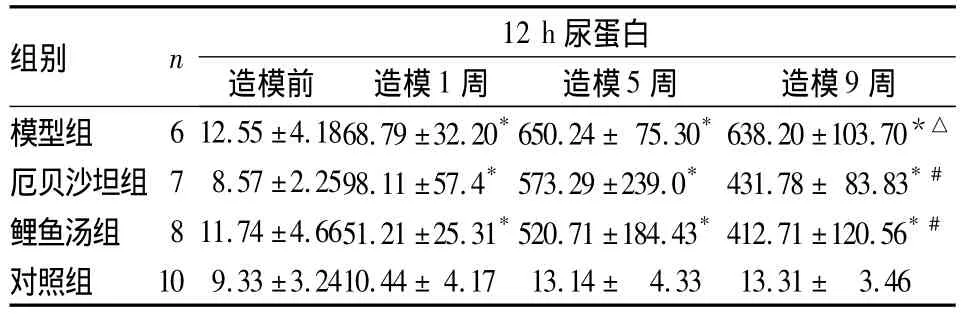
表1 各组造模前后12 h尿蛋白水平比较(mg/12 h,¯x±s)

表2 各组干预后 TP、ALB、BUN、Cr 比较(¯x±s)
2.2 肾组织病理变化 第9周末模型组肾组织光镜下可见肾小管蛋白管型、炎性细胞浸润、间质纤维化及肾小球硬化。模型组大鼠肾小球截面积、肾小球体积及肾小管损害率高于对照组组(P<0.05),并出现小管纤维化、膨胀、管型等肾小管损害。鲤鱼汤组、厄贝沙坦组肾小球截面积、肾小球体积及肾小管损害率小于模型组(P<0.05)。见图1。
2.3 肾皮质 MMP-2、TIMP-2表达 MMP-2、TIMP-2表达主要定位于肾小管上皮细胞。与对照组比较,模型组 MMP-2、TIMP-2蛋白表达均降低,MMP-2/TIMP-2值降低(P<0.05)。与模型组比较,鲤鱼汤组、厄贝沙坦组MMP-2、TIMP-2表达上调,且MMP-2/TIMP-2升高(P<0.05),鲤鱼汤组、厄贝沙坦组比较差异无统计学意义。见表3。
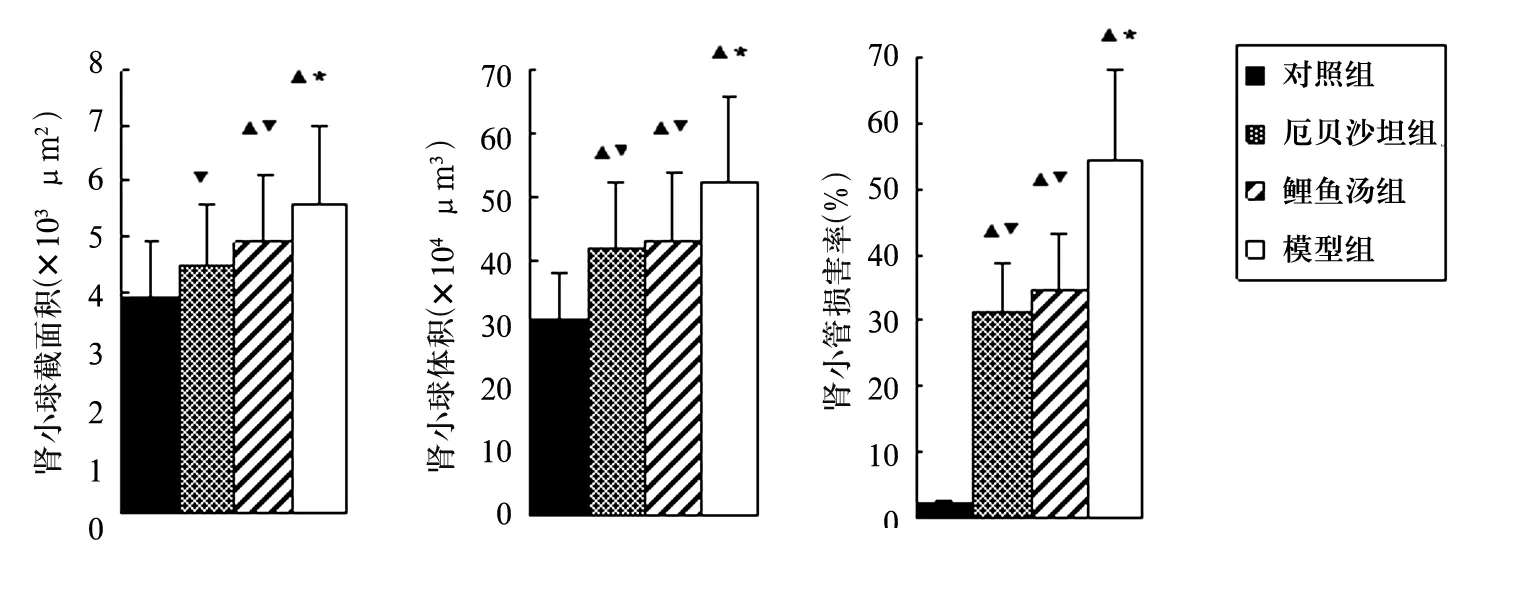
图1 各组肾小球截面积、肾小球体积、肾小管损害率比较
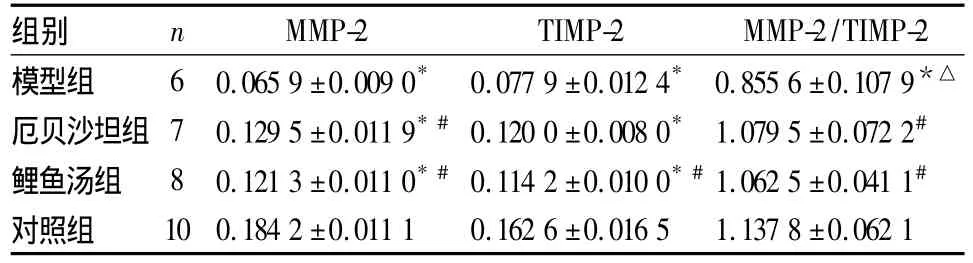
表3 各组肾皮质MMP-2、TIMP-2表达及MMP-2/TIMP-2 比较(OD 值,¯x ±s)
3 讨论
肾间质纤维化、肾小球硬化是不同肾病终末期的共同形态学表现,均是以ECM代谢失衡、异常堆积为病理基础[7,8]。ECM的主要成分为Ⅳ型胶原,Ⅳ型胶原合成与降解失衡或多肽链结构异常可使ECM过度蓄积,破坏GBM与TBM的正常结构,使其丧失原有的结构和功能,致蛋白尿产生,最终发展为纤维化乃至硬化。厄贝沙坦在治疗肾病的临床应用中发现具有更强阻断,更强降压作用,对降低微量及大量蛋白尿,抑制氧化应激,降低肾病终点事件发生率效果优于氯沙坦、缬沙坦等药物。本研究以厄贝沙坦为药物对照,观察鲤鱼汤肾脏保护作用的疗效,发现第5周~第9周,鲤鱼汤组、厄贝沙坦组尿蛋白排泄率呈时间依赖性降低,BUN、Cr、尿蛋白明显低于模型组,TP、ALB升高,鲤鱼汤组、厄贝沙坦组尿蛋白排泄率、BUN、Cr、TP、ALB 的差异无统计学意义,提示鲤鱼汤亦具有利水消肿、减轻蛋白尿的作用,推测其机制可能为升高血浆胶体渗透压,减少ECM的蓄积以维持GBM、TBM的完整性。
MMP-2是MMPs家族的重要成员,主要降解ECM成分中的Ⅳ型胶原。TIMP-2是其内源性抑制剂,它们共同调节ECM的新陈代谢。MMP/TIMP是ECM维持稳定性和完整性的决定性因素[9]。在肾病不同阶段,MMP-2、TIMP-2的表达存在不同,肾病早期(出现纤维化前)MMP-2代偿性表达上调,而肾病晚期出现硬化时MMP-2、TIMP-2表达均下调,ECM蓄积,导致肾小球系膜基质堆积出现间质纤维化[10,11]。本研究发现,模型组肾小球截面积、肾小球体积均较对照组增大,并出现纤维化及硬化,MMP-2、TIMP-2表达均降低,且 MMP-2/TIMP-2值降低,即MMP-2下调的程度超过TIMP-2的下调程度,TIMP-2相对高表达,提示模型组肾脏ECM合成增加;鲤鱼汤组与厄贝沙坦组MMP-2、TIMP-2蛋白表达均有所上调,肾小球截面积、肾小球体积均较模型组减小,但二者之间差异无统计学意义,提示应用鲤鱼汤后肾脏炎症侵润、纤维化病理变化有所改善。
综上所述,鲤鱼汤具有肾脏保护作用。其机制可能是鲤鱼鱼肉或鱼鳞中含有某种活性成分,参与了ECM降解酶系的某个作用环节,有利于调节MMP-2/TIMP-2的平衡以及滤过膜重建,从而减少ECM的蓄积并促进其降解,缓解肾脏纤维化、硬化的进程。鲤鱼作为一种价格低廉、天然易获得的食材,具有较大的药用价值。
[1]Van den Branden C,Ceyssens B,De Craemer D,et al.Renal antioxidant enzymes and fibrosis-related markers in the rat adriamycin model[J].Nephron,2000,86(2):167-175.
[2]朱清义,蒋玉红.基质金属蛋白酶-9与肾脏疾病关系的研究进展[J].中国临床医学,2006,13(4):639-641.
[3]李炳文(李时珍原著).本草纲目[M].天津:天津古籍出版社,2006:371.
[4]赵丽敏.中西医结合治疗肾病综合征36例[J].河南中医,2004,24(8):55.
[5]常克,吕斌,钟柏松,等.新制鲤鱼汤去除肾病综合症蛋白尿的临床观察[J].现代中西医结合杂志,2001,10(16):1536-1537.
[6]Bertani T,Poggi A,Pozzoni R,et al.Adriamycin-induced nephritic syndrome in rats[J].Labo Inv,1982,46(1):16-23
[7]Beaudeux JL,Giral P,Bruckert E,et al.Matrix metallo proteinases,inflammation and at heosclerosis:therapeutic perspectives[J].Clin Chem Lab Med,2004,42(2)121-131
[8]Klahr S,Morrissey JJ.The role of vasoactive compounds,growth factors and cytokines in the progression of renal disease[J].Kidney Int Suppl,2000,75:7-14.
[9]Fan YZ,Zhang JT,Yang HC,et al.Expression of MMP-2,TIMP-2 protein and the ratio of MMP-2/TIMP-2 in gallbladder carcinoma and their significance[J].World J Gastroenterol,2002,8(6):1138-1143.
[10]张岚,王惠萍,毛云英.基质金属蛋白酶-2在阿霉素肾病大鼠肾小球中的表达及其意义[J].西安交通大学学报(医学版),2011,32(4):470-472.
[11]李广波,林瑞霞,杨青,等.阿霉素肾病大鼠肾小管基质金属蛋白酶-2、金属蛋白酶抑制剂-2的免疫组织化学观察[J].实用医学杂志,2008,24(4):522-525.
