γ-分泌酶抑制剂对姜黄素后处理心肌保护作用的影响
2013-08-05段维勋梁振兴金振晓易定华俞世强
王 宁,段维勋,杨 阳,李 悦,梁振兴,金振晓,易定华,俞世强
(1第四军医大学西京医院,西安710032;2第四军医大学口腔医学系)
药物干预是对抗心肌缺血/再灌注损伤(IR)的重要策略和主要研究方向。但IR是由多种信号通路和细胞因子参与的复杂过程[1],由于具体作用机制、药物来源、副作用和伦理学等诸多问题,至今未能获得理想的心肌保护药物[2]。姜黄素(Curcumin,Cur)具有多重心血管保护作用,且毒性作用小、经济、安全,是当前心肌IR研究领域极具研究价值和开发前景的中药[3]。我们前期研究显示,Cur后处理可有效对抗心肌IR损伤,但其机制尚未完全阐明[4]。2012年6~10月,我们观察了 γ-分泌酶抑制剂DAPT(Notch信号通路特异性阻断剂)对Cur后处理心肌保护作用的影响,探讨Notch信号通路在Cur后处理在抗心肌IR中的作用及机制。
1 材料与方法
1.1 材料 动物:成年SD大鼠40只,雄性,体质量220~250 g,由第四军医大学实验动物中心提供。主要试剂和仪器:DAPT(Santa Cruz公司,美国),2,3,5-氯三苯四唑(Sigma公司,美国),LDH检测试剂盒(南京建成公司,中国)。GAPDH小鼠抗大鼠多克隆抗体(中杉金桥生物技术有限公司,北京),兔抗大鼠Notch1多克隆抗体(Abcom公司,美国),辣根过氧化物酶标记羊抗兔或鼠IgG(中杉金桥生物技术有限公司,北京),BCA-100蛋白质定量测定试剂盒(Pierce公司,美国),组织裂解蛋白提取液(碧云天生物技术公司,上海),蛋白酶抑制剂(Sigma公司,美国),预染标准蛋白质Marker(Fermentas公司,美国)。Langendoff离体心肌灌注系统(Radnoti公司,美国),MP100压力换能器(Biopac Systems公司,美国),电泳及湿转转移槽(Bio-Rad公司,美国),Western发光照相系统(Bio-Rad公司,美国)。
1.2 实验方法
1.2.1 离体心脏灌注模型建立及干预 根据文献[4],Langendoff系统采用经典的 KH 液灌装,KH缓冲液成分(mmol/L):NaCl 118,KCl 4.7,CaCl21.25,MgSO41.2,KH2PO41.2,NaHCO325,葡萄糖5.5。灌流前50 min,以体积分数为95%的 O2和5%的CO2混合气体向储液罐内的灌流液中持续通气,灌流液温度维持在37℃,维持pH 7.35~7.45。SD大鼠腹腔注射戊巴比妥(30 mg/kg)和肝素(500 U/kg)后麻醉,迅速开胸取心脏,立即放入预冷的KH缓冲液(4℃)。将主动脉根部迅速固定于灌注管口,于37℃下用KH液逆行恒压灌注(灌注压为80 mmHg)。心脏复跳后,于左心耳处剪一小口,将带有乳胶水囊的测压管经二尖瓣插入左心室。连接压力换能器,调节水囊使左心室舒张末压至5~10 mmHg,心脏稳定灌注10 min、待心跳稳定后按分组进行灌注。
将40只SD大鼠随机分为对照组、IR组、Cur组、Cur+DAPT组、DAPT组各8只。各组均采用离体心脏Langendoff逆行灌注10 min致心肌缺血,停止灌注30 min后除对照组外其余各组均予KH液再灌注150 min。Cur组再灌注液中含1 μM的Cur,Cur+DAPT 组含有 1 μM 的 Cur 和 0.5 μM 的DAPT,DAPT 组含有0.5 μM 的 DAPT。
1.2.2 观察项目
1.2.2.1 血流动力学指标 采用MP100换能器记录心脏缺血前10 min(以下称为缺血前)及再灌注15、30、45 及 60 min(以下分别以 R15、R30、R45、R60表示)时的心率(HR)、左心室发展压(LVDP)、左心室内压最大变化速率(+dp/dtmax)。收集上述时间点的冠脉流出液,记录冠脉流量(CF)。
1.2.2.2 心肌梗死面积(MI面积) 采用TTC染色法测定。参照文献[4],心脏处理完毕后于-70℃冷冻10 min,继之沿心脏长轴切成横切面1~2 mm的切片,每个心脏取直径最长的一片。切片在TTC及0.1 mol/L磷酸盐缓冲液中孵育30 min(pH调整至7.4,温度37℃),再置于40 g/L的甲醛中固定过夜,并行数码摄影。用linageJ1.37软件行图像分析,砖红色区域为正常区域,灰白色区域为梗死区域。MI面积由总坏死区占总切片区的百分比表示。
1.2.2.3 冠脉流出液 LDH 水平 根据文献[4]所述,留取各组R15时的冠脉流出液,LDH检测试剂盒检测流出液LDH水平,严格按照说明书操作。
1.2.2.4 心肌组织Notch1表达 采用Western blot法测定。将留取的心肌组织在裂解缓冲液中匀浆裂解,以12 000 r/min离心15 min。收集组织裂解物,BCA法测定蛋白浓度。取20 μg总蛋白于1×SDS缓冲液中煮7 min,进行SDS-PAGE电泳并电转移至硝酸纤维素膜上。硝酸纤维素膜用含50 g/L脱脂奶粉的TBST室温封闭1.5 h,依次滴加1∶1 000的抗Notch1及GAPDH抗体,4℃过夜后TBST洗涤3次,每次10 min。用1∶5 000的 HRP-羊抗兔或鼠IgG孵育2 h,再用TBST洗涤3次,每次10 min。最后用ECL发光液进行曝光显影,Bio-Rad照相系统进行照相和并用其附带的软件分析蛋白的相对表达量。
1.3 统计学方法 采用SPSS 16.0统计软件行统计学处理,实验结果以¯x±s表示。差异显著性检验采用单因素方差分析,组间差异采用LSD-t法检验。P<0.05为差异有统计学意义。
2 结果
2.1 血流动力学指标 与IR组比较,DAPT组各时间点LVDP、+dp/dtmax均明显降低(P<0.01);与对照组比较,DAPT组加药10 min内心率减慢,而LVDP、+dp/dtmax升高(P <0.01),药物去除后,LVDP和+dp/dtmax逐渐恢复到正常水平,各项指标与对照组比较差异无统计学意义。各组缺血前后相关指标比较见表1。
2.2 MI面积 各组MI面积比较见图1。
2.3 冠脉流出液LDH水平 Cur组明显低于IR组(P<0.01);Cur+DAPT组明显高于 Cur组(P<0.01);DAPT组与IR组比较无统计学差异,见图2。2.4 心肌组织Notch1蛋白表达 Cur组明显高于IR组(P<0.01);Cur+DAPT组明显低于Cur组(P<0.01);DAPT组明显低于 IR 组(P <0.01),见图3。
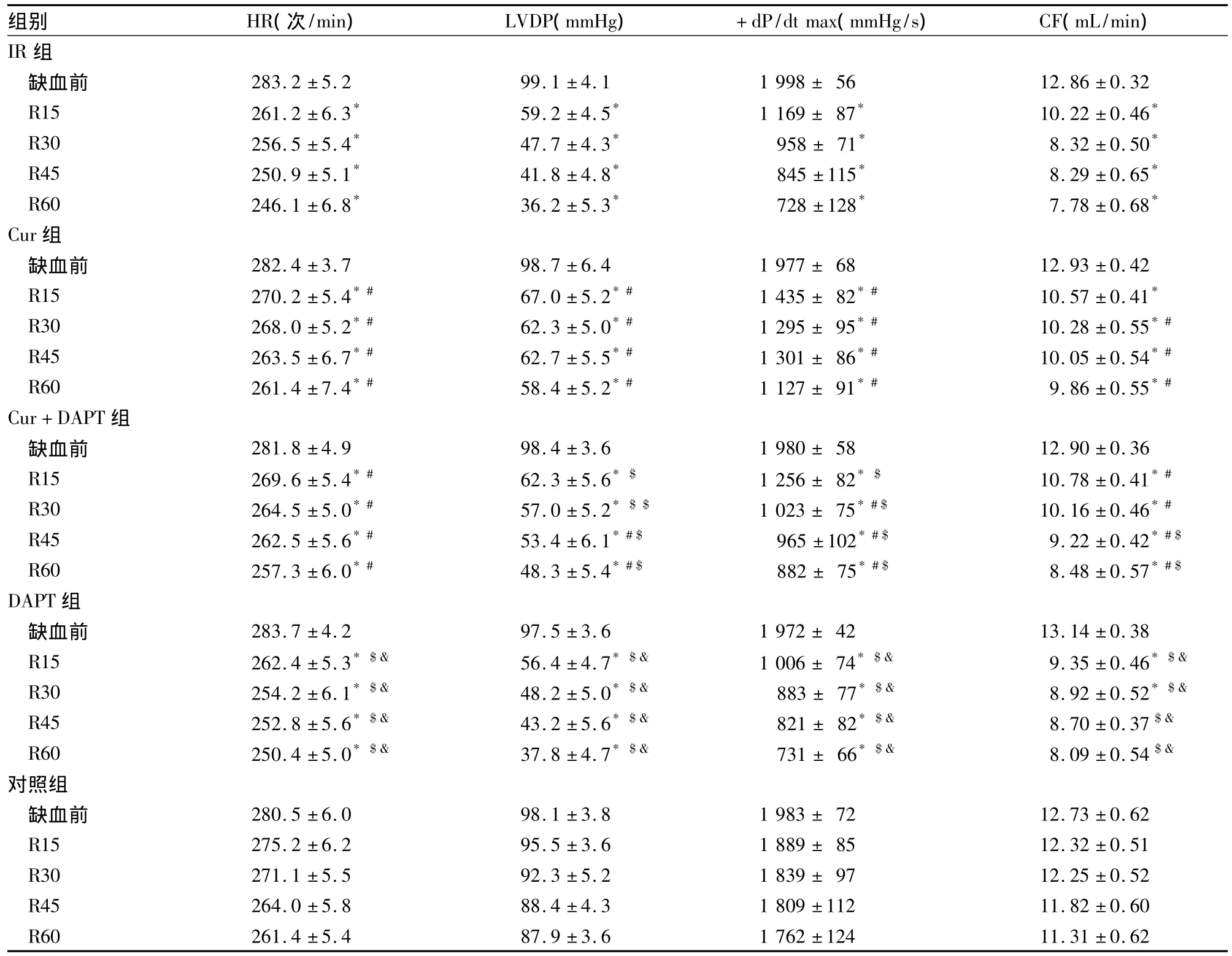
表1 各组心脏血流动力学指标比较(n=8,¯x±s)
3 讨论
缺血性心脏病治疗的核心是重新恢复心肌血液供应,但缺血心肌组织重新恢复血供(再灌注)后常继发和加重心肌组织损伤,即心肌IR[1],常导致患者死亡、预后不良、严重并发症发生。心肌IR的病理机制复杂,很多信号通路和细胞因子参与其中[1,11~13]。
研究发现,Notch信号通路在心血管系统发生、发育、病理和生理过程中发挥重要作用[5],可能在心肌梗死后心肌保护中发挥调控作用[6,7];Cur可通过Notch信号通路抑制肿瘤细胞增殖并促进肿瘤细胞凋亡[8~10]。药物后处理是对抗心肌IR的有效方法[14,15]。Cur是从 Cur科、Cur属植物的根茎中提取的一种天然有效成分,分子式为C21H20O6,毒性作用小,安全范围大[16]。Cur具有抗氧化、抗感染、抗炎、抗凝、降血脂、抗心力衰竭、抗心肌肥厚及抗动脉粥样硬化等多种心血管效应,且毒性作用小、经济、安全,尤其是其具有明确的抗IR、保护心肌作用极具研究价值和开发前景的中药[17,18]。我们在前期研究中发现,Cur后处理可以有效拮抗心肌IR损伤,但具体机制尚未完全阐明。

图1 各组MI面积比较
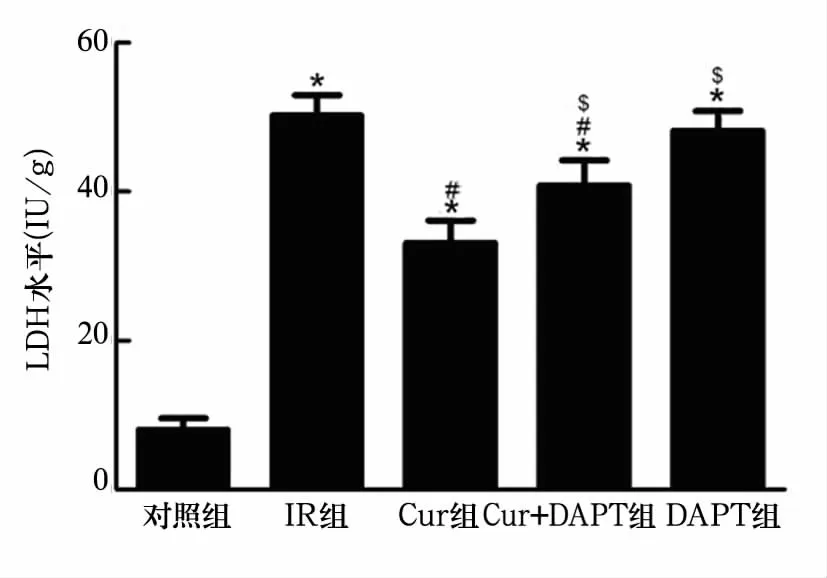
图2 各组冠脉流出液中LDH水平比较

图3 各组心肌组织Notch1蛋白表达比较
有报道,心梗后晚期Notch信号通路关键分子NICD(Notch-1分子胞内区)在心梗边缘区(缺血但未坏死,可获得有效再灌注)表达显著上升,即Notch信号通路激活后心功能得到显著改善,提示Notch信号通路激活可能在心肌IR修复中发挥重要调控作用,且与其它信号通路通过复杂的分子网络产生交互作用[19]。本研究得到了相同结果;同时发现激活Notch通路有明确的抗心肌IR作用,其对于抗凋亡相关分子的转录和表达有重要调控作用[20~22];提示Notch信号通路作为重要物质基础参与了调控心肌的IR过程,激活Notch信号通路具有抗心肌IR作用。本研究发现,Notch通路在心肌急性IR过程中被抑制,而心梗晚期Notch通路活化参与损伤修复过程。进一步证实Notch信号通路可能在心肌梗死后的心肌保护中发挥调控作用[23]。研究显示,Cur可通过Notch信号通路抑制食管肿瘤、口腔肿瘤和胰腺肿瘤细胞增殖并促进肿瘤细胞凋亡[8~10];因此本实验观察了 DAPT对 Cur后处理心肌保护作用的影响。LDH广泛存在于心肌细胞内,当细胞受损时,细胞内酶释放到细胞外,使血清酶升高,故LDH水平可作为判断心肌损伤程度的一项重要指标[12,19]。本研究结果显示,Cur后处理可改善心脏血流动力学指标,减小MI面积,降低冠脉流出液中LDH释放量。DAPT作为Notch信号通路的特异性阻断剂可消除Cur后处理对心肌IR的保护作用,表现为心脏血流动力学减弱、MI面积增加、冠脉流出液中LDH释放量增加。由此我们推测:Notch信号通路参与介导了Cur后处理抗心肌IR作用,其调控机制有待进一步研究。
本研究为Notch信号通路参与药物后处理心肌保护作用提供了理论依据,有利于寻找全新的药物作用靶点对心肌IR的主要作用环节进行干预,对于获得全新的心肌保护方法提供了新的思路。
[1]Botker HE,Kharbanda R,Schmidt MR,et al.Remote ischaemic conditioning before hospital admission,as a complement to angioplasty,and effect on myocardial salvage inpatients with acute myocardial infarction:a randomised trial[J].Lancet,2010,375(9716):727-734.
[2]Kleinbongard P,Schulz R,Heusch G,et al.TNFα in myocardial ischemia/reperfusion,remodeling and heart failure[J].Heart Fail Rev,2011,16(1):49-69.
[3]杨阳,段维勋,金振晓,等.姜黄素对血管内皮细胞过氧化氢损伤的保护作用及其机制研究[J].中国体外循环杂志,2011,9(4):239-242.
[4]Duan W,Yang Y,Yan J,et al.The effects of curcumin posttreatment against myocardial ischemia and reperfusion by activation of the JAK2/STAT3 signaling pathway[J].Basic Res Cardiol,2012,107(3):1-12.
[5]杨阳,段维勋,周京军,等.γ-分泌酶抑制剂对正常乳鼠心肌细胞的影响[J].中国体外循环杂志,2011,9(2):89-92.
[6]Mohamed Nemir,Thierry Pedrazzini.Functional role of Notch sig-naling in the developing and postnatal heart[J].J Mol Cell Cardiol,2008,45(4):495-504.
[7]Qie E,Sandberg WJ,Ahmed MS,et al.Activation of Notch signaling in cardiomyocytes during post-infarction remodeling[J].Scand Cardiovasc J,2010,44(6):359-366.
[8]Subramaniam D,Ponnurangam S,Ramamoorthy P,et al.Curcumin induces cell death in esophageal cancer cells through modulating Notch signaling[J].PLoS One,2012,7(2):e30590.
[9]Liao S,Xia J,Chen Z,et al.Inhibitory effect of curcumin on oral carcinoma CAL-27 cells via suppression of Notch-1 and NF-κB signaling pathways[J].J Cell Biochem,2011,112(4):1055-1065.
[10]Wang Z,Zhang Y,Banerjee S,et al.Notch-1 down-regulation by curcumin is associated with the inhibition of cell growth and the induction of apoptosis in pancreatic cancer cells[J].Cancer,2006,106(11):2503-2513.
[11]Gude NA,Emmanuel G,Wu W,et al.Activation of Notch-mediated protective signaling in the myocardium[J].Circ Res,2008,102(9):1025-1035.
[12]Wang N,Min X,Li D,et al.Geranylgeranylacetone protects against myocardial ischemia and reperfusion injury by inhibiting high-mobility group box 1 protein in rats[J].Mol Med Report,2012,5(2):521-524.
[13]Huffmyer J,Raphael J.Physiology and pharmacology of myocardial preconditioning and postconditioning[J].Semin Cardiothorac Vasc Anesth,2010,13(1):5-18.
[14]Takada Y,Hashimoto M,Kasahara J,et al.Cytoprotective effect of sodium orthovanadate on ischemia/reperfusion-induced injury in the rat heart involves Akt activation and inhibition of fodrin breakdown and apoptosis[J].J Pharmacol Exp Ther,2004,311(3):1249-1255.
[15]Maulik SK,Seth SD,Manchanda SC,et al.Effect of verapamil post-treatment in myocardial reperfusion injury[J].Indian J Exp Biol,1993,31(2):120-124.
[16]Wang L,Li C,Guo H,et al.Curcumin inhibits neuronal and vascular degeneration in retina after ischemia and reperfusion injury[J].PLoS One,2011,6(8):e23194.
[17]Fiorillo C,Becatti M,Pensalfini A,et al.Curcumin protects cardiac cells against ischemia-reperfusion injury:effects on oxidative stress,NF-kappaB,and JNK pathways[J].Free Radic Biol Med,2008,45(6):839-846.
[18]Weissenberger J,Priester M,Bernreuther C,et al.Dietary curcumin attenuates glioma growth in a syngeneic mouse model by inhibition of the JAK1,2/STAT3 signaling pathway[J].Clin Cancer Res,2010,16(23):5781-5795.
[19]Zhang L,Ma J,Liu H.Protective effect of ischemic postconditioning against ischemia reperfusion-induced myocardium oxidative injury in IR rats[J].Molecules,2012,17(4):3805-3817.
[20]Gude NA,Emmanuel G,Wu W,et al.Activation of Notch-mediated protective signaling in the myocardium[J].Circ Res,2008,102(9):1025-1035.
[21]杨阳,段维勋,梁振兴,等.Jagged1蛋白对乳鼠心肌细胞缺氧复氧损伤的作用[J].中国体外循环杂志,2012,10(4):43-46.
[22]杨阳,段维勋,梁振兴,等.γ-分泌酶抑制剂对大鼠离体心脏缺血再灌注损伤的作用[J].中国体外循环杂志,2012,10(4):249-252.
[23]杨阳,段维勋,金振晓,等.缺血/再灌注前后人心肌组织中Notch信号通路相关分子的变化[J].中国体外循环杂志,2010,9(12):235-237.
[24]Ahmed I,Chandrakesan P,Tawfik O,et al.Critical roles of Notch and Wnt/β-catenin pathways in the regulation of hyperplasia and/or colitis in response to bacterial infection[J].Infect Immun,2012,80(9):3107-3121.
