六星黑点豹蠹蛾求偶行为与性信息素产生和释放的时辰节律
2013-08-02刘金龙荆小院杨美红宗世祥骆有庆范丽华刘红霞张金桐
刘金龙,荆小院,杨美红,宗世祥,骆有庆,范丽华,刘红霞,张金桐,*
(1.山西农业大学化学生态研究所,太谷 030801;2.北京林业大学省部共建森林培育与保护教育部重点实验室,北京 100083)
六星黑点豹蠹蛾Zeuzera leuconotum Butler是一种重要的园林害虫[1],俗称截杆虫。主要危害花灌木和乔木的枝梢,可造成林木死亡[2],严重影响园林绿化效果。许多昆虫的发育、行为和代谢均受时辰节律的控制[3],与其内分泌系统有关[4-7],其中昆虫性信息素的产生和释放是昆虫繁殖过程中产生性行为的重要环节,因此研究其时辰节律对于性信息素的提取和鉴定有重要的参考价值,也是利用其性信息素监测和防治害虫研究中的重要内容。目前,关于六星黑点豹蠹蛾的性信息素产生与释放的时辰节律尚未见报道,近年来,作者对其生殖行为进行了全面观察[8],并利用腺体提取,瓶内收集、触角电位技术以及林间处女蛾引诱试验等方法,对六星黑点豹蠹蛾产生和释放性信息素的时辰节律进行了研究,为进一步开展性信息素化学组分的提取、鉴定,以及应用研究奠定了基础。
1 材料与方法
1.1 供试昆虫
六星黑点豹蠹蛾的老熟幼虫和蛹采自山东东营市黄河路两旁绿化带白蜡树。剪下白蜡树受害枝条,保留长度为30—60cm的有虫树枝,带回养虫室(2m×2.5m×2m),绑缚于横挂的铁丝上,模拟树体状态饲养,养虫室光周期L∶D=14∶10,光期5:00开始,19:00结束,温度19—32℃,相对湿度75%—85%,保持自然通风,待其羽化,鉴别雌雄后分别置于养虫笼(50cm×50cm×60cm),保证雌蛾全部为处女蛾,并且明确虫龄(成虫羽化后至第1个暗期结束视为1日龄)。
1.2 六星黑点豹蠹蛾求偶行为及其时辰节律的观察
在自然条件下的养虫室内,将10头同日龄处女雌蛾放养于同一纱罩养虫笼(80cm×80cm×80cm)中,笼内置插在水瓶中的新鲜白蜡树枝,底部铺一层白蜡树叶,供雌蛾飞舞或爬行,观察雌蛾的求偶行为及其时辰节律。据观察,六星黑点豹蠹蛾交配均在暗期[8],故只在暗期观察和记录雌蛾求偶情况,以红色灯为观察光源。重复3次。在暗期每隔1h观察1次,连续观察6d,记录求偶头数,按每2h的求偶率进行统计分析。
1.3 性信息素产生与释放时辰节律的测定
利用雄蛾的触角电位反应(EAG)检测雌蛾性信息素产生和释放的时辰节律。性信息素提取物的制备分为腺体提取和瓶内收集两种方法。以雄蛾对腺体提取物的EAG值表示性信息素的产生量;对瓶内收集物的EAG值表示性信息素的释放量。
1.3.1 腺体提取
通过对雌蛾腹尖的扫描电镜与组织切片的观察,得知其性信息素分泌腺位于第8—9腹节之间的节间膜上。根据其生殖行为特征[8],六星黑点豹蠹蛾在进入暗期5—8 h交配率最高,故选择在暗期5h提取其腺体。提取时,用手轻轻挤压雌蛾腹部,待其第8—9腹节完全伸出腹尖,用眼科手术剪快速剪下,放入5mL的具塞尖底试管中,加入0.5mL重蒸正己烷,盖紧瓶塞,室温下浸泡1h后,抽取提取液并转移至样品管中,密封,置于冰箱内(-4℃以下)贮存备用。
1.3.2 瓶内收集
参照张金桐[9]和李连昌[10]报道的方法收集雌蛾释放的性信息素。将不同处理下的处女雌蛾放入具磨口玻璃塞的25 mL洁净干燥的鸡心瓶中,1瓶1虫,瓶塞与磨口之间加一细铜丝,既可保障瓶内雌蛾正常呼吸,又可防止瓶中雌蛾释放的性信息素向外扩散。按照实验设计要求,在不同的时辰将鸡心瓶从培养条件下取出,立刻放入冰箱(-10℃),冷冻15min,小心取出雌蛾,向瓶内加入2mL重蒸正己烷,加塞后反复摇动,以便将瓶壁上和空气中的性信息素充分洗脱。每一处理,重复5头雌蛾。合并收集液,经氮吹浓缩至一定体积后转移到样品管中,密封,置于冰箱内(-4℃以下)贮存备用。
1.3.3 触角电位测定
触角电位测定仪由荷兰Syntech公司生产。测定条件:连续气体流量为124mL/min,刺激气体流量为20mL/min,刺激时间为0.1s,刺激间隔60 s。
参照张金桐报道的方法[9],取2日龄未交配雄蛾,将触角从基部剪下,用刀片去掉触角两端的角质层后,用Beadle-Ephrussi生理液将其两端湿润,分别与参比电极和记录电极相连,使电路导通,微调触角与电极之间的连接使基线平稳,即可开始测定。先将滤纸条(2cm×0.5cm)纵折一下,部分插入巴斯德管端口,用微量注射器吸取一定量待测试液,滴在滤纸条上,待溶剂挥发后将其完全推入,进行触角电位测定。
测定时,各处理提取液的测定顺序是随机的。为消除触角因适应而导致的偏差,在每一样品测定前后,均以20μL正己烷为空白对照,分别测量空白值,取其平均值为该样品的平均空白值,以样品的平均反应值减去平均空白值,得触角对样品的绝对反应值。样品均在同一根触角上平行测定3次,计算测定的平均值。每只雄蛾只取用1根触角。共测试6根触角为重复,进行统计分析。
1.3.4 雄蛾对不同性信息素浓度的反应曲线的测定
按1.3.1方法,选取20头处女雌蛾,将腺体依次剪下,置于5mL具塞尖底试管中,加入1mL重蒸正己烷浸泡1h后,抽取750μL提取液于另一试管,氮吹浓缩至300μL,得浓度为1 FE/20μL(FE:female equivalent,雌当量)正己烷溶液。以此为母液分别配制10,1,10-1,10-2,10-3,10-4,10-5FE/20μL的样品溶液,其中10 FE/20μL是将200μL母液氮吹浓缩至20μL制成。以20μL正己烷为对照,按照浓度由低到高的顺序进行触角电位测定。
1.3.5 性信息素产生与释放的日动态规律
通过检测不同日龄处女雌蛾进入暗期后5h所产生和释放的性信息素量来确定日动态节律。腺体提取时,以100μL正己烷提取5头同一日龄雌蛾的腺体,得浓度为1FE/20 μL的性信息素提取液。同时取5头处女雌蛾分别进行单虫瓶内收集,亦制备成1FE/20 μL的性信息素收集液。每个处理重复3次。以正己烷为对照。
1.3.6 性信息素产生与释放的时辰节律
通过检测2日龄处女雌蛾在不同时辰所产生和释放的性信息素量来确定时辰节律。分别于光期2,6,10,14h 和暗期1,2,3,4,5,6,7,8,9h 选取 5 头 2 日龄处女雌蛾进行腺体提取,同上制备成 1FE/20 μL 的性信息素提取液。同时在各个时辰选取5头雌蛾分别进行单虫瓶内收集,同上制备成1FE/20 μL的性信息素收集液。每个处理重复3次。以正己烷为对照。
1.4 林间处女蛾诱蛾试验
在山东东营市黄河路绿化带进行林间诱蛾试验。采用三角形诱捕器(黑色塑料瓦楞板制成,截面30cm×30cm×30cm,棱长40cm),将涂有粘虫胶的蜡纸板插入诱捕器内。将1头2日龄处女雌蛾装入自制小纱笼(5cm×5cm×5cm)内,由细铁丝从诱捕器上棱中间垂下,距粘胶面约2cm。诱捕器悬挂在白蜡树枝上,距地面3—4m,以仅有粘虫胶板的诱捕器为对照,设3个重复,诱捕器间距20m以上,随机顺序布置。每2h记录1次所诱捕的雄蛾数量,计算占全天诱蛾总量的百分率,并统计分析。
1.5 数据分析
数据采用SPSS17.0统计软件中单因素方差分析(One-Way ANOVA)进行分析处理,用Duncan法检验差异显著性。
2 结果与分析
2.1 六星黑点豹蠹蛾求偶行为及其时辰节律
2.1.1 雌蛾的求偶行为
经过林间及观测笼内的观察,六星黑点豹蠹蛾于暗期进行求偶和交配活动,其余时间在树干或树枝隐蔽处静伏。静伏时,雌蛾翅呈屋脊状覆盖于腹部,腹尖偶尔套缩于第7腹节内,而大部分时间腹尖暴露于体外。在暗期5—7h,雌蛾出现求偶行为,求偶过程表现为:雌蛾由静伏变为在枝干上四处爬动,两翅微向两侧外伸且伴随轻微振动;爬行片刻后,两翅振动速度明显加快,但不起飞,爬行范围也逐渐减小,腹部末端翘起,第8腹节和产卵器伸直;原地剧烈振翅,第8—9腹节继续伸直,最终向上翘起或左右摆动,第8—9腹节节间膜已完全伸展,若无干扰或交配,可保持30min左右。在此期间,被隔离的雄蛾表现为:触角竖立,腹部摆动,或迅速爬行,或定向飞往雌蛾,在雌蛾周围振翅、爬行,腹部侧向左右弯曲,不时伸出抱握器,作出企图交配的姿态。表明求偶是雌性成虫的一种自发性行为,也是完成其生殖交配的必需过程,同时求偶也具有一定的时间性。因此本研究以腹部上翘、产卵器伸直并伴随着振翅作为标准,判断雌蛾是否求偶。
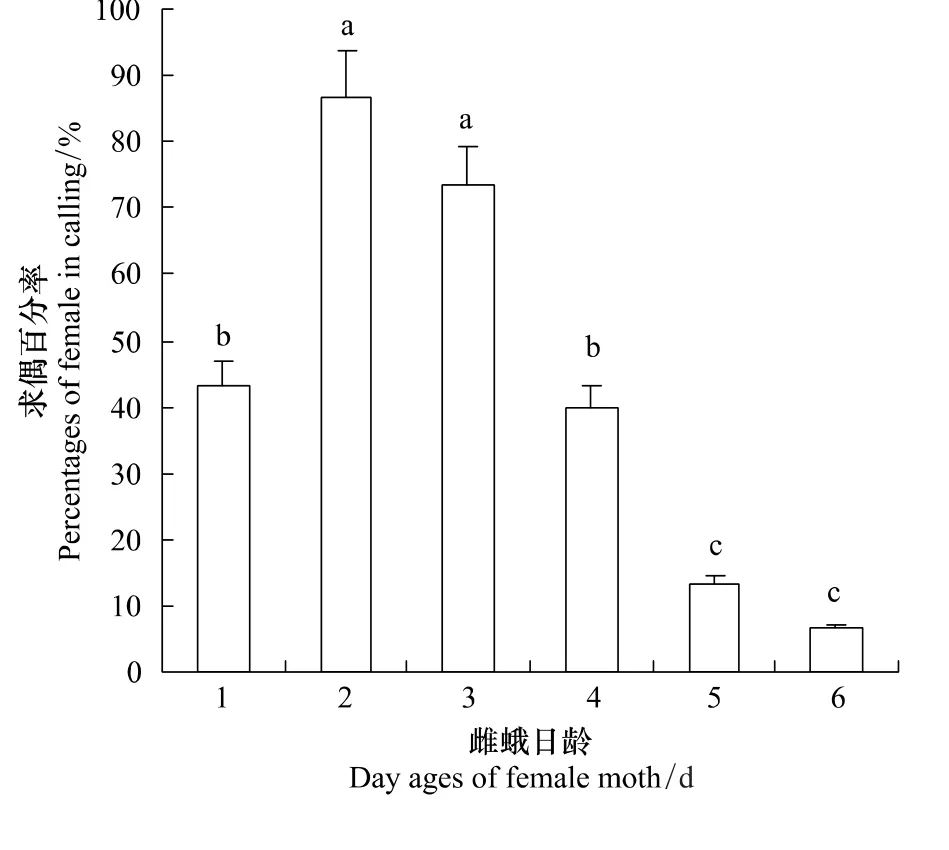
图1 不同日龄雌蛾的求偶百分率Fig.1 The percentages of calling female Z.leuconotum of different ages
2.1.2 六星黑点豹蠹蛾日龄与求偶率的关系
在自然条件下的养虫室内,不同日龄雌蛾求偶率的统计结果如图1所示。
可以看出,雌蛾在羽化当天即可发生求偶行为,求偶率为43.3%;2—3日龄雌蛾求偶率最高,分别为86.7%和73.3%,与其它日龄求偶率相比差异显著(P<0.05);4日龄求偶率明显下降,到6日龄仅有6.7%的雌蛾出现求偶行为。表明雌蛾在羽化1d后达性成熟,求偶行为在羽化后1—3d表现强烈,雌蛾日龄对求偶率有影响。六星黑点豹蠹蛾雌蛾成虫期平均为6d,由此可推测求偶行为与雌蛾的生理活力相关,雌蛾的发育状况是求偶行为的内在制约因子[11]。
2.1.3 求偶行为的时辰节律
六星黑点豹蠹蛾的求偶率不仅受到日龄的影响,而且在同一天内不同时辰求偶率也不一致。经观察其求偶行为仅在暗期,而且有时辰规律,因此在暗期观察和记录各日龄处女雌蛾的求偶行为,按每2h的求偶率进行统计分析,分析结果列于表1。

表1 六星黑点豹蠹蛾雌蛾求偶行为的时辰节律Table 1 The calling rhythm of female Z.leuconotum
可以看出,雌蛾求偶行为最早发生在进入暗期3h内,主要是3—6日龄雌蛾;最晚发生在暗期7—9h,主要是1—2日龄雌蛾;最大求偶率出现在第2和3日龄的暗期5—7h之间;各日龄雌蛾求偶率随时辰有所变化,从暗期开始到结束均表现为求偶率先低后高再逐渐减少的趋势,其中1—3日龄均在进入暗期5—7h期间求偶率最大,与其它时辰差异达到显著水平(P<0.05),说明六星黑点豹蠹蛾求偶行为有一定的时辰节律。由表1还可以看出,求偶时间随日龄的增加逐渐提前,为进一步了解各日龄求偶时间的差异,经加权平均法计算出求偶高峰期,以进入暗期的时间(加权平均值±标准差)表示:1—6日龄雌蛾求偶高峰期依次为(5.92±1.21)h,(5.68±2.22)h,(5.04±1.37)h,(4.79±0.68)h,(4.57±0.83)h,(4.50±0.58)h。表明,六星黑点豹蠹蛾的求偶行为存在时辰节律,而且与雌蛾日龄有关,这一点与其交配行为的时辰节律[8]具有一致性。
2.2 性信息素产生与释放的时辰节律
2.2.1 雄蛾对性信息素提取物的EAG反应
以2日龄处女雌蛾和雄蛾为测试对象,进行触角电位测定。测得雄蛾对不同浓度性信息素分泌腺提取物的触角电位反应如图2。
可以看出,六星黑点豹蠹蛾雄蛾对性信息素提取物有较强的触角电位反应,其中对样品溶液能产生触角电位的起始浓度为 10-4FE/20μL,反应阈值在 10-4—10-2FE/20μL之间,而在 10-1—101FE/20μL之间触角电位反应较强,可见雄蛾触角对此浓度范围的提取物反应敏感。因此本研究选用1FE/20μL的腺体提取物作为标准刺激浓度,触角电位高于阈值,但也不太强,不会因多个样品的重复测试而引起触角敏感性降低。
2.2.2 性信息素产生与释放的日动态规律
由图3的触角电位测定结果可以看出,雄蛾对1日龄处女雌蛾的腺体提取物和瓶内收集物均有电生理反应;对2日龄处女雌蛾的反应最为强烈(5.1 mV,3.9 mV),与其它日龄达差异显著水平(P<0.05);对3日龄的反应也较高,但随后明显降低。结果表明:羽化当晚雌蛾体内即可产生性信息素,并向体外释放,但性信息素量较少;羽化第2天产生和释放的性信息素量最多,以后逐日下降。这个结果与求偶率随日龄的变化规律是一致的,推测六星黑点豹蠹蛾羽化后即性成熟,在其召唤求偶时,通过释放体内产生的性信息素引诱雄蛾来完成交配行为。

图2 雄蛾对不同浓度性信息素粗提物的EAG反应曲线Fig.2 EAG response(mean ±SD)of male to female sex pheromone content
2.2.3 性信息素产生与释放的时辰节律
雄蛾对不同时辰处女雌蛾的触角电位反应测试结果见图4,可以看出,雄蛾对暗期3h之前的腺体提取物反应逐渐增强,但是对瓶内收集物的反应很弱;雄蛾对暗期4h的腺体提取物反应明显增强,且对暗期5h时提取物的反应最为强烈,之后逐渐减弱。对暗期4h时瓶内收集物有反应,随后逐渐增强,而且对暗期6h时收集物的反应最为强烈,之后逐渐减弱。结果表明,雌蛾腺体中的性信息素含量从进入暗期后逐渐增加,在暗期5h时含量最大,随后逐渐减少,而雌蛾释放性信息素从暗期4h开始,至暗期6h时达到高峰,这也就说明了雌蛾腺体性信息素含量变化曲线(图4)在暗期4h时出现拐点以及从5h到9h逐渐减少的原因。由此可见,六星黑点豹蠹蛾雌蛾存在有性信息素产生和释放的时辰节律:产生量的峰值在暗期5h,而释放量的峰值在暗期6h,与求偶行为的时辰节律存在一致性。
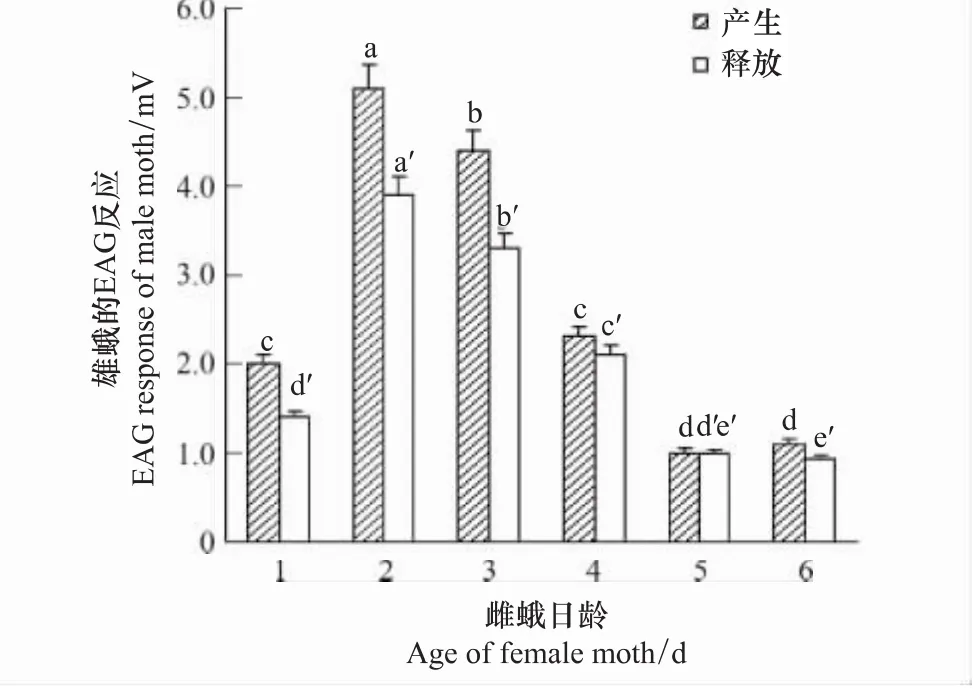
图3 雄蛾对不同日龄处女雌蛾的腺体提取物和瓶内收集物的触角电位反应(暗期5h)Fig.3 The EAG response(mean ± SD)of male to the gland extract and collection sex pheromone of 1—6 old virgin females at the 5th hour into scotophase

图4 六星黑点豹蠹蛾性信息素产生与释放的时辰节律(2日龄)Fig.4 Circadian rhythm of the sex pheromone production and release(2-d-old)
2.3 林间诱捕试验结果
利用处女蛾不同时辰的诱蛾量也可以反映雌蛾释放性信息素的时辰节律。由2日龄处女雌蛾在林间不同时间的诱蛾百分率(表2)可以看出,在光期雌蛾不能诱到雄蛾,进入暗期诱蛾量逐渐增加,诱蛾高峰出现在0:00—2:00(暗期5—7h)期间。进一步证明六星黑点豹蠹蛾雌蛾产生和释放性信息素存在时辰节律,而且具有一致性。
3 结论与讨论
求偶是昆虫完成其生殖交配的必需过程,是一种自发行为,通常呈现出一定的昼夜节律性,并且这种节律受到外界因子的调节[18]。对六星黑点豹蠹蛾求偶行为的研究表明,处女雌蛾求偶率受日龄的影响,其中2日龄雌蛾求偶率最高,平均为86.7%。同日龄雌蛾的求偶行为存在明显的时辰节律,求偶高峰期出现在进入暗期5—7 h。从不同日龄求偶行为时辰节律的比较分析可知,雌蛾的求偶行为具有一定的时序性:随着虫龄的增加,其求偶时间逐渐提前,求偶高峰期前移,但求偶率逐渐减小。这一现象与其它鳞翅目昆虫,如小地老虎Agrotis ypsilon[12]、豆野螟 Maruca vitrata[13]、榆木蠹蛾 Holcocerus vicarius[14]、Lonomia oblique[15]等的求偶行为相似,Swier认为老龄处女雌蛾通过提前求偶的时间来提高与幼龄处女蛾的竞争能力,以增加对雄蛾的引诱几率[16],六星黑点豹蠹蛾求偶行为也符合这种适应性的生殖策略。

表2 2日龄处女雌蛾在林间不同时间的诱蛾试验(山东东营,2011年6月)Table 2 Percentage of the male trapped by 2-day-old virgin female moth during different time of the day in the field(Dongying,Shandong;June,2011)
昆虫求偶时,通过向体外释放性信息素以引诱同种异性前去交配。许多鳞翅目昆虫性信息素的产生和释放存在时辰节律,如大袋蛾 Clania variegate[19]、枣粘虫 Ancylis sativa[10]、小线角木蠹蛾 Holcocerus insularis[9]、甜菜夜蛾Spodoptera exigua[21]、沙棘木蠢蛾Holcocerus hippophaecolus[20]等,这些蛾类的性信息素产生和释放仅在一天的某一个时间段。本文试验结果表明,六星黑点豹蠹蛾羽化当晚雌蛾体内即可产生性信息素,并且向体外释放,羽化第2d产生和释放的性信息素量最多,以后逐日下降;在一天中,雌蛾腺体中的性信息素从进入暗期后逐渐增加,在暗期5h时量最大,随后逐渐减少,而释放性信息素从暗期4h开始,至6h时达到高峰。处女雌蛾林间诱蛾试验表明:诱蛾高峰出现在暗期5—7h期间,而且2日龄处女雌蛾的诱蛾效果最好[8],这些结果都验证了六星黑点豹蠹蛾性信息素的释放也存在着一定的时辰节律。
Haynes等[6]和Pope等[22]通过对于Platyptilia carduidoctyla和 Heliothis zea的生殖行为生理学的研究证实,许多昆虫的羽化、交配和性信息素的产生与释放均存在协同性。Mazor&Dunkelblum总结了许多鳞翅目昆虫的求偶交配行为与性信息素的产生和释放的关系[17],都表现出这些方面节律上的一致性。六星黑点豹蠹蛾雄蛾对性腺体提取和瓶内收集性信息素所产生的EAG反应曲线(图4)表明,2日龄雌蛾性信息素产生量的峰值在暗期5 h,释放量的峰值在暗期6h,而求偶高峰期在进入暗期5.68h,三者之间存在着一定的一致性。性信息素的产生略提前于释放,这个结果与Delisle等对Pseudaletia unipuncta以及Snir等对Chrisodeixis chalcites的研究结果相似[23-24],推测形成这种差异的可能原因是,雌蛾求偶行为需要体内性信息素达到一定数量才可以启动,也反映出体内合成性信息素早于求偶交配行为。
不少学者认为昆虫生殖行为的时辰节律是通过内分泌系统进行控制的[4-7]。本研究表明,雌蛾日龄对其时辰节律均有明显的影响。由于各日龄雌蛾个体发育状况和性成熟程度不一致,可见六星黑点豹蠹蛾的时辰节律首先是由其内在的生理因素决定的。值得注意的是昆虫的行为节律也受到环境温度、光周期、湿度等生态因子的影响[25]。一天内雌蛾求偶和性信息素产生与释放的高峰期是由时间决定,还是由光周期或温度决定,或者是由这些生态因子协同作用决定的,尚需做进一步的研究。
了解性信息素产生和释放的时辰节律,有利于把握提取性信息素的最佳时机,为性信息素的化学鉴定提供可靠依据。六星黑点豹蠹蛾求偶行为及其性信息素的产生和释放的时辰节律是其生殖行为的重要环节,也是将来利用其性信息素进行防治实践所涉及的理论基础和依据。
致谢:在采集试验用虫和林间试验期间,山东农业大学植保学院周成刚教授和山东东营胜利油田管理局公共事业部杨玉武先生提供帮助,特此致谢。
[1]Hua B Z,Zhou Y,Fang D Q,Chen S L.Chinese Cossidae(Lepidoptera:Cossidae).Xian:Tianze Publish House,1990:62-64.
[2]Yin H G,Gao P,Guo S R,Li Y,Li Z B,Dong X.Investigate of life history about Zeuzera leuconolum Butler Tianjin.Journal of Hebei ForestScience and Technology,2009(2):16-17.
[3]Saunder D S.Insect Clock.New York:Pergamon,1982:337-364.
[4]Smith P H.Circadian control of spontaneous flight activity in the blowfly Lucilia cuprina.Physiological Entomology,1983,8(1):72-73.
[5]Webster R P,Conner W E.Effects of temperature,photoperiod and light intensity on the calling rhythm in arctiid moth.Entomologia Experimentalis et Applicata,1986,40:239-245.
[6]Haynes K F,Gaston L K,Pope M M Baker T C.Rate and periodical of pheromone release from individual female artichoke plume moths,Platyptilia carduidactyla(Lepidoptera:Pterophoridae).Environmental Entomology,1983,12:1597-1600.
[7]Giebultowicz J N,Webb R E,Rsina A K.Effect of temperature and age on daily changes in pheromone titre in laboratory reared and wild gypsy moths,Lymantria dispar.Environmental Entomology,1992,21:822-826.
[8]Liu J L,Zong S X,Zhang J T,Jing X Y,Liu H X,Lu Y L.Reproductive behavior character and sexual tendency of the adult Zeuzera leuconotum Butler(Lepidoptera:Cossidae).Acta Ecologica Sinica.2011,31(17):4919-4927.
[9]Zhang JT,Meng XZ,Sexual behavior of Holcocerus insularis and circadian rhythm of its sex pheromone production and release.Acta Entomologica Sinica,2001,44(4):428-432
[10]Li L C,Fan Y L,Ren Z L.Study on the sexual behavior circadian rhythm of jujube leaf roller moth Ancylis sativa Liu.Scientia silvae sinicae,1991,27(2):145-148.
[11]Blomquist G J,Dillwith J W.Pheromones:biochemistry and physiology.In:Downer RGH,Laufer H eds.Endocrinology of Insects.New York:Alan R Liss,Incorporation,1983:527-542.
[12]Xiang Y Y,Yang M F,Li Z Z.Calling behavior and rhythms of sex pheromone production in the black cutworm moth in china.Journal of Insect Behavior,2010,23:35-44.
[13]Lu P F,Qiao H L,Wang X P,Zhou X M,Wang X Q,Lei C L.Adult behavior and circadian rhythm of sex pheromone production and release of the legume pod borer,Maruca vitrata(Fabricius)(Lepidoptera:Pyralidae).Acta Entomologica Sinica,2007,50(4):335-342.
[14]Yang M H,Zhang J T,Liu J L,Jing X Y,Luo Y Q,Zong S X,Cao C J,Li Y H.Reproductive behavior and circadian rhythm of sex pheromone production and release of Holcocerus vicarius Walker(Lepidoptera:Cossidae).Acta Entomologica Sinica,2010,53(11):1273-1280.
[15]Zarbin P H G,Lorini L M,Ambrogi B G,Vidal D M,Lima E R.Sex pheromone of Lonomia obliqua:daily rhythm of production,identification,and synthesis.J Chemical Ecology,2007,33:555-565.
[16]Swier S R,Rings R W,Musick G J.Age-related calling behaviour of the black cutworm Agrotis ipsilon.Annals of the Entomological Society of America,1977,70:919-924.
[17]Michal Mazorl,Ezra Dunkelblum.Circadian rhythms of sexual behavior and pheromone titers of two closely related moth species:Autographa gamma and Cornutiplusia.J Chemical Ecology,2005,31:2153-2168.
[18]Giebultowicz J,Raina A K,Uebel E C.Two step regulation of sex pheromone decline in mated gypsy moth females.Arch Insect Biochem Physiol,1991,16:95-105.
[19]Zhao B G.Circadian rhythm and endocrine control of sex pheromone secretion in Clania variegate Snellen(Lepidoptera:Psychidae).Acta Entomologica Sinica,1988,31(3):236-242.
[20]Zong S X,Luo Y Q,Lu C K,Xu Z C,Zhang L S.Preliminary study on biological characteristic of Holcocerus hippophaecolus.Scientia Silvae Sinicae,2006,42(1):79-84.
[21]Dong S L,Du J W.Effects of experience and temperature on sex pheromone production of beet armyworm,Spodoptera exigua.Chinese Journal of applied ecology.2002,13(12):1633-1636.
[22]Pope M M,Gaston L K,Baker T C.Composition,quantification and periodicity of sex pheromone volatiles from individual Heliothis zea females.Journal of Insect Physiology,1984,30:943-945.
[23]Delisle J,Mcneil J N.Calling behavior and pheromone titer of the true armyworm Pseudaletia unipuncta(Haw.)(Lepidoptera:Noctuidae)under different temperature and photoperiod conditions.Journal of Insect Physiology,1987,33:315-324.
[24]Snir R,Dunkelblum E,Gothilf S,Harpaz I.Sexual behavior and pheromone titer in the tomato looper,Plusia chalcites(Esp.)(Lepidoptera:Noctuidae).Journal of Insect Physiology.1986,32:735-739.
[25]McNeil J N.Behavioral ecology of pheromone-mediated communication in moths and its importance in the use of pheromone traps.Annual Review of Entomology,1991,36:407-430.
参考文献:
[1]花保祯,周尧,方德齐,陈树良.中国木蠹蛾志(鳞翅目:木蠹蛾).西安:天则出版社,1990:62-64.
[2]尹鸿刚,高鹏,郭淑荣,李燕,李子博,董晓.天津地区六星黑点豹蠹蛾生活史调查.河北林业科技,2009,(2):16-17.
[8]刘金龙,宗世祥,张金桐,荆小院,刘红霞,吕玉里.六星黑点豹蠹蛾成虫生殖行为特征与性趋向.生态学报,2011,31(17):4919-4927.
[9]张金桐,孟宪佐.小木蠹蛾性行为和性信息素产生与释放的时辰节律.昆虫学报,2001,44(4):428-432.
[10]李连昌,樊永亮,任自立.枣粘虫性行为时辰节律的研究.林业科学,1991,27(2):145-148.
[13]陆鹏飞,乔海莉,王小平,周兴苗,汪细桥,雷朝亮.豆野螟成虫行为学特征及性信息素产生与释放节律.昆虫学报,2007,50(4):335-342.
[14]杨美红,张金桐,刘金龙,荆小院,骆有庆,宗世祥,曹川健,李月华.榆木蠹蛾成虫生殖行为及性信息素产生与释放节律.昆虫学报,2010,53(11):1273-1280.
[19]赵博光.大袋峨性信息素分泌的时辰节律和内分泌控制.昆虫学报,1988,31(3):236-242.
[20]宗世祥,骆有庆,路常宽,许志春,张连生.沙棘木蠢蛾生物学特性的初步研究.林业科学,2006,42(1):79-84.
[21]董双林,杜家伟.交配和温度对甜菜夜蛾雌蛾性信息素产生的影响.应用生态学报.2002,13(12):1633-1636.
