干湿交替频率对不同土壤CO2和N2O释放的影响
2013-12-26欧阳扬李叙勇
欧阳扬, 李叙勇
(1. 中国科学院生态环境研究中心城市与区域国家重点实验室,北京 100085;2. 中国科学院研究生院,北京 100049)
全球气候变化的一个重要表征是降雨格局的改变,常常表现为干旱和极端降雨事件的增加,并且交替出现,这种变化特征在干旱、半干旱和地中海气候区表现得尤为明显[1]。甚至在年降水总量较高的地区,由于极端降雨事件的增加,干旱和降雨交替格局也日益显著,这种干湿交替变化深刻影响着陆地生态系统过程,特别是土壤碳(C)、氮(N)的生物地球化学过程,进而强烈地影响着土壤碳、氮的矿化和土壤温室气体的排放[2- 3]。

1 研究区域和研究方法
1.1 研究区概况
野外采样用以进行室内干湿交替控制试验的站点主要位于我国东西主线的气候带上,并全部是中国生态系统研究网络(CERN)站,是沿东西走向的降雨梯度,干旱及半干旱半湿润地区是干湿交替影响的Birch效应最为显著的气候区,我国受季风气候影响,从东到西降雨量和场次降雨频率呈降低趋势;再者,随着我国从半干旱半湿润到干旱地区降雨梯度的变化,也呈现出不同的生态系统类型,据此我们选定四个观测点,分别是北京森林站(位于北京门头沟区东灵山)、安塞农田站(位于陕西安塞县)、内蒙古草原站(位于内蒙古锡林郭勒)和阜康荒漠站(位于新疆阜康县)。
1.2 实验设计
用于该实验的土壤分别取自于北京森林站、内蒙古草地站、长武农田站和阜康荒漠站(土壤基本理化性质如表1),所采集的土壤样品经过7d的平衡培养之后,每个试验样品称取100g(干重)土壤,放入1000mL的罐头瓶,盖子上钻有一个小孔,利于注射器采集气体样品。
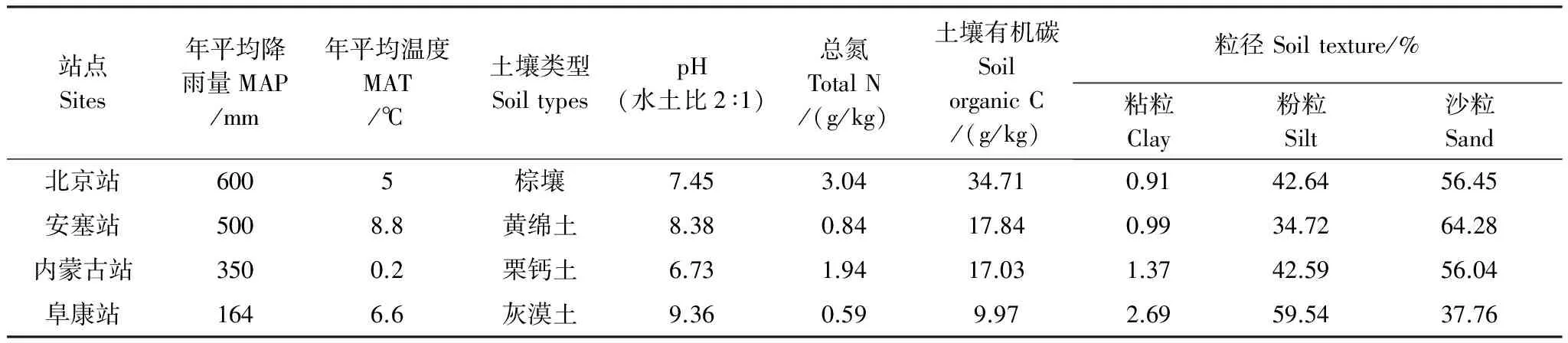
表1 站点基本情况和土壤基本理化性质
对土壤进行不同的干旱和再湿润处理,温度恒定在20℃,同时设置40%土壤持水量(WHC)的恒湿处理作为对照,并设2、5、7、14这4个干湿循环频率,每个处理设置3个重复。一个干湿循环开始于再湿润(加水),并且使之维持在40% WHC培养2d,然后就是干旱期开始时的3d风干。在再湿润的时候加入的水为无菌去离子水,干旱是指使土壤风干到5%WHC。恒湿处理使土壤湿度维持在40%WHC;2个循环处理的每个干旱期长为30d,总计培养时间为77d;5个循环处理的每个干旱期为10d,总计培养时间为82d;7个循环的每个干旱期为5d,总计培养时间为77d;14个循环处理的是指只要土壤干旱(土壤含水率达到5% WHC)即可,总计培养时间77d。

图1 土壤干湿交替控制试验方案示意图
上述控制试验的设计方案见图1。
1.3 测定方法
土壤理化性质测定[10]:土壤有机质采用重铬酸钾氧化-外加热法;土壤全氮、全碳采用元素分析仪(Vario EL III)测定;土壤pH值用酸度计测定;土壤质量含水量采用烘干法测定;土壤粒径采样激光粒度仪(Mastersizer 2000)测定;土壤持水量(WHC)测定主要参照Fierer和Schimel的方法[15]。
在湿润开始和结束(湿润阶段培养瓶完全密封)用医用注射器抽取气体样品,测定土壤温室气体(CO2和N2O)在每个湿润阶段的积累量。CO2样品的测定采用带有氢离子火焰检测器的气相色谱仪器(GC112A,北京分析仪器厂)进行分析;N2O的浓度通过带有点子捕获检测器(ECD)的气相色谱仪(GC,SP3410,北京分析仪器厂)进行分析。
1.4 数据分析
利用Origin8.5(Origin Lab Corporation, USA)进行画图。不同干湿循环间的差异利用spss12.0软件进行方差分析,差异显著性水平(P<0.05)通过最小显著差数法(LSD)进行检验。
2 结果与分析
2.1 CO2的释放
2.1.1每个再湿润阶段CO2释放速率的动态变化和平均值
图2为每个再湿润阶段CO2释放的动态变化。从图中可以明显看出,4个处理组CO2的释放速率都要高于恒湿对照组,14个循环处理的CO2释放速率的变化趋势与恒湿处理一致,都是在培养的前40d有明显的下降趋势,然后趋于平稳。还可以看出干湿循环中干旱期越长,再湿润阶段CO2的释放速率越大。4种不同生态系统土壤CO2释放速率的变化模式一致。例如在内蒙古草原土壤中,14循环、7循环、5循环和2循环4个处理中 CO2的平均释放速率分别是恒湿处理的1.43倍、2.03倍、2.16倍和2.92倍。
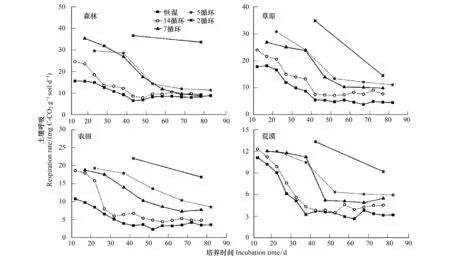
图2 干湿交替过程中每个再湿润阶段土壤呼吸速率变化
2.1.2第1个循环和最后一个循环再湿润阶段CO2释放速率的变化
干旱土壤再湿润能够激发土壤呼吸速率的脉冲事件。如图3,所有土壤在经历第1次再湿润时,都有明显的CO2释放的激发现象。并且随着干湿交替频率的增加(干旱期的减短)而减少。在森林和草原土壤中,各干湿交替处理中土壤呼吸速率都显著高(P<0.05)于恒湿对照。在2-循环中,森林土壤和草地土壤分别是其恒湿对照组的2.3倍和2.0倍。在农田和荒漠土壤中,虽然14-循环、7-循环和5-循环与对照组没有统计上的显著增加,但是2-循环显著高于恒湿对照,分别是对照组的1.9倍和1.2倍。在最后一个循环的再湿润中,虽然也都存在土壤呼吸的激发现象,但是相对于第1个次再湿润而言,14-循环、7-循环和5-循环的激发强度都有所减弱。2-循环处理只有经历2次再湿润阶段,土壤在第2次经历再湿润时,较之于第1次再湿润,森林和农田土壤呼吸的减少量并不明显,不过草原土壤和荒漠土壤减少较多,分别减少58.49%和31.06%;较之于恒湿对比而言,森林、农田、草原和荒漠土壤分别是对照的3.8倍、4.7倍、3.2倍和2.9倍。

图3 第1个循环和最后一个循环中再湿润阶段土壤呼吸速率的变化
2.1.3整个再湿润阶段CO2释放的积累量
图4中恒湿对照中土壤呼吸的积累量是与14-循环相对应的湿润天数所积累的土壤呼吸总量。总的来说,干湿交替处理中土壤呼吸的积累量都高于与之相对应的恒湿对照,由图可以看出农田土壤呼吸积累量增加得最为显著。在森林土壤中,14-循环的土壤呼吸积累量为360.11μgC-CO2/g 土与之对应的恒湿对照的积累量为284.56 μgC-CO2/g 土,增加了26.55%。在草原土壤中,14-循环的土壤呼吸积累量为339.88μgC-CO2/g 土与之对应的恒湿对照的积累量为244.01 μgC-CO2/g 土,增加了39.29%。在农田土壤中,14-循环的土壤呼吸积累量为299.31μgC-CO2/g 土与之对应的恒湿对照的积累量为143.27 μgC-CO2/g 土,增加了108.91%。在荒漠土壤中,14-循环的土壤呼吸积累量为167.54μgC-CO2/g 土与之对应的恒湿对照的积累量为142.79 μgC-CO2/g 土,增加了17.33%。

图4 土壤呼吸在整个再湿润阶段的积累量
2.2 N2O的释放
2.2.1第1个循环和最后一个循环再湿润阶段N2O释放速率的变化
如图5,总的来看,通过对比第1个循环和最后一个循环再湿润阶段氧化亚氮释放速率的变化,发现除了2-循环,其他干湿交替处理使得氧化亚氮的释放速率减少,其中森林和草原土壤氧化亚氮释放速率减少最为显著,如森林土壤中的7-循环和5-循环使得氧化亚氮释放速率分别减少了93.37%和95.30%;草地土壤中的7-循环和5-循环使得氧化亚氮释放速率分别减少了72.46%和73.68%。在第1个再湿润中,森林土壤和草原土壤在14-循环、7-循环和5-循环氧化亚氮的释放速率变化与CO2一致,都是随着干旱期增长而增加,不过在2-循环处理(30d干旱期)氧化亚氮的释放速率并不是最大。农田土壤氧化亚氮释放规律与森林和草地的正好相反,而是随着干旱期的增长,释放速率反而减少。与农田土壤类似,荒漠土壤中氧化亚氮释放速率也是14-循环为最大。不过,土壤在经历多次干湿交替之后,在最后一次再湿润条件下,所表现出来的现象与上文中CO2释放速率变化一致。
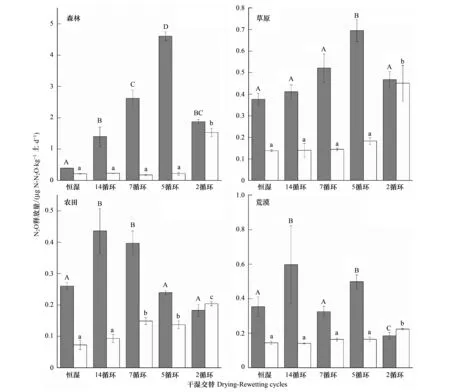
图5 第1个循环和最后一个循环中再湿润阶段N2O释放速率的变化
2.2.2整个再湿润阶段N2O释放的积累量
由图6可以看出,干湿交替处理能够激发土壤中氧化亚氮的释放,其中森林土壤表现得最为显著,如5-循环处理整个再湿润阶段氧化亚氮积累量较之于对应的恒湿处理增加了295.83%,7-循环增加了221.40%,14-循环增加了65.01%。在草地土壤中,7-循环处理湿润处理整个再湿润阶段氧化亚氮积累量较之于对应的恒湿处理增加了50.81%,不过14-循环却只增加了5.53%。农田和荒漠中14-循环处理整个再湿润阶段氧化亚氮积累量较之于对应的恒湿处理分别增加了42.02%和59.37%。图中还可以看出,虽然荒漠土壤所含总氮量低于农田土壤,但是其在整个室内培养过程中恒湿和14-循环处理所释放的氧化亚氮积累量却高于农田土壤。

图6 土壤N2O释放在整个再湿润阶段的积累量
3 讨论
当干旱的土壤再湿润的时候,通常情况下能够刺激微生物活性并释放CO2,这种现象在干旱、半干旱和地中海生态系统中最为常见[4, 11- 14]。通过对橡树和草地土壤进行水分的室内控制实验,Fierer等[15]发现,干旱土壤再湿润的时候,能够激发CO2的产量,并且能够持续2—6d。Saetre等[16]对半干旱地区两种不同植被土壤(草地和灌木)的研究发现在对土壤立即湿润的时候, 17h内CO2的产量增加了10倍。Schmitt等[17]对挪威云杉林灰化土壤实验中,同样发现CO2产量激发现象。本研究中,4种不同生态系统类型土壤中CO2的释放对干湿交替的响应都表现出类似的激发现象。而且,表现出来的激发总量与土壤中有机碳含量有一定的关系。例如,在森林土壤中,7-循环的土壤呼吸积累量比之对应的恒湿对照的积累量66.56%。在农田土壤中,14-循环的土壤呼吸积累量比之对应的恒湿对照的积累量增加了108.91%。
目前对于干湿交替过程中土壤所释放CO2的来源主要有两种机制来解释。一种是微生物胁迫机制。在干旱条件下,由于存在渗透调节,细胞内会通过合成可溶性有机物降低渗透压。微生物为了能够保留体内的水分,防止脱水,就会在体内积累高浓度的溶质[18- 19]。在随后的湿润条件下,环境中的水势迅速增加,为了平衡外界的水势,微生物需要迅速地转化之前所积累的溶质,这些溶质被分解成含碳化合物和易分解的有机碳[20]。另一种是底物供应机制,在干旱条件下,土壤团粒结构会被压缩,从而暴露新的土壤表面和前期受到保护的有机质[21- 22]。土壤再经历湿润的时候,土壤会膨胀,土壤团粒结构遭到进一步的破坏,暴露给微生物的有机质表面会进一步增加,从而增加了土壤养分的生物可利用性[23]。
干湿交替对土壤氮素释放的影响主要表现在对土壤N2O 排放和矿化态氮的淋失的影响[24]。土壤中N2O产生的机制是多方面的,受许多因子影响,土壤硝化作用和反硝化作用是其主要来源。在一定土壤水分含量范围内,硝化速率随水分含量增加而增加,当土壤水分的增加使氧的供应受到限制时,硝化速率开始下降[2, 5, 25]。土壤的干湿交替使得硝化作用和反硝化作用交替进行,从而促进了N2O 的产生[26]。由于土壤的干湿交替增加了死亡微生物的量以及打乱了土壤环境和有机物之间的相互作用而使得土壤有效碳和氮的矿化量增加,使土壤的硝化和反硝化量显著高于长期湿润的土壤。
4 结论
(1)干湿交替处理激发了CO2的释放速率。在特定时间内,随着干湿交替频率的减少(干旱期的增长),再湿润阶段CO2的释放速率增大。森林、农田、草地和荒漠土壤CO2的释放速率表现出一致的响应模式。
(2)在整个干湿交替处理中,各处理组在再湿润阶段CO2释放的积累量高于与之相对应的恒湿对照。在14-循环处理中,农田土壤再湿润阶段CO2释放的积累量比恒湿对照增加了108.91%,草地土壤增加了39.29%,森林土壤增加了26.55%。
(3)干湿交替处理也同样激发了N2O的释放速率和释放量。森林土壤表现得最为显著,如5-循环处理整个再湿润阶段氧化亚氮积累量较之于对应的恒湿处理增加了295.83%,7-循环增加了221.40%,14-循环增加了65.01%。不同土壤中N2O释放对干湿交替频率的响应模式存在一定的差异。其中农田和荒漠土壤中N2O的释放总量对干湿交替频率的响应模式类似。
[1]IPCC. Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University Press, 2007.
[2]Huygens D, Schouppe J, Roobroeck D, Alvarez M, Balocchi O, Valenzuela E, Pinochet D,Boeckx P. Drying-rewetting effects on N cycling in grassland soils of varying microbial community composition and management intensity in south central Chile. Applied Soil Ecology, 2011,48(3):270- 279.
[3]de Graaff M A, Six J, Harris D, Blum H,van Kessel C. Decomposition of soil and plant carbon from pasture systems after 9 years of exposure to elevated CO2: impact on C cycling and modeling. Global Change Biology, 2004,10(11):1922- 1935.
[4]Schimel J P, Wetterstedt J A M, Holden P A,Trumbore S E. Drying/rewetting cycles mobilize old C from deep soils from a California annual grassland. Soil Biology & Biochemistry, 2011,43(5):1101- 1103.
[5]Borken W,Matzner E. Reappraisal of drying and wetting effects on C and N mineralization and fluxes in soils. Global Change Biology, 2009,15(4):808- 824.
[6]Birch H F. The effect of soil drying on humus decomposition and nitrogen availability. Plant and Soil, 1958,10:9- 31.
[7]Butterly C R, McNeill A M, Baldock J A,Marschner P. Rapid changes in carbon and phosphorus after rewetting of dry soil. Biology and Fertility of Soils, 2011,47(1):41- 50.
[8]Schimel J, Balser T C,Wallenstein M. Microbial stress-response physiology and its implications for ecosystem function. Ecology, 2007,88(6):1386- 1394.
[9]Fierer N,Schimel J P. A proposed mechanism for the pulse in carbon dioxide production commonly observed following the rapid rewetting of a dry soil. Soil Science Society of America Journal, 2003,67(3):798- 805.
[10]Rukun L. Analysis methods of Soil Agricultural Chemistry. Beijing: China Agricultural Science Press, 2000.
[11]Yang Yusheng C G, Dong Bin, Wang Xiaoguo, Xie Jinsheng. Responses of soil respiration to soil rewetting in a natural forest and two monoculture plantations in subtropical China. Acta Pedologia Sinica, 2004,24(5):953- 958.
[12]Li Chenhua T L, Li Yan. Effects of air-drying and rewetting on physico-chemical properties and microbial activity of desert grey soil. Acta Pedologia Sinica, 2007,44(2):364- 367.
[13]Wu J,Brookes P C. The proportional mineralisation of microbial biomass and organic matter caused by air-drying and rewetting of a grassland soil. Soil Biology & Biochemistry, 2005,37(3):507- 515.
[14]Wang Y D W H M, Ma Z Q, Li Q K, Shi L L, Xu F. Review of response mechanism of soil respiration to rainfall. Chinese Journal of Plant Ecology, 2010,34(5):601- 610.
[15]Fierer N,Schimel J P. Effects of drying-rewetting frequency on soil carbon and nitrogen transformations. Soil Biology & Biochemistry, 2002,34(6):777- 787.
[16]Saetre P,Stark J M. Microbial dynamics and carbon and nitrogen cycling following re-wetting of soils beneath two semi-arid plant species. Oecologia, 2005,142(2):247- 260.
[17]Schmitt A, Glaser B, Borken W,Matzner E. Organic matter quality of a forest soil subjected to repeated drying and different re-wetting intensities. European Journal of Soil Science, 2010,61(2):243- 254.
[18]Halverson L J, Jones T M,Firestone M K. Release of intracellular solutes by four soil bacteria exposed to dilution stress. Soil Science Society of America Journal, 2000,64(5):1630- 1637.
[19]Harris R F. The effect of water potential on microbial growth and activity//Water potential relations in soil microbiology. SSSA Special Publication No. 9, Wisconsin, USA., 1981: 23- 95.
[20]Sugai S F,Schimel J P. Decomposition and biomass incorporation of C14- labeled glucose and phenolics in taiga forest floor-effect of substrate quality, successional state, and season. Soil Biology & Biochemistry, 1993,25(10):1379- 1389.
[21]Denef K, Six J, Bossuyt H, Frey S D, Elliott E T, Merckx R,Paustian K. Influence of dry-wet cycles on the interrelationship between aggregate, particulate organic matter, and microbial community dynamics. Soil Biology & Biochemistry, 2001,33(12/13):1599- 1611.
[22]Appel T. Non-biomass soil organic N - the substrate for N mineralization flushes following soil drying-rewetting and for organic N rendered CaCl2-extractable upon soil drying. Soil Biology & Biochemistry, 1998,30(10/11):1445- 1456.
[23]Vangestel M, Merckx R,Vlassak K. Microbial biomass responses to soil drying and rewetting the fate of fast-growing and slow-growing microorganisms in soils from different climates. Soil Biology & Biochemistry, 1993,25(1):109- 123.
[24]Beare M H, Gregorich E G,St-Georges P. Compaction effects on CO2 and N2O production during drying and rewetting of soil. Soil Biology & Biochemistry, 2009,41(3):611- 621.
[25]Zhang Wei Z X-d, He Hong-bo Research advances in soil nitrogen transformation as related to drying / wetting cycles. Chinese Journal of Ecology, 2010,29(4):783- 789.
[26]Liang Dongli T Y, Ove Emteryd, Fang Riyao, Zhang Shulan. The effects of wetting and drying cycles on N2O emission in dryland. Agricultural Research in the Arid Areas, 2002,20(2):28- 31.
参考文献:
[10]鲁如坤.土壤农业化学分析方法.北京:中国农业科技出版社,2000.
[11]杨玉盛,陈光水,董彬,王小国,谢锦升,李灵,卢豪良. 格氏栲天然林和人工林土壤呼吸对干湿交替的响应. 生态学报,2004,24(5):953- 958.
[12]李晨华, 唐立松, 李彦. 干湿处理对灰漠土土壤理化性质及微生物活性的影响. 土壤学报, 2007, 44(2): 364- 367.
[13]王义东, 王辉民, 马泽清, 李庆康, 施蕾, 徐飞. 土壤呼吸对降雨响应的研究进展. 植物生态学报, 2010, 34(5): 601- 610.
[25]张威, 张旭东, 何红波, 解宏图, 白震. 干湿交替条件下土壤氮素转化及其影响研究进展. 生态学杂志, 2010, 29(4): 783- 789.
[26]梁东丽,同延安,Ove Emyteryd,方日尧,张树兰. 干湿交替对旱地土壤N2O气态损失的影响. 干旱地区农业研究,2002,20(2):28- 31.
