转录因子Twist促进腹膜透析患者腹膜纤维化的作用机制研究
2013-08-02贾真姬丽华陈景荷梁维车明文何丽洁孙世仁王汉民
贾真,姬丽华,陈景荷,梁维,车明文,何丽洁,孙世仁,王汉民
·基础研究·
转录因子Twist促进腹膜透析患者腹膜纤维化的作用机制研究
贾真,姬丽华,陈景荷,梁维,车明文,何丽洁,孙世仁,王汉民
目的探讨转录因子Twist对腹膜透析患者腹透流出液人腹膜间皮细胞(HPMCs)的作用及相关机制。方法将腹膜透析患者透出液离心后进行HPMCs培养,检测Twist、E-cadherin、α-SMA、Bmi-1的蛋白及免疫荧光表达。分别采用上调质粒pcDNA3.1-Twist和空载体pcDNA3.1转染HPMCs,检测Twist、E-cadherin、α-SMA以及Bmi-1的蛋白及免疫荧光表达。分别采用Twist的siRNA质粒和空载体pSlience转染转分化的HPMCs,检测Twist、E-cadherin、α-SMA以及Bmi-1的蛋白及免疫荧光表达。采用Bmi-1的siRNA质粒转染转分化的HPMCs,检测E-cadherin、α-SMA以及Bmi-1的蛋白及免疫荧光表达。结果免疫荧光及Western blotting检测结果显示,随着透龄增加,E-cadherin表达降低,Twist、α-SMA及Bmi-1表达增加(P<0.05)。与空载体组相比,HPMCs过表达Twist后,E-cadherin表达减弱,Twist、α-SMA及Bmi-1表达增加(P<0.05)。用小干扰RNA使Twist沉默后,E-cadherin表达增加,Twist、α-SMA及Bmi-1表达减弱(P<0.05)。用小干扰RNA使Bmi-1沉默后,E-cadherin表达增加,α-SMA、Bmi-1表达减弱(P<0.05)。结论Twist参与了腹膜纤维化的发生发展过程,其作用部分是通过Bmi-1促进HPMCs的转分化实现的。
腹膜纤维化;上皮-间质细胞转分化;Twist转录因子;Bmi-1;钙黏着糖蛋白类;肌动蛋白类
[Key words]peritoneal fibrosis; epithelial-to-mesenchymal transition; Twist transcription factor; Bmi-1; cadherin; actins
腹膜透析(peritoneal dialysis,PD)是终末期肾病患者(ESRD)的替代治疗方法之一,长期腹膜透析失败与腹膜结构和功能的逐渐破坏有关[1-2]。虽然腹膜透析引起腹膜纤维化的确切分子机制不明,但是近年来研究提示腹膜间皮细胞向间质细胞的转化(epithelial-to-mesenchymal transition,EMT)可能是引起腹膜纤维化的重要原因之一[3]。本课题组前期研究证实,转录因子Twist在体外人腹膜间皮细胞(human peritoneal mesothelial cells,HPMCs)的转分化中发挥着重要作用,其过表达促进了EMT的发生[4-5],但该研究主要在体外进行,关于Twist是否能在人体内促进腹膜间皮细胞的转分化以及通过哪些相关分子进行调控尚不清楚。本实验观察Twist、Bmi-1及转分化标志物E-钙黏蛋白(E-cadherin)、α-平滑肌肌动蛋白(α-SMA)在腹膜透析患者透出液原代培养人HPMCs转分化中的表达变化,进一步探讨Twist在腹膜透析患者腹膜纤维化中的分子机制。
1 材料与方法
1.1 主要材料及试剂 人腹膜透析透出液标本取自西京医院肾脏内科腹膜透析中心腹膜透析患者,均经患者知情同意。体外试验所用人腹膜间皮细胞购于广州弗尔博生物有限公司。兔抗人Twist购自美国Abcam公司;兔抗人β-actin购于北京博奥森生物技术有限公司;兔抗人E-cadherin、兔抗人Bmi-1、Twist siRNA、Bmi-1 siRNA购自美国Santa Cruze公司;兔抗人α-SMA购自美国Epitomics公司。表达上调质粒pcDNA3.1由Ashwell教授(National Institute of Health)惠赠,pcDNA3.1-Twist由Glackin教授(National Medical Center and Beckman Research Institute)惠赠。
1.2 方法
1.2.1 HPMCs的培养、鉴定与分组 无菌收集进行腹膜透析患者的透出液标本,4℃、800r/min离心5min,弃上清,向沉淀中加入生理盐水洗涤2次,加入15% FBS-DMEM/F-12培养液重悬细胞,接种于0.1%明胶包被的25cm2培养瓶中,每袋透析液接种1瓶,37℃、5% CO2培养箱中培养,24h后换液,以后每3d换液1次,7~10d生长融合成单层,弃去培养液,每瓶加入1ml胰酶消化,待细胞少量漂浮后,加入15% FBS-DMEM/F-12培养液,将细胞吹打松解后,4℃、800r/min离心5min,弃上清,再次加入15% FBS-DMEM/F-12培养液吹打细胞,并移入6孔板,用于免疫细胞化学实验。经倒置相差显微镜观察,随着透析时间的增加,腹膜间皮细胞由鹅卵石样外观逐渐变化为条索状;免疫组化鉴定抗细胞角蛋白抗体和抗波形蛋白抗体染色阳性、抗第Ⅷ因子抗体和抗白细胞CD45抗体染色阴性。选取80例连续性非卧床腹透(CAPD)患者,留取夜间PD液标本。入选标准:年龄<65岁;CAPD≥1个月;近6个月无腹膜炎史,无腹部手术史;无长期服用免疫抑制剂史。按照开始腹膜透析时间,分为透析<6个月(10例)、6~12个月(15例)、12~18个月(20例)、18~24个月(10例)和≥24个月(25例)。
1.2.2 瞬时转染 转染前24h将永生化的HPMCs接种于6孔板,待细胞达90%融合时将pcDNA3.1-Twist正义质粒及pcDNA3.1空载体转入HPMCs细胞。具体转染步骤按Lipofectamine 2000试剂说明书操作。转染48h后,裂解细胞,收集蛋白,存储于-70℃冰箱,以备检测Twist、E-cadherin、α-SMA及Bmi-1蛋白及免疫荧光表达。用10% FBS-RPMI-1640培养液培养永生化的HPMCs,待细胞生长状态良好,加入浓度为50mmol/L的葡萄糖,刺激48h使细胞发生转分化后用Twist的siRNA质粒及空载体pSlience分别转染转分化的HPMCs,检测E-cadherin、α-SMA、Twist及Bmi-1的蛋白及免疫荧光表达。并且采用Bmi-1的siRNA质粒转染转分化的HPMCs,检测E-cadherin、α-SMA及Bmi-1的蛋白及免疫荧光表达,具体转染步骤同前。
1.2.3 Western blotting检测 提取处理过的HPMCs总蛋白样品,行10%SDS-PAGE电泳,并转印至硝酸纤维素膜上,5%脱脂奶粉室温封闭2h;用2%脱脂奶粉稀释一抗,4℃孵育过夜;洗涤后加辣根过氧化酶标记二抗,室温孵育2h,TBST洗膜后,ECL化学发光试剂盒显影。
1.2.4 细胞免疫荧光检测 细胞爬片后,用4%多聚甲醛固定20min,PBS缓冲液冲洗5次,正常山羊血清封闭液封闭30min后,滴加对应的一抗,4℃过夜。洗涤后滴加荧光二抗,室温下作用90min,PBS冲洗5min×5次,滴加DAPI染色5min,PBS冲洗5min×5次,防淬灭剂封片、镜检、照相。
1.3 统计学处理 采用SPSS 13.0软件进行统计分析。数据以±s表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 PD患者透出液中HPMCs的分离与培养 倒置相差显微镜观察显示,透龄6个月患者透出液培养的腹膜间皮细胞呈鹅卵石状;随着腹透时间的延长(透龄18个月),腹透液培养的细胞呈现鹅卵石状和条索状混合存在;透龄48个月透出液培养的细胞多呈条索状,类似纤维样细胞。提示随着透龄的延长,HPMCs形态由上皮样细胞逐渐转变为纤维样细胞(图1)。
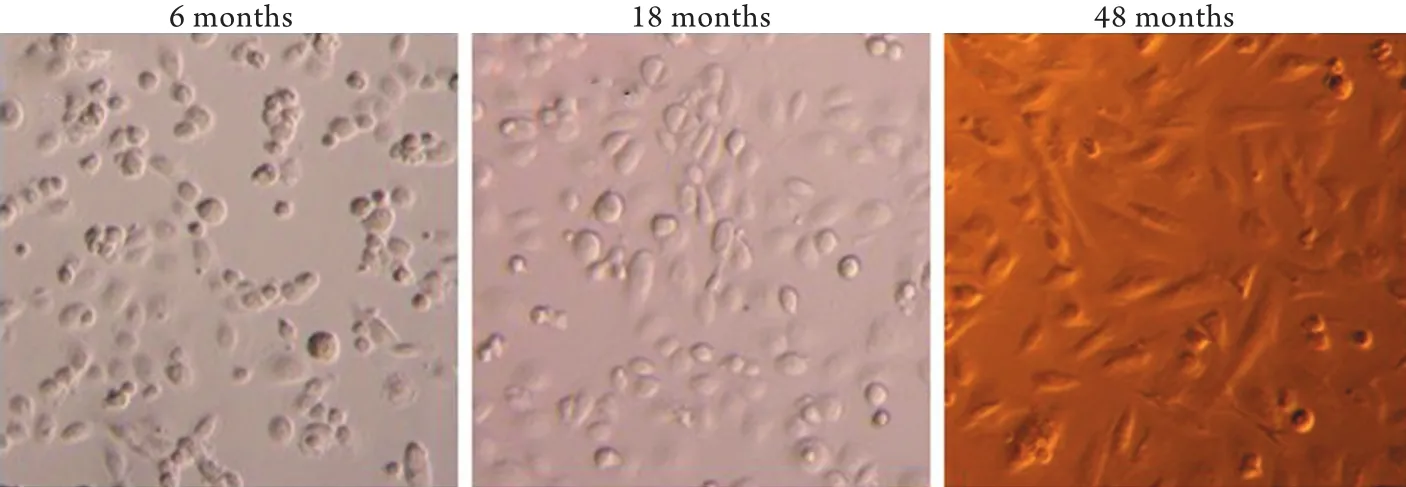
图1 腹膜透析患者透出液原代培养人腹膜间皮细胞的形态学改变Fig.1 Morphological changes of human peritoneal mesothelial cells (HPMCs) in peritoneal dialysis fluid from patient undergoing PD dialysis
2.2 免疫荧光及Western blotting检测Twist的表达
免疫荧光结果显示,随着透龄的增加,间质细胞标志分子α-SMA表达显著增加(P<0.05),上皮细胞标志分子E-cadherin表达明显降低(P<0.05),提示HPMCs已发生了EMT。与此同时,Twist的表达由胞质逐渐进入到胞核(P<0.05,图2A),提示随着透析时间的延长,Twist在原代HPMCs的表达逐渐增强且激活转位进入细胞核。Western blotting结果同样显示随着透析时间的增加,E-cadherin蛋白表达明显降低,α-SMA及Twist蛋白表达显著增加,差异有统计学意义(P<0.05,图2B),表明Twist的过表达在HPMCs的EMT中发挥着重要作用。
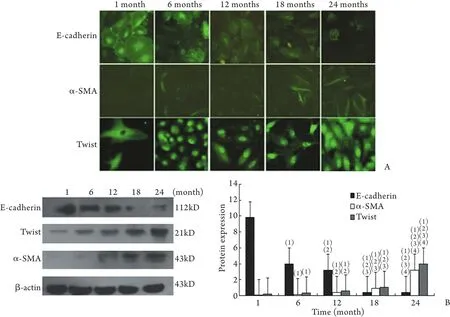
图2 E-cadherin、α-SMA和Twist在不同透龄腹膜透析透出液培养的HPMCs中的表达Fig.2 Expression of E-cadherin, α-SMA and Twist detected by immunofluorescence and Western blotting in the HPMCs from peritoneal dialysis fluid in PD patients
2.3 免疫荧光及Western blotting检测Bmi-1的表达免疫荧光结果显示,随着透析时间增加,Bmi-1表达显著增加(P<0.05,图3A)。Western blotting结果同样显示随着透析时间增加Bmi-1蛋白表达显著增加(P<0.05,图3B)。
2.4 Twist经基因转染上调后EMT各标志分子及Bmi-1表达的变化 分别转染Twist上调质粒和对照质粒后,免疫荧光染色显示,对照组E-cadherin在细胞膜高表达,而α-SMA表达较弱。与对照组相比,过表达Twist后E-cadherin表达明显减弱(P<0.05),而α-SMA、Twist及Bmi-1的表达显著增加(P<0.05,图4A)。Western blotting结果显示,过表达Twist后E-cadherin蛋白表达明显降低(P<0.05),而α-SMA和Twist、Bmi-1表达显著增高(P<0.05,图4B)。
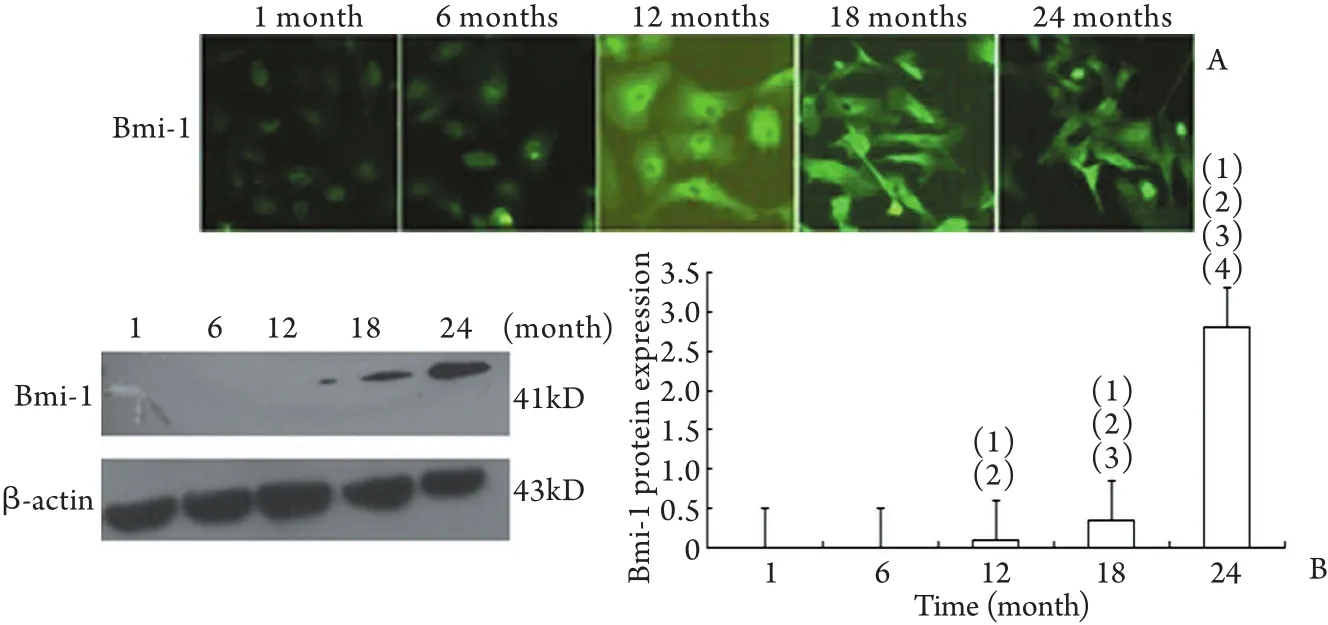
图3 不同透龄PD患者透出液培养的HPMCs中Bmi-1的表达Fig.3 Expression of Bmi-1 detected by immunofluorescence and Western blotting in the HPMCs from peritoneal dialysis fluid in PD patients
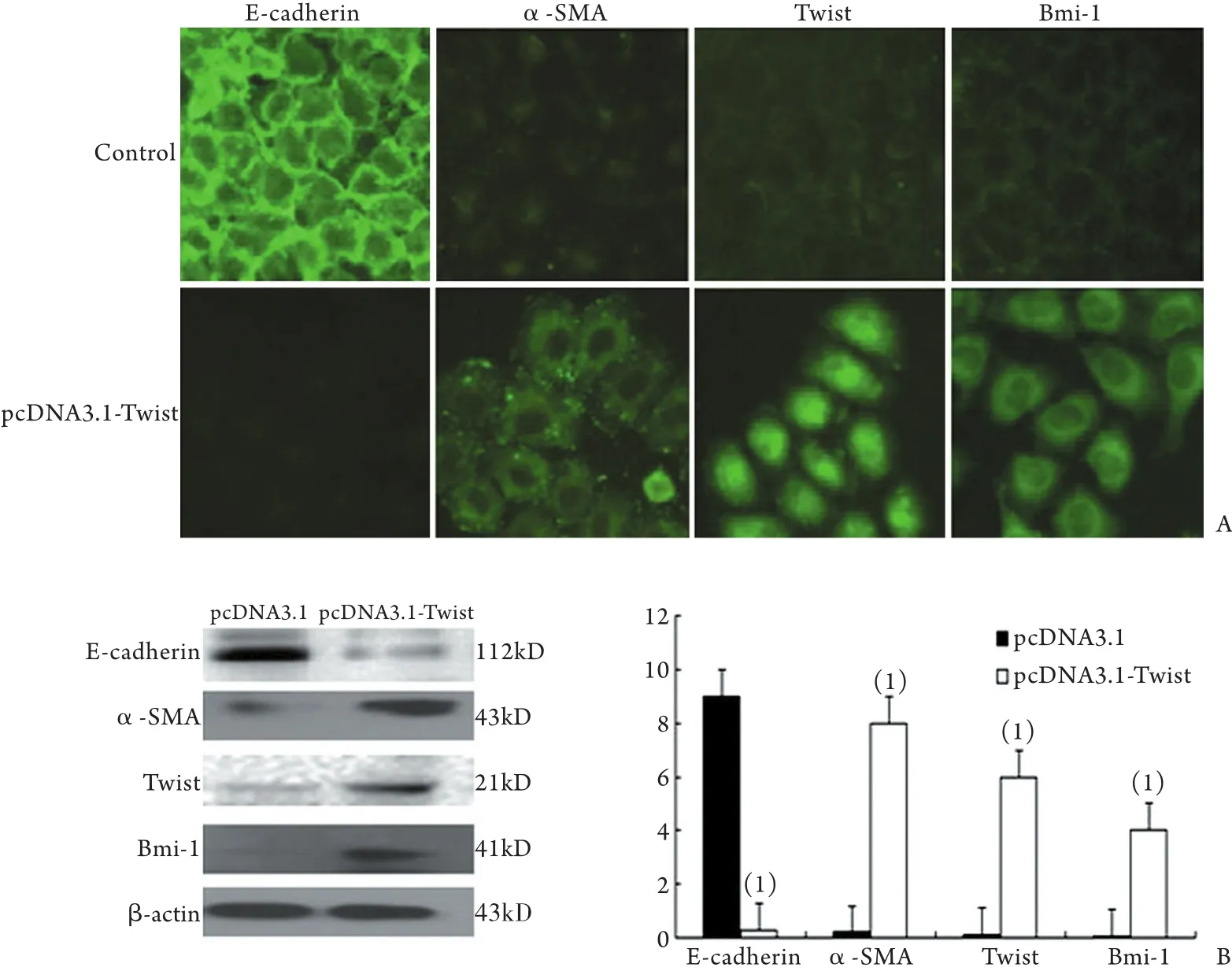
图4 Twist经质粒转染上调后E-cadherin、α-SMA、Twist和Bmi-1的表达变化Fig.4 Expression of E-cadherin, α-SMA, Twist and Bmi-1 of HPMCs after transfection of plasmid pcDNA3.1-Twist
2.5 Twist经基因转染下调后EMT各标志分子及Bmi-1表达的变化 分别转染siTwist和空载体后,免疫荧光染色显示,与对照组相比,下调Twist表达后E-cadherin表达明显增强(P<0.05),而α-SMA,Twist及Bmi-1表达显著减弱(P<0.05,图5A)。Western blotting结果显示,与对照组相比,下调Twist表达后E-cadherin蛋白表达水平明显升高(P<0.05),而α-SMA、Twist和Bmi-1的表达显著降低(P<0.05,图5B)。
2.6 Bmi-1经基因转染下调后EMT各标志分子表达的变化 转染Bmi-1 siRNA后,免疫荧光染色显示,与对照组相比,E-cadherin表达明显增强(P<0.05),而α-SMA、Bmi-1表达显著减弱(P<0.05,图6A)。Western blotting结果显示,与对照组相比,下调Bmi-1后E-cadherin蛋白表达水平明显升高(P<0.05),而α-SMA、Bmi-1表达显著降低(P<0.05,图6B)。
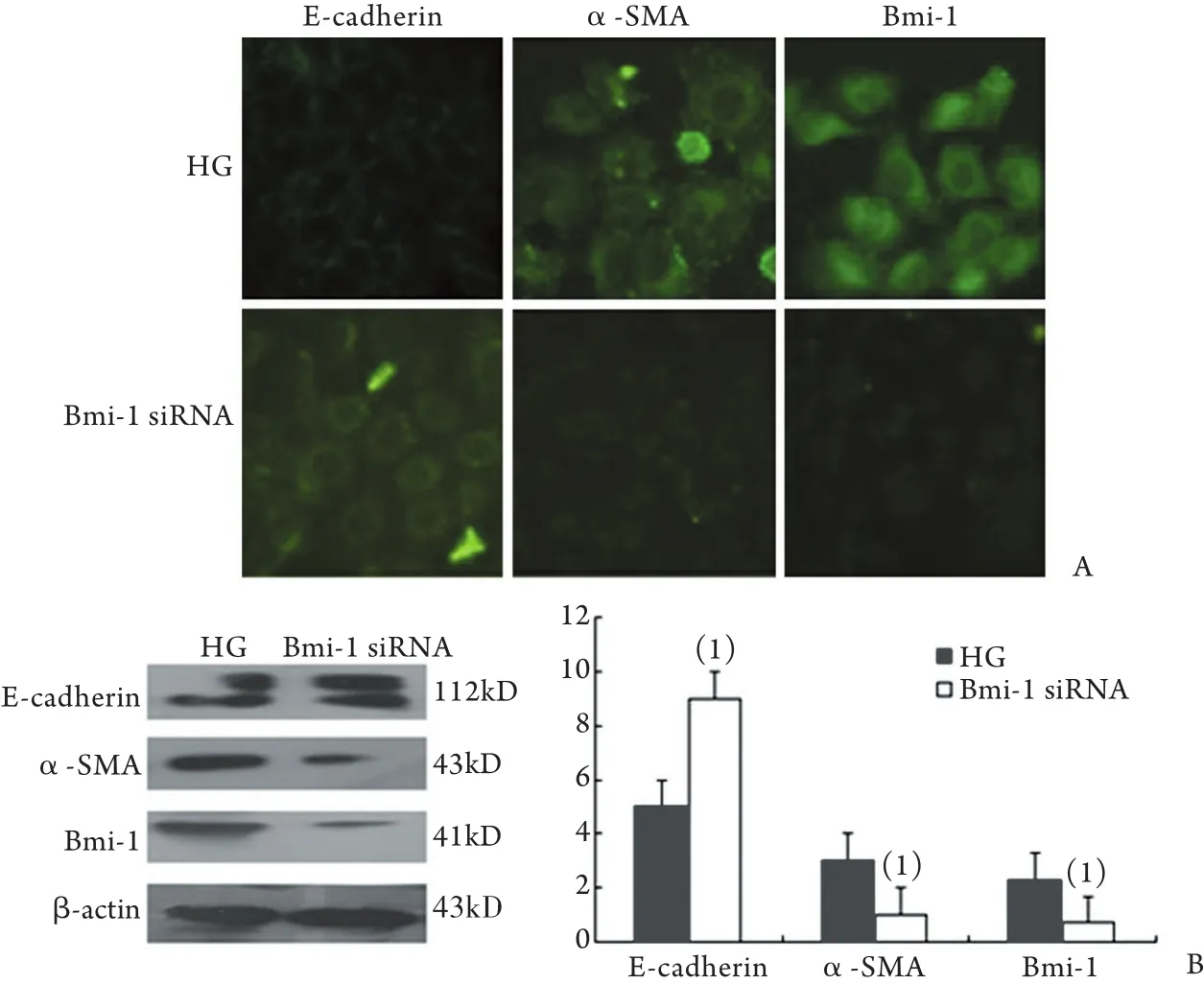
图6 Bmi-1经质粒转染下调后E-cadherin、α-SMA和Bmi-1表达的变化Fig.6 Expression of E-cadherin, α-SMA and Bmi-1 of HPMCs after the siRNA transfection
3 讨 论
腹膜纤维化是导致腹膜透析患者放弃腹透治疗的主要原因。近期研究表明间皮细胞在腹膜纤维化中可能发挥了重要作用[6]。间皮细胞的EMT是一个复杂的过程,其特点是间皮细胞标志物α-SMA的表达增加,负向调控上皮标志分子E-cadherin及其他黏附分子,导致细胞间连接破裂[7]。因此腹膜纤维化被认为是由腹膜间皮细胞的EMT引发的。然而目前有关腹膜间皮细胞转分化的机制尚不清楚。由于转录因子对下游基因的表达实行一对多或多对一的调控方式,因此在众多对EMT的刺激因素中,对转录因子作用的研究显得更有意义。
Twist蛋白是一种高度保守的碱性螺旋-环-螺旋转录因子,通过多种途径控制细胞生长、凋亡、分化及上皮-间质过渡[8-11]。本课题组以往的研究已经证实在高糖刺激下转录因子Twist表达显著增加,Twist的过表达促进了腹膜间皮细胞的转分化即EMT的发生[4]。抑制Twist的表达可逆转EMT的发生,可能会延缓腹膜纤维化的发生发展。然而关于Twist促进腹膜间皮细胞转分化的机制尚不清楚。Bmi-1基因是多梳基因(polycomb group genes)家族中重要的调节基因(一种癌基因),可调节同源盒基因的转录[12]。Bmi-1基因在维持正常干细胞自我更新和多向分化方面起重要作用。已有研究证实人类多种肿瘤如淋巴瘤、白血病、乳腺癌、肺癌及大肠癌等的发生发展过程均与Bmi-1基因表达异常有关[13]。目前认为Bmi-1可能是Twist的下游靶基因,由Twist直接调控[14]。已有研究证实Twist调控Bmi-1的表达,并且和Bmi-1一起通过抑制E-cadherin的表达促进肿瘤的始动以及EMT[15]。
综上所述,本研究证实在腹透患者透出液的原代HPMCs中Twist呈高表达,并且随着透龄的延长显著增高,Bmi-1的表达也显著增加,提示Twist、Bmi-1的过表达在HPMCs的EMT中发挥重要的作用,同时提示Twist可能通过Bmi-1促进HPMCs的EMT。通过体外实验用永生化的HPMCs转染Twist的上调质粒,观察到过表达Twist时,α-SMA、Bmi-1的表达也明显增强,E-cadherin的表达明显下降,提示过表达Twist后HPMCs发生了EMT,并且Twist通过Bmi-1促进HPMCs的EMT,而在高糖刺激发生了EMT的HPMCs细胞中转染下调Twist的Twist siRNA,检测到E-cadherin的表达明显增强,而α-SMA、Twist、Bmi-1的表达明显减弱,这提示下调Twist可以使HPMCs的表型有所改变,抑制HPMCs的EMT。同时,在高糖刺激发生了EMT的HPMCs细胞中转染Bmi-1 siRNA后,E-cadherin的表达明显增强,而α-SMA、Bmi-1表达明显减弱,提示下调Bmi-1后可以逆转HPMCs的EMT,并且提示Twist通过Bmi-1促进HPMCs的EMT。本研究证实Twist参与了人腹膜间皮细胞的EMT,并且通过Bmi-1促进EMT 的发生。而抑制Twist的表达可降低Bmi-1的表达从而逆转EMT的发生,为腹膜透析患者腹膜纤维化的防治提供了新的依据。
[1] Chaudhary K. Peritoneal dialysis drop-out: causes and prevention strategies[J]. Int J Nephrol, 2011, 2011: 434608.
[2] Wang H, Zhao ZZ, Shen WQ, et al. Expressions of HIF-1α and CTGF in peritoneum of peritoneal dialysis rats[J]. J Zhengzhou Univ (Med Sci), 2012, 47(2): 205-208. [腹膜透析大鼠腹膜组织中HIF-1α和CTGF的表达[J]. 郑州大学学报(医学版), 2012, 47(2): 205-208.]
[3] Aroeira LS, Aguilera A, Sánchez-Tomero JA, et al. Epithelial to mesenchymal transition and peritoneal membrane failure in peritoneal dialysis patients: pathologic significance and potential therapeutic interventions[J]. J Am Soc Nephrol, 2007, 18(7): 2004-2013.
[4] Li C, Ren Y, Jia X, et al. Twist aoverexpression promoted epithelial-to-mesenchymal transition of human peritoneal mesothelial cells under high glucose[J]. Nephrol Dial Transplant, 2012, 27(11): 4119-4124.
[5] Li CX, Sun SR, He LJ, et al. Effects of twist over-expression on the transdifferentiation of human peritoneal mesothelial cells[J]. Med J Chin PLA, 2011, 36(5): 456-462. [李翠香, 孙世仁, 何丽洁, 等. Twist过表达在人腹膜间皮细胞转分化中的作用[J].解放军医学杂志, 2011, 36(5): 456-462.]
[6] Bowen T. A role for fibrocytes in peritoneal fibrosis[J]? Perit Dial Int, 2012, 32(1): 4-6.
[7] Wheelock MJ, Shintani Y, Maeda M, et al. Cadherin switching[J]. J Cell Sci, 2008, 121(Pt 6): 727-735.
[8] Yang J, Mani SA, Donaher JL, et al. Twist, a master regulator of morphogenesis, plays all essential role in tumor metastasis[J]. Cell, 2004, 117(7): 927-939.
[9] Zhang L, Yang M, Gan L, et al. DLX4 upregulates TWIST and enhances tumor migration, invasion and metastasis[J]. Int J Biol Sci, 2012, 8(8): 1178-1187.
[10] Elias MC, Tozer KR, Silber JR, et al. Twist is expressed in human gliomas and promotes invasion[J]. Neoplasia, 2005, 7(9): 824-837.
[11] Kang Y, Massagué J. Epithelial-mesenchymal transitions: twist in development and metastasis[J]. Cell, 2004, 118(3): 277-279.
[12] Farivar S, Zati Keikha R, Shiari R, et al. Expression of bmi-1 in pediatric brain tumors as a new independent prognostic marker of patient survival[J]. Biomed Res Int, 2013, 2013: 192548.
[13] Giinsky GV, Berezovska O, Giinskii AB. Microarray analysis identifies a death-from-cancer signature predicting therapy failure in patients with multiple types of cancer[J]. J Clin Invest, 2005, 115(6): 1503-1521.
[12] Qi Q, Xu Y, He T, et al. Normal and disease-related biological functions of Twist1 and underlying molecular mechanisms[J]. Cell Res, 2012, 22(1): 90-106.
[13] Yang MH, Hsu DS, Wang HW, et al. Bmi1 is essential in Twist1-induced epithelial-mesenchymal transition[J]. Nat Cell Biol, 2010, 12(10): 982-992.
Mechanism of transcription factor Twist on promoting peritoneal fibrosis in patients undergoing peritoneal dialysis
JIA Zhen1,2, JI Li-hua1, CHEN Jing-he1, LIANG Wei1, CHE Ming-wen1, HE Li-jie1, SUN Shi-ren1, WANG Han-min1*
1Department of Nephrology, Xijing Hospital, Fourth Military Medical University, Xi’an 710032, China
2Department of Nephrology, First Hospital of Xi'an, Xi'an 710002, China
*
, E-mail: whm@medmail.com.cn
This work was supported by the National Natural Science Foundation of China (81270768, 81270849), and the Scientific and Technological Projects in Shaanxi Province (2012K16-08-05)
ObjectiveTo explore the mechanism of transcription factor Twist on promoting peritoneal fibrosis of human peritoneal mesothelial cells (HPMCs) in patients undergoing peritoneal dialysis (PD).MethodsThe HPMCs in peritoneal fluid after dialysis from patients underwent peritoneal dialysis was collected and cultured. The expression and subcellular localization of E-cadherin, α-SMA, Twist and Bmi-1 were assayed by immunofluorescence and Western blotting. The expression of Twist, Bmi-1, E-cadherin and α-SMA were determined by immunofluorescence and Western blotting after the plasmids pcDNA3.1-twist and empty vector pcDNA3.1 were transfected into HPMCs with Lipofectamine 2000 in vitro. Twist, Bmi-1, E-cadherin and α-SMA were determined by Western blotting and immunofluorescence after silencing the expression of Twist by small interfering RNA (siRNA) and empty vector pSlience. Bmi-1, E-cadherin and α-SMA were assessed by Western blotting and immunofluorescence after silencing the expression of Bmi-1 by siRNA.ResultsThe expression of E-cadherin decreased gradually and the expression of Twist, α-SMA and Bmi-1 increased along with the increase in PD time as determined with immunofluorescence and Western blotting. Compared with that expressed in the HPMCs trasfected with empty vector pcDNA3.1, the expression of E-cadherin significantly reduced and the expressions of α-SMA, Twist and Bmi-1 increased significantly after transfection of the plasmids pcDNA3.1-twist (P<0.05). The expression of E-cadherin increased significantly and the expressions of α-SMA, Twist and Bmi-1 decreased significantly after silencing the expression of twist by siRNA.The expression of E-cadherin increased significantly and the expressions of α-SMA and Bmi-1 decreased significantly after silencing the expression Bmi-1 by siRNA.ConclusionTwist may be involved in the process of peritoneal fibrosis, and its underlying mechanism is the promotion of the transdifferentiation of HPMCs via the regulation of Bmi-1.
R459.5
A
0577-7402(2013)11-0879-06
10.11855/j.issn.0577-7402.2013.11.002
2013-08-27;
2013-10-06)
(责任编辑:张小利)
国家自然科学基金(81270768,81270849);陕西省科技攻关项目(2012K16-08-05)
贾真,住院医师,硕士研究生。主要从事肾脏纤维化与肾衰竭方面的研究
710032 西安 第四军医大学西京医院肾脏内科[贾真(现在西安市第一医院肾脏内科工作)、姬丽华、陈景荷、梁维、车明文、何丽洁、孙世仁、王汉民]
王汉民,E-mail:whm@medmail.com.cn
