CTP-OD1-HA和CTP-OD2-HA融合肽在K562细胞中的定位及其与BCR-ABL蛋白的相互作用
2013-08-02肖恒王海霞陶崑刘鑫钟梁黄世峰冯文莉
肖恒,王海霞,陶崑,刘鑫,钟梁,黄世峰,冯文莉
CTP-OD1-HA和CTP-OD2-HA融合肽在K562细胞中的定位及其与BCR-ABL蛋白的相互作用
肖恒,王海霞,陶崑,刘鑫,钟梁,黄世峰,冯文莉
目的研究CTP-OD1-HA和CTP-OD2-HA两种融合肽在慢性粒细胞白血病(CML)K562细胞中的定位及其与BCR-ABL蛋白的相互作用。方法将前期制备的CTP-OD1-HA和CTP-OD2-HA融合肽转导入K562细胞,采用免疫荧光和Western blotting方法检测其入胞情况及胞内定位,His-pull down和CoIP实验检测融合肽与BCR-ABL的相互作用。结果免疫荧光检测显示CTP-OD1-HA和CTP-OD2-HA融合肽均能穿过细胞膜进入细胞并定位于胞质,Western blotting也同时检测到进入细胞质中的两种融合肽。His-pull down实验结果表明,CTP-OD1-HA和CTP-OD2-HA融合肽在细胞外均可直接与BCR-ABL蛋白结合,CoIP实验结果显示两种融合肽在K562细胞内也能与BCR-ABL蛋白结合并形成复合物。结论CTP-OD1-HA和CTP-OD2-HA融合肽均能成功进入白血病K562细胞并定位于细胞质,且可与BCR-ABL蛋白发生相互作用。
白血病,粒-单核细胞,慢性;融合蛋白质类,bcr-abl
慢性粒细胞白血病(chronic myeloid leukemia,CML)是一种以形成BCR-ABL融合基因为特征的造血干细胞恶性克隆增殖性疾病[1-2],其表达生成的BCR-ABL癌蛋白可使ABL激酶持续活化,从而导致CML的发生。目前,CML的主要治疗药物为伊马替尼,但近年来耐药情况日益严重[3-5],因此,迫切需要寻找新的治疗靶点。寡聚化结构域(oligomerization domain,OD)是位于BCR-ABL蛋白N端的重要结构域,由72个氨基酸构成,即BCR1-72。有研究证实可通过靶向该OD域达到治疗CML的目的[6-8]。近来有报道指出,OD域中起关键作用的是第30–63位氨基酸[9]。因此,本课题组前期分别制备了含BCR30-63的CTP-OD2-HA融合肽和含BCR1-29+64-72的CTP-OD1-HA融合肽。本研究以含BCR1-72的CTP-OD-HA融合肽为阳性对照,不含BCR1-72的CTP-HA融合肽及PBS为阴性对照,检测上述两种融合肽的入胞能力及定位,并研究其在胞外和胞内与BCR-ABL蛋白的相互作用,为后续检测其生物学效应奠定基础。
1 材料与方法
1.1 主要试剂 细胞培养所需胎牛血清和RPMI 1640培养液干粉购自美国Gibco公司,鼠抗HA抗体、兔抗c-ABL抗体购自美国Cell Signal公司,山羊抗鼠Cy3抗体、DAPI染料购自上海碧云天生物技术有限公司,CoIP试剂盒购自美国Thermo公司,Ni-NTA His纯化柱购自德国QIAGEN公司,正常山羊血清封闭液购自武汉博士德生物工程有限公司。
1.2 细胞株及融合肽 慢性粒细胞白血病急变细胞株K562细胞株由重庆医科大学临床检验诊断学教育部重点实验室保存,能稳定表达BCR-ABL融合蛋白。CTP-OD1-HA、CTP-OD2-HA、CTP-OD-HA和CTP-HA融合肽由本课题组前期表达纯化获得。
1.3 细胞免疫荧光检测融合肽入胞情况 将K562细胞常规换液,传代培养,取对数生长期细胞进行实验。在无血清的RPMI 1640培养液中分别加入终浓度为4μmol/L的CTP-OD-HA、CTP-OD1-HA、CTP-OD2-HA、CTP-HA融合肽和PBS,在37℃、5%CO2培养箱中孵育6h。离心收集细胞后,涂片、干燥、固定,先后孵育鼠抗-HA抗体(1:1000稀释)和Cy3标记的山羊抗鼠IgG二抗(1:1000稀释),并进行DAPI复染,封片观察结果。
1.4 Western blotting检测融合肽入胞情况 为了证明CTP-OD1-HA和CTP-OD2-HA融合肽可以在细胞中与BCR-ABL相互结合,并排除其结合能力的差异不是由融合肽进入细胞的量所造成的差异,实验设计如下:K562细胞培养同上,在含10%血清的RPMI 1640培养液中分别加入终浓度为60μmol/L的CTP-OD-HA、CTP-OD1-HA、CTP-OD2-HA、CTPHA融合肽和PBS,在37℃、5%CO2培养箱中孵育24h。离心收集细胞,提取总蛋白,Bradford法测定蛋白浓度。经10%SDS-PAGE电泳进行分离后,转移至硝酸纤维素膜上,封闭后孵育鼠抗HA多克隆抗体(1:1000稀释)和HRP标记的羊抗鼠IgG(1:1000稀释),化学发光显影,以检测各融合蛋白进入细胞的含量是否一致。
1.5 His-pull down检测CTP-OD1-HA和CTP-OD2-HA与BCR-ABL蛋白的相互作用 离心收集对数生长期的K562细胞,提取总蛋白,Bradford法测定蛋白浓度,并均分成4份。将提取的蛋白与预先结合了融合肽的Ni-NTA His纯化柱混合,4℃缓慢结合约1h,漂洗后进行洗脱,并留取洗脱液。以不加蛋白提取液的Ni-NTA His纯化柱作为原核表达融合肽阳性对照,不加Ni-NTA His纯化柱的蛋白提取液作为BCR-ABL融合蛋白阳性对照,两种对照处理方法同上。Western blotting检测上述洗脱液中的融合肽和BCR-ABL融合蛋白。
1.6 CoIP检测细胞内CTP-OD1-HA和CTP-OD2-HA与BCR-ABL蛋白的相互作用 在K562细胞中分别加入终浓度为60μmol/L的CTP-OD-HA、CTPOD1-HA、CTP-OD2-HA、CTP-HA融合肽和PBS,于37℃、5%CO2条件下孵育24h。离心收集细胞,使用CoIP试剂盒内的非变性蛋白裂解液提取蛋白,并加入PMSF防止蛋白降解,Bradford法测定蛋白浓度。将蛋白提取液与CoIP试剂盒内抗HA抗体的琼脂糖磁珠充分混匀,4℃搅拌过夜。离心弃上清,将琼脂糖磁珠用PBS洗涤后,加入CoIP试剂盒中的2×上样缓冲液,沸水煮5min。Western blotting检测融合肽和BCR-ABL融合蛋白。
2 结 果
2.1 免疫荧光检测融合肽入胞情况 K562细胞分别经CTP-OD1-HA、CTP-OD2-HA融合肽及CTPOD-HA、CTP-HA处理后,荧光显微镜观察可见,被Cy3标记的红色荧光主要出现在胞质内,细胞核被DAPI染为蓝色,而PBS组仅见DAPI的蓝色荧光(图1)。由此可见融合肽可以穿过细胞膜进入细胞,并定位于胞质中。
2.2 Western blotting检测融合肽入胞情况 Western blotting结果显示,4种融合肽蛋白条带与β-actin的比值无明显差异(图2),即进入细胞的含量相同。
2.3 His-pull down检测细胞外融合肽与BCR-ABL蛋白的相互作用 与阳性对照融合肽CTP-OD-HA相比,BCR-ABL融合蛋白均可以被融合肽CTP-OD1-HA和CTP-OD2-HA“pull down”。CTP-HA中由于不含OD域中的任何结构,因此,没有BCR-ABL可以被“pull down”(图3)。以上结果说明CTP-OD1-HA和CTP-OD2-HA融合肽均可与BCR-ABL蛋白结合。

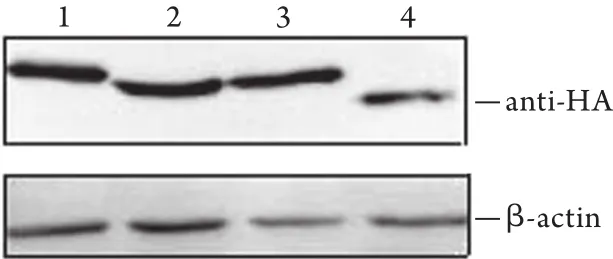
图2 Western blotting检测K562细胞中融合肽的含量Fig.2 Contents of fusion peptides in K562 cells detected by Western blotting
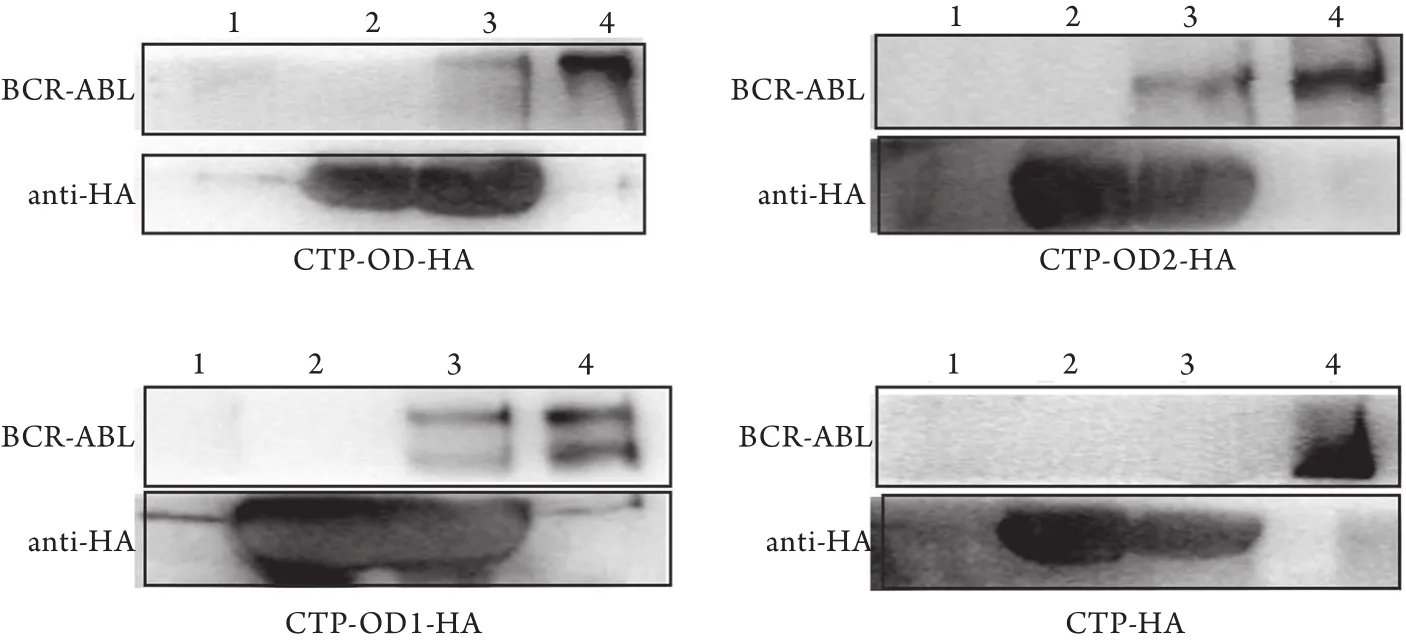
图3 His-pull down检测融合肽与BCR-ABL的相互作用Fig.3 Interaction of BCR-ABL with fusion peptides detected by His-pull down assay
2.4 CoIP检测细胞内融合肽与BCR-ABL蛋白的相互作用 K562细胞内分别加入融合肽CTP-OD1-HA和CTP-OD2-HA后,融合肽均可与BCR-ABL结合。与阳性对照CTP-OD-HA相比,两种融合肽的结合能力较弱,CTP-OD1-HA的结合力强于CTP-OD2-HA(图4)。
3 讨 论
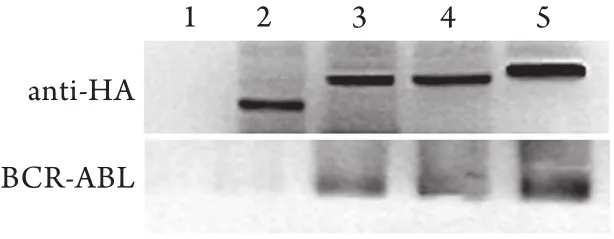
图4 CoIP检测K562细胞内融合肽与BCR-ABL的相互作用Fig.4 Detection of interaction of fusion peptides with BCRABL in K562 cells by CoIP assay
CML是由于BCR-ABL融合蛋白形成导致酪氨酸激酶异常活化,从而引起骨髓造血干细胞恶性增殖的疾病[10]。深入研究BCR-ABL的结构有利于开发新的治疗CML的小分子药物[11]。研究显示,可通过蛋白-蛋白之间的相互作用筛选出具有高亲和力、高稳定性的小分子多肽或小分子化合物作为治疗疾病的小分子药物的前体[12],同时研究蛋白-蛋白的相互作用也是对小分子蛋白进行修饰的前提条件[13]。Pull down和CoIP实验作为研究蛋白-蛋白相互作用的常用研究方法,可以确定蛋白相互作用的氨基酸区域[14],其中Pull down实验可以在细胞外研究蛋白-蛋白之间的相互作用,而其在活细胞内的相互作用则通过CoIP实验进行验证。
从BCR1-72晶体结构的研究中发现,BCR30-63在BCR1-72四聚体化后对BCR-ABL激酶的活化中起重要作用,但仍未有实验数据进行验证,除BCR30-63以外,BCR1-29+64-72是否有生物学功能也仍不清楚。本实验通过Pull down和CoIP两种方法探讨CTP-OD1-HA和CTP-OD2-HA融合肽与BCR-ABL之间的相互关系,结果表明两种融合肽均可通过信号肽CTP的作用进入K562细胞并定位于胞质,且无论在胞外还是胞内,二者均可与BCR-ABL结合,但是CTP-OD1-HA与BCR-ABL蛋白的亲和力强于CTP-OD2-HA,可能是由于OD1和OD2与BCR-ABL结合的部位不同、空间位阻不同所致。
综上所述,本实验验证了通过大肠埃希菌表达的融合肽CTP-OD1-HA和CTP-OD2-HA可成功跨膜入胞,定位于胞质,并可与BCR-ABL蛋白相结合,为后续深入研究两种融合肽的生物学功能和分子机制奠定了基础。
[1] Bennour A, Tabka I, Ben Youssef Y, et al. A novel t(3;12) (q21;p13) translocation in a patient with accelerated chronic myeloid leukemia after imatinib and nilotinib therapy[J]. Cancer Biol Med, 2013, 10(1): 47-51.
[2] Yang L, Jiang QL, Meng FY, et al. Assessment of bcr/ abl expression by realtime quantitative PCR in chronic myeloid leukemia patients after imatinibmesylate treatment[J]. Med J Chin PLA, 2007, 32(5): 451-453. [杨柳, 江千里, 孟凡义, 等.荧光定量PCR对伊马替尼治疗后慢性粒细胞白血病bcr/abl融合基因变化的检测效果研究[J]. 解放军医学杂志, 2007, 32(5): 451-453.]
[3] Elias MH, Baba AA, Husin A, et al. Contribution of BCR-ABL kinase domain mutations to imatinib mesylate resistance in Philadelphia chromosome positive Malaysian chronic myeloid leukemia patients[J]. Hematol Rep, 2012, 4(4): e23.
[4] Cooper MJ, Cox NJ, Zimmerman EI, et al. Application of multiplexed kinase inhibitor beads to study kinome adaptations in drug-resistance leukemia[J]. PLoS One, 2013, 8(6): e66755.
[5] Jiang H, Chen SS, Huang XJ, et al. Impact of trough plasma imatinib levels on patients with suboptimal responses after treatment with standard doseof imatinib in chronic-phase chronic myelogenous leukemia[J]. Chin J Pract Intern Med, 2012, 32(2): 135-137. [江浩, 陈珊珊, 黄晓军, 等. 伊马替尼血浆谷质量浓度与慢性粒细胞白血病慢性期疗效相关性研究[J]. 中国实用内科杂志, 2012, 32(2): 135-137.]
[6] Woessner DW, Lim CS. Disrupting BCR-ABL in combination with secondary leukemia-specific pathways in CML cells leads to enhanced apoptosis and decreased proliferation[J]. Mol Pham, 2013, 10(1): 270-277.
[7] Vassilev LT, Verdine GL. TAT-CC fusion protein depresses the oncogenicity of BCR-ABL in vitro and in vivo through interrupting its oligomerization[J]. Amino Acids, 2013, 44(2): 461-472.
[8] Huang SF, Liu DB, Zeng JM, et al. Cloning, expression, purification and functional characterization of the oligomerization domain of Bcr–Abl oncoprotein fused to the cytoplasmic transduction peptide[J]. Protein Expr Purif, 2009, 64(2): 167-178.
[9] Taylor CM, Keating AE. Orientation and oligomerization specificity of the Bcr coiled-coil oligomerization domain[J]. Biochemistry, 2005, 44(49): 16246-16256.
[10] Sessions J. Chronic myeloid leukemia in 2007[J]. Am J Health Syst Pharm, 2007, 64(24 Suppl 15): S4-S9.
[11] Sherbenou DW, Druker BJ. Applying the discovery of the Philadelphia chromosome[J]. J Clin Invest, 2007, 117(8): 2067-2074.
[12] Fry DC, Vassilev LT. Targeting protein-protein interactions for cancer therapy[J]. J Mol Med (Berl), 2005, 83(12): 955-963.
[13] Baek S, Kutchukian PS, Verdine GL, et al. Structure of the stapled p53 peptide bound to Mdm2[J]. J Am Chem Soc, 2012, 134(1):103-106.
[14] Wu Z, Li Y, Li X, et al. LRP16 integrates into NF-κB transcriptional complex and is required for its functional activation[J]. PLoS One, 2011, 6(3): e18157.
Location of CTP-OD1-HA and CTP-OD2-HA fusion peptide in K562 cells and its interaction with BCR-ABL protein
XIAO Heng, WANG Hai-xia, TAO Kun, LIU Xin, ZHONG Liang, HUANG Shi-feng, FENG Wen-li*
Department of Clinical Hematology, Key Laboratory of Laboratory Medical of Education Ministry, Chongqing Medical University, Chongqing 400016, China
*
, E-mail: fengwlcqmu@sina.com
This work was supported by the National Natural Science Foundation of China (30670901, 30871102)
ObjectiveTo investigate the intracellular location of cytoplasmic transduction peptide-oligomerization domain 1-hemagglutinin (CTP-OD1-HA) and cytoplasmic transduction peptide-oligomerization domain 2-hemagglutinin (CTP-OD2-HA) fusion peptide and interaction with BCR-ABL protein in chronic myelocytic leukemia (CML) K562 cells.MethodsThe prepared CTP-OD1-HA and CTP-OD2-HA fusion peptide were transduced into K562 cells, and the cytoplasmic transduction peptideoligomerization domain-hemagglutinin (CTP-OD-HA) peptide was used as positive control, and cytoplasmic transduction peptidehemagglutinin (CTP-HA) and PBS were used as negative control. The intracellular location of the fusion peptide was demonstrated by immunofluorescence and Western blotting. The interactions between the fusion peptides and BCR-ABL protein were detected by His-pull down and CoIP test.ResultsImmunofluorescence assay showed that both fusion peptides CTP-OD1-HA and CTP-OD2-HA could penetrate the cell membrane, and they were mainly localized in cytoplasm. Western blotting also confirmed the existence of the two fusion peptides in the cytoplasm. His-pull down showed that CTP-OD1-HA and CTP-OD2-HA could directly bind BCRABL protein outside the cells, and CoIP experiment showed that both fusion peptides could interact with BCR-ABL protein and form complex in the K562 cells. The negative control CTP-HA fusion peptide and PBS showed no such effects.ConclusionCTPOD1-HA and CTP-OD2-HA fusion peptides can successfully target into CML K562 cells and locate in cytoplasm, and it interacts with BCR-ABL protein.
leukemia, myelomonocytic, chronic; fusion proteins, bcr-abl
R733.7
A
0577-7402(2013)11-0896-04
10.11855/j.issn.0577-7402.2013.11.006
2013-07-03;
2013-09-11)
(责任编辑:李恩江)
国家自然科学基金(30670901、30871102)
肖恒,医学硕士。主要从事白血病的分子机制及基因治疗研究
400016 重庆 重庆医科大学临床检验诊断学教育部重点实验室(肖恒、王海霞、陶崑、刘鑫、钟梁、黄世峰、冯文莉)
冯文莉,E-mail: fengwlcqmu@sina.com
