粒细胞集落刺激因子对脑出血大鼠脑水肿及星型胶质细胞可塑性的影响
2013-07-26何晓英李小刚
何晓英,付 华,袁 平,谭 华,李小刚
脑出血(intracerebral haemorrhage,ICH)具有发展快、恢复慢、致残重的特点,随着老龄化进程加快发病率逐渐上升,严重威胁人类健康。实验证实粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)作为生物大分子可穿过大鼠血-脑脊液屏障,在中枢神经系统发挥重要的非造血功能。Laske 等[1]报道早期阿尔茨海默病 (AD)患者血浆G-CSF水平降低,外源性G -CSF 有望作为AD 新的治疗策略;实验变态反应性脑炎模型(EAE)证实G -CSF 在脑内具有抗炎功能[2];Sevimli 等[3]研究证实G-CSF 可明显减小脑梗死动物梗死灶、促进神经功能恢复。那么,G -CSF 对ICH 是否同样具有神经保护作用呢?本研究通过构建ICH 模型,从脑水肿及星形胶质细胞(Astrocyte,Ast)可塑性的角度,探讨G-CSF对ICH 大鼠发挥的作用及可能机制。现报道如下。
1 材料与方法
1.1 材料
1.1.1 动物及分组 健康成年Sprague - Dawley 大鼠96 只,体质量(250 ~320)g,SPF 级,由泸州医学院动物实验中心提供。实验大鼠随机分为假手术组(n =24)、ICH 组和干预组(n=36),各组又分6h、24h、48h、72h、7d、10d 6 个亚组(假手术组n=4,ICH 组、干预组n=6)。
1.1.2 主要试剂及仪器 重组人粒细胞集落刺激因子注射液(rhG-CSF,深圳新鹏生物工程有限公司);胶质原纤维酸性蛋白(GFAP)抗体(NeuMarker 公司);人基质金属蛋白酶9(MMP-9)抗体(Santa Cruz 公司);SABC 试剂盒、DAB 显色试剂盒以及二抗(武汉博士德公司)。大鼠脑立体定位注射仪(WDT-V,西安西北光电厂)。
1.2 方法
1.2.1 ICH 模型的制作[4]SD 大鼠术前禁食12h,2%戊巴比妥钠(50mg/kg)腹腔注射后,俯卧位固定在立体定位仪上,无菌操作暴露前囟,用小型牙科钻钻透颅骨至硬脑膜处,定位于前囟前0.2 mm、中线右侧旁开3mm、深6mm 为注血点,将非肝素抗凝断尾获取的动脉血50μl,先注入10μl,停针2min,后缓慢注入40μl,整个注血时间约5min,注血完毕后留针10~15min,再缓慢退针。术后青霉素粉末涂抹局部,缝合皮肤。所用手术器械经高压灭菌消毒,整个手术过程无菌操作。假手术组:参照上述方法,经注入点注入等量无菌0.9%氯化钠溶液。干预组制模成功1h 后经腹腔注射rhG -CSF (60μg/kg),假手术组、ICH 组经腹腔注射等量0.9%氯化钠溶液。
1.2.2 模型制作成功判断 SD 大鼠麻醉清醒后用Garcia 测评18 分制法[5]进行神经症状学评分,评分为3 ~12 分的大鼠为制模成功进入实验,死亡及评分>12 分大鼠剔除出实验。
1.2.3 脑组织含水量测定 采用干湿测重法:各组大鼠于相应时间点(假手术组n=2,ICH 组、干预组n =3)麻醉后迅速断头,剥离颅骨及硬脑膜,取出完整脑组织,去除脑膜、低位脑干和小脑,在电子精密天平上称重 (湿重),然后在100℃烤箱内烘烤24h,电子天平再次称重直到最后两次的质量差≤0.2mg 为止(干重)。按公式:BWC = (湿重-干重)÷湿重×100%计算脑组织含水量。
1.2.4 免疫组化检测MMP-9、GFAP 各组大鼠于相应时间点(假手术组n=2,ICH 组、干预组n =3)麻醉后,经主动脉灌注4%多聚甲醛,取出脑组织,多聚甲醛固定,石蜡包埋、切片。按照免疫组织化学试剂盒说明进行染色。采集系统对MMP-9、GFAP 的表达测定采用阳性细胞计数法,每只大鼠选1 张脑切片,在400 倍光镜下随机选取血肿周围的4 个视野,计数每个视野的阳性细胞数,取平均值。MMP-9 阳性表达为细胞胞膜及胞浆呈棕褐色,GFAP 阳性表达为细胞胞浆及星状突起纤维呈黄色或黄棕色。
1.3 统计学方法 采用SPSS13.0 统计软件进行数据处理,计量资料以(± s)表示,多组间比较采用单因素方差分析(One-Way ANOVA)的最小显著差法(LSD),两样本均数比较采用t 检验,脑组织含水量、MMP -9 进行直线相关分析,以P <0.05 为差异有统计学意义。
2 结果
2.1 各组ICH 大鼠脑组织含水量比较 3 组各时间点脑组织含水量比较,差异有统计学意义(P <0.05);ICH 组脑组织含水量各时间点与假手术组及干预组比较,差异均有统计学意义(P <0.05,见表1)。
2.2 各组ICH 大鼠血肿周围组织中MMP -9 表达比较 3 组各时间点MMP-9 表达比较,差异有统计学意义(P <0.05);ICH 组各时点MMP-9 表达与假手术组及干预组比较,差异均有统计学意义(P <0.05,见表2 及图1、2、3)。
表1 各组不同时间点脑组织含水量比较(±s,%)Table 1 Comparison of the water content of brain tissue in each group at different time points

表1 各组不同时间点脑组织含水量比较(±s,%)Table 1 Comparison of the water content of brain tissue in each group at different time points
注:与假手术组比较,* P <0.05;与ICH 组比较,△P <0.05
组别 只数6h 24h 48h 72h 7d 10d假手术组 24 77.80±0.48 77.54±0.62 77.28±0.53 77.55±0.26 78.02±0.57 77.73±0.34 ICH 组 36 80.10±0.18* 82.47±0.10* 84.15±0.58* 84.10±0.51* 80.39±0.39* 79.43±0.26*干预组 36 78.03±0.11△79.02±0.91△80.87±0.25△79.73±0.27△78.12±0.38△77.74±0.28△
表2 各组不同时间点血肿周围MMP-9 表达比较(±s)Table 2 Comparison of expression of MMP -9 around hematoma in each group at different time points
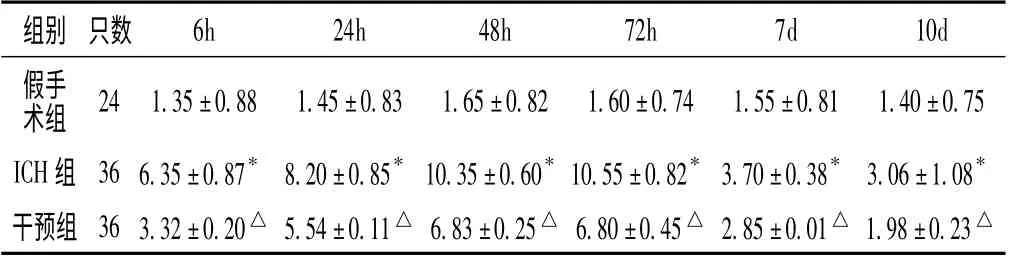
表2 各组不同时间点血肿周围MMP-9 表达比较(±s)Table 2 Comparison of expression of MMP -9 around hematoma in each group at different time points
注:与假手术组比较,* P <0.05;与ICH 组比较,△P <0.05
组别 只数6h 24h 48h 72h 7d 10d假手术组 24 1.35±0.88 1.45±0.83 1.65±0.82 1.60±0.74 1.55±0.81 1.40±0.75 ICH 组 36 6.35±0.87* 8.20±0.85* 10.35±0.60* 10.55±0.82* 3.70±0.38* 3.06±1.08*干预组 36 3.32±0.20△ 5.54±0.11△ 6.83±0.25△ 6.80±0.45△2.85±0.01△1.98±0.23△

图1 假手术组MMP-9 少量表达(×400)Figure 1 Few expression of MMP-9 in sham operation group
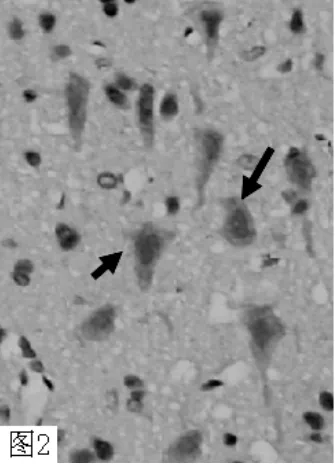
图2 ICH 组72h MMP-9 大量表达(×400)Figure 2 Abundant expression of MMP-9 in ICH group in 72h
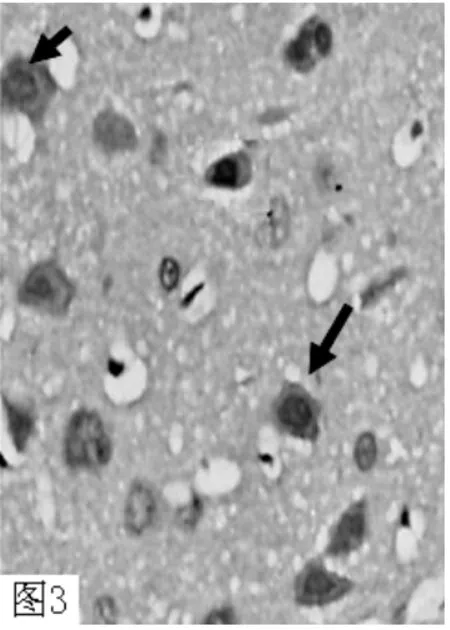
图3 干预组72h MMP-9 表达量较ICH 组减少(×400)Figure 3 72h MMP-9 intervention group decreased compared with that in ICH group
2.3 脑组织含水量与MMP-9 相关性分析 假手术组脑组织含水量与MMP-9 表达无线性相关(r =0.429,P =0.3961);ICH 组脑组织含水量与MMP -9 表达呈正相关(r =0.922,P=0.0089);干预组脑组织含水量与MMP-9 表达呈正相关(r=0.844,P=0.0345)。
2.4 各组ICH 大鼠血肿周围组织中GFAP 测定 假手术组未见GFAP 阳性细胞表达。ICH 组6h 即有少量GFAP 阳性细胞表达,分布稀疏、着色较浅、胞体体积较小、突起分支较少;48h 开始增多,72h 出现大量表达,7d GFAP 达高峰,胞体肥大、突起增粗且增长、着色较深;10d GFAP 阳性细胞表达减少。干预组6h GFAP 阳性细胞表达与ICH 组比较,差异无统计学意义(P >0.05);24h、48h、72h、7d、10d 与ICH 组比较,差异有统计学意义(P <0.05),细胞变形程度减轻(见表3 及图4、5、6)。
表3 各组不同时间点血肿周围GFAP 阳性细胞表达比较(±s)Table 3 Comparison of expression of GFAP positive cells around hematoma in each group at different time points
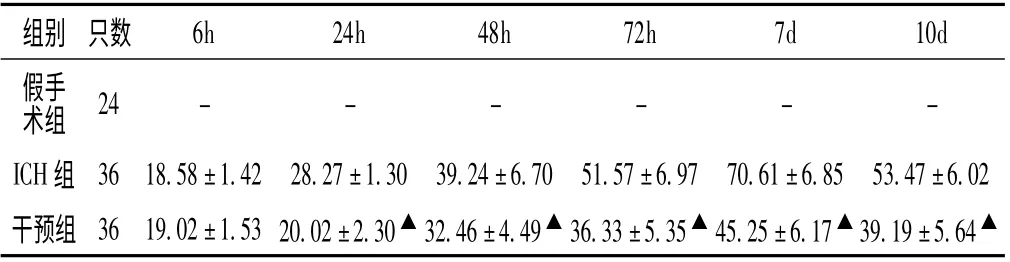
表3 各组不同时间点血肿周围GFAP 阳性细胞表达比较(±s)Table 3 Comparison of expression of GFAP positive cells around hematoma in each group at different time points
注:-为无GFAP 阳性蛋白表达;与ICH 组比较,▲P <0.05
6h 24h 48h 72h 7d 10d假手术组组别 只数24------ICH 组 36 18.58±1.42 28.27±1.30 39.24±6.70 51.57±6.97 70.61±6.85 53.47±6.02干预组 36 19.02±1.53 20.02±2.30▲32.46±4.49▲36.33±5.35▲45.25±6.17▲39.19±5.64▲
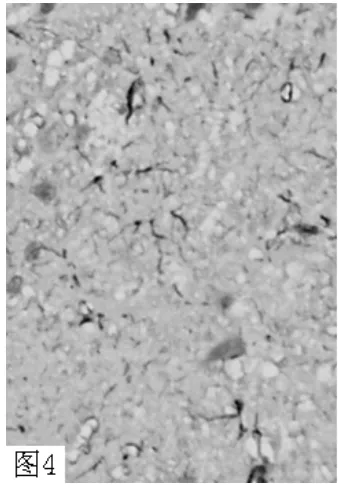
图4 假手术组无GFAP 表达(×400)Figure 4 No expression of GFAP in sham operation group
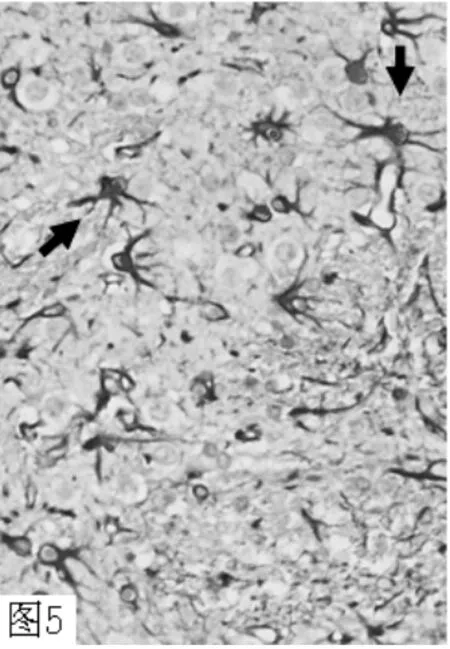
图5 ICH 组7d GFAP 大量表达(×400)Figure 5 Abundant expression of GFAP in ICH group in 72h

图6 干预组7dGFAP 表达量较ICH 组减少(×400)Figure 6 72h GFAP intervention group decreased compared with that in ICH group
3 讨论
G-CSF 是一种20kDa 的蛋白质,属造血生长因子家族的一员,在临床已广泛用于肿瘤患者化疗后或血液系统疾病如粒细胞减少症等的治疗。近年来越来越多的实验证据表明G-CSF存在中枢神经系统并发挥着重要的非造血功能。初期学者们推测G -CSF 在中枢神经系统发挥生物学作用可能是G-CSF动员了自体骨髓干细胞(BMSC),然后透过血-脑脊液屏障进入颅内,横向分化成神经干细胞,从而促进神经元再生以及神经功能恢复[6]。随着研究的深入,Schäbitz 等[7]在离体实验中发现在受到刺激的星形胶质细胞上有G -CSF 表达,Schneider 等[8]采用双重免疫标记法标记NeuN 与G -CSF,发现体内正常脑组织神经元上也有G - CSF 表达。另一方面,Schneider 等[8]应用免疫组化、western Blot 和RT-PCR 法均证实鼠脑的神经元和胶质细胞有G-CSF 受体(G-CSF-R)存在。在此基础上,Hasselblatt 等[9]试验证实G -CSF 在中枢神经系统通过与效应细胞表面特异性G -CSF -R 结合发挥生物学作用。脑组织存在内源性G -CSF 并在特定的条件下能与G-CS-R结合参与中枢神经系统复杂的病理生理过程,那么,外源性G-CSF 能否透过血-脑脊液屏障进入中枢神经系统呢?Solaroglu 等[10]采用不能透过血-脑脊液屏障的碘化牛血清蛋白作为对照,给大鼠注射碘化的G - CSF,计算注射后1h、4h、24h 碘化G-CSF 和碘化清蛋白的脑/血清比值,实验发现G-CSF 显示一个较高的脑/血清比值,证实G -CSF 能够通过完整的血-脑脊液屏障,为外源性G -CSF 治疗中枢系统疾病提供了科学的基础理论依据。
G-CSF 对缺血性脑血管病神经保护作用的研究较多,动物及部分临床实验均证实脑梗死后G-CSF 可以减少神经元凋亡、促进血管新生、减轻炎症反应、减少梗死面积等[11-12]。而G-CSF 对ICH 的神经保护作用及机制的研究鲜见报道。脑水肿是ICH 最为严重的继发性损伤,本实验建立大鼠自体血ICH 模型,研究显示ICH 组脑组织含水量各时间点明显高于假手术组,48 ~72h 达高峰,至第7d 后逐渐恢复;而干预组脑组织含水量各时间点明显低于ICH 组,说明G -CSF 减轻了ICH 后的脑水肿。实验进一步研究了G -CSF 减轻脑水肿程度的可能机制,MMP -9 是影响脑水肿发生发展的重要因素之一。Gursoy-Ozdemir 等[13]对基因遗传工程小鼠的实验研究证实MMP-9 能够改变血- 脑脊液屏障通透性并加重脑水肿。应用核磁共振技术对临床患者观察发现,ICH 患者脑水肿消涨规律与血清MMP-9 变化一致[14]。本实验也发现ICH 组各时点MMP-9 表达明显高于假手术组,48 ~72h 达高峰,对ICH组中MMP-9 表达和脑组织含水量进行相关性分析,发现两者呈正相关,说明ICH 后MMP -9 表达增强并参与了ICH 后脑水肿形成。干预组各时点MMP -9 表达明显轻于ICH 组,提示G-CSF 抑制了MMP-9 的表达,相关性分析发现干预组MMP-9 表达和脑组织含水量也呈正相关。因此,G -CSF 可能通过下调MMP -9 的表达减轻了ICH 后脑水肿,其确切机制尚需进一步研究。
Ast 是脑内数量最多的神经胶质细胞类型,正常条件下,它对神经元起到营养、支持、保护作用,并积极参与神经元再生修复的电生理活动。受到某些外伤、应激、脑损伤后Ast 具有改变自身特性适应损伤刺激的能力,即可塑性,称之为Ast活化,其表型上包括:细胞数量上的增加,细胞胞体、胞核大小及突起长度的变化[15]。GFAP 是Ast 独有的骨架蛋白,在有活性的Ast 中丰富表达,GFAP 在正常Ast 分布较少,其主要存在于活化Ast 中,其表达与Ast 的活性呈正比,可反映Ast的活化程度[16]。活化的Ast 在脑损害后有利弊双向作用,一方面,调节细胞钾、钙内外离子的浓度可增强能量代谢能力;释放神经营养因子 (GDNF)、碱性成纤维细胞生长因子(bFGF)、脑源性神经营养因子(BDNF)等营养成分和细胞因子;合成大量的载脂蛋白E 重建神经元完整性,修复神经功能,发挥神经保护作用[17]。另一方面,活化的Ast 可产生大量一氧化氮(NO),通过对大分子特别是DNA 的修饰,可导致细胞凋亡和坏死;可以产生多种细胞因子和炎性递质介导炎性反应,促进内皮细胞坏死,引起血-脑脊液屏障开放,参与脑水肿病理过程;过度的胶质化也可以作为机械屏障妨碍髓鞘和轴索的再生,影响周围神经组织结构和功能恢复[18]。因此,活化的Ast 对ICH 后神经组织是一把双刃剑,依靠神经系统代偿性的自我调节不足以既发挥Ast 的神经保护作用,同时又抑制Ast 神经毒性作用,可能是导致ICH 预后不佳的因素之一。因此,Ast 在ICH 中适度活化无疑具有重要意义。
Komine-Kobayashi 等[19]研究发现G -CSF 干预脑梗死后活化的Ast 减少,其表达的一氧化氮合酶(iNOS)被抑制,脑损害程度减轻。本实验也观察到假手术组无GFAP 阳性细胞表达,表明Ast 处于相对稳定状态;ICH 组6h 开始GFAP 少许表达,随时间延长逐渐增多,72h 大量表达,7d 达高峰,该规律与已有研究报道基本一致[20];干预组6h GFAP 表达与ICH组相似,24h、48h、72h、7d、10d 时GFAP 表达较ICH 明显减少,细胞变形程度减轻,实验结果提示G -CSF 下调了ICH后GFAP 表达,抑制Ast 过度活化。理论上G - CSF 抑制了ICH 大鼠Ast 过度胶质化,可增强对神经元的保护作用,而减轻对脑组织的损伤作用,但是怎样才能使GFAP 恰好维持在一个适当的水平从而最大限度发挥Ast 的神经保护作用以及G-CSF抑制Ast 过度活化的确切机制有待深入研究。
1 Laske C,Stellos K,Stransky E,et al. Decreased plasma levels of granulocyte-colony stimulating factor (G-CSF)in patients with early Alzheimer's disease [J]. J Alzheimers Dis,2009,17 (1):115 -123.
2 Zavala F,Abad S,Ezine S,et al. G-CSF therapy of ongoing experimental allergic encephalomyelitis via chemokine and cytokine-based immune deviation [J]. J Immunol,2002,168 (4):2011 -2019.
3 Sevimli S,Diederich K,Strecker JK,et al. Endogenous brain protection by granuloeyte-colony stimulating factor after ischemic stroke [J].Exp Neurol,2009,217 (2):328 -335.
4 Deinsberger W,Vogel J,Kuschinsky W,et al. Experimental intracerebral hemorrhage:decription of a double injection model in rats [J].Neurol Res,1996,18 (5):475 -477.
5 Gareia JH,Whgner S,Liu KF,et al. Neurological deficit and extent of neuronal neurosis attributable to middle cerebral artery occlusion in rats:statistical validation [J]. Stroke,1995,26:627 -635.
6 Corti S,Locatelli F,Strazzer S,et al. Modulated generation of neuronal cells from bone marrow by expansion and mobilization of circulating stem cells with in vivo cytokine treatment [J]. Exp Neurol,2002,177 (2):443 -452.
7 Schäbitz WR,Kollmar R,Schwaninger M,et al. Neuroprotective effect of granulocyte colony-stimulating factor after focal cerebral ischemia [J]. Stroke,2003,34 (3):745 -751.
8 Schneider A,Krüger C,Steigleder T,et al. The hematopoietic factor G-CSF is a neuronal ligand that counteracts programmed cell death and drives neurogenesis [J]. J Clin Invest,2005,115 (8):2083 -2098.
9 Hasselblatt M,Jeibmann A,Riesmeier B,et al. Granuloeyte colony stimulating factor (G - CSF)and G - CSF receptor expression in human ischemie stroke [J]. Acta Neuropathol,2007,113 (l):45 -51.
10 Solaroglu I,Cahill J,Tsubokawa T,et al. Granulocyte colony -stimulating factor protects the brain against experimental stroke via inhibition of apoptosis and inflammation [J]. Neurol Res,2009,31(2):167 -172.
11 Sugiyama Y,Yagita Y,Oyama N,et al. Granulocyte colony-stimulating factor enhances arteriogenesis and ameliorates cerebral damage in a mouse model of ischemic stroke [J]. Stroke,2011,42 (3):770-775.
12 England TJ,Abaei M,Auer DP,et al. Granulocyte colony -stimulating factor for mobilizing bone marrow stem cells in subacute stroke:the stem cell trial of recovery enhancement after stroke 2 randomized controlled trial [J]. Stroke,2012,43 (2):405 -411.
13 Gursoy - Ozdemir Y,Qiu J,Matsuoka N,et al. Cortical spreading depression activates and upregulates MMP - 9 [J]. J Clin Invest,2004,113 (10):1447 -1455.
14 Barr TL,Latour LL,Lee KY,et al. Blood -brain barrier disruption in humans is independently associated with increased matrix metalloproteinase-9 [J]. Stroke,2010,41 (3):e123 -128.
15 Barker AJ,Ullian EM. Astrocytes and synaptic plasticity [J]. Neuroscientist,2010,16 (1):40 -50.
16 Love S,McLean C. Overview and recent advances in neuropathology[J]. Pathology,2011,43 (2):87.
17 Brouns R,De Vil B,Cras P,et al. Neurobiochemical markers of brain damage in cerebrospinal fluid of acute ischemic stroke patients[J]. Clin Chem,2010,56 (3):451 -458.
18 梁彦涛,张敬军. 胶原纤维酸性蛋白基础与临床研究进展[J].医学综述,2009,15 (16):2407 -2409.
19 Komine - Kobayashi M,Zhang N,Liu M,et al. Neuroprotective effect of recombinant human granulocyte colony - stimulating factor in transient focal ischemia of mice [J]. J Cereb Blood Flow Metab,2006,26 (3):402 -413.
20 Masuda T,Maki M,Hara K,et al. Peri-hemorrhagic degeneration accompanies stereotaxic collagenase - mediated cortical hemorrhage in mouse [J]. Brain Res,2010,1355:228 -239.
