胶州湾12种饵料鱼类耳石大小与体长的关系
2013-07-24麻秋云徐宾铎纪毓鹏陈学刚韩东燕孙远远
麻秋云 薛 莹 徐宾铎 纪毓鹏 陈学刚韩东燕 孙远远
(1.中国海洋大学水产学院, 青岛 266003; 2.青岛市黄岛区海洋与渔业局, 青岛 266500)
耳石是硬骨鱼类在生长过程中沉积在内耳中的结石, 由于其记录的信息涵盖了鱼类生理生态学研究的诸多方面, 因此已逐渐成为国际上渔业科学和海洋环境科学研究的热点[1]。由于耳石形态结构稳定, 具有种的特征, 利用光学图像处理软件和傅立叶分析等统计学手段, 研究者将耳石形态学分析方法应用于鱼类物种及群系识别领域, 取得了良好效果[2—4]。
在鱼类胃含物分析的过程中, 许多饵料鱼类在胃中多处于消化或半消化状态, 主要身体部位常常残缺不全, 给种类鉴定和个体大小的测量带来一定的难度[5]。由于耳石具有坚硬且不易被消化的特点,即使饵料鱼类的消化程度很高, 其耳石仍然能够较为完整的保留, 因此可以依据耳石的形态特征鉴别饵料鱼类的种类, 这方面已经在许多高营养级海洋动物(如海洋哺乳动物、海鸟、凶猛肉食性鱼类等)的食性研究中得到了广泛的应用[6—9]。除了种类鉴别, 通过建立耳石大小与鱼体长度的关系式, 还可以根据胃含物中残留耳石的个体大小来推算饵料鱼类的体长等形态指标, 近年来国外学者在该领域开展许多相关的研究[10—14], 而我国在这方面的研究报道较少。
本文选择胶州湾 12种常见的饵料鱼类作为研究对象, 分析每种鱼类的体长与耳石形态大小(包括耳石的长度、宽度、长半径和短半径)的关系, 并建立回归方程, 旨在为深入研究高营养级鱼类的摄食生态和食物网营养动力学提供基础资料。
1 材料与方法
1.1 样品采集
样品采自2008年11月至2009年8月在胶州湾海域(36°06′—36°08′N, 120°12′—120°18′E)进行的逐月定点底拖网调查(图1)。调查船为30 kW左右的单拖渔船, 平均拖速为 2.0 kn, 平均每站拖网时间为0.5h。调查网具网口高度1.6 m, 网口宽度12 m, 囊网网目 20 mm。调查共采集 12种饵料鱼类的样品1063尾, 各个鱼种的样品数目及体长范围(表1)。
图1 胶州湾调查站位Fig.1 Sampling stations in Jiaozhou Bay
1.2 耳石测量
鱼类样品带回实验室做进一步的分析, 鉴定种类, 并按照最新的《海洋调查规范》[15]进行生物学测定, 包括体长(mm)和体重(g)等生物学参数。将鱼类的左、右矢耳石取出, 清洗干燥后, 编号记录置于离心管中保存。采用尼康E800体视显微镜拍摄耳石的照片, 分类编号后应用Image-Pro Plus 6.0软件测量耳石的长度、宽度、长半径和短半径。其中, 耳石长度是指平行于耳石主凹槽的耳石前后端最大长度, 耳石宽度是指垂直于主凹槽从耳石背侧到腹侧的最大宽度[12]; 耳石长半径和短半径分别为耳石中心核到耳石边缘的最大距离和最小距离[16]。
1.3 数据分析
根据 Keys公式W=a*SLb计算各个鱼种体长与体重的关系[17], 式中W为体重(g),SL为体长(cm),a为条件系数,b为回归系数。用t检验法检验回归系数b值与3之间是否有显著差异[18], 若差异不显著则为等速生长, 反之则为异速生长[17]。运用最小二乘法对 12种鱼类体长与耳石形态大小(包括耳石的长度、宽度、长半径和短半径)的关系进行回归分析[10,12,14], 并应用方差分析(ANOVA)检验回归方程的显著性[18]。经检验, 12种鱼类左右矢耳石的形态参数均无显著差异(P<0.05), 因此本文选取各个鱼种的左耳石进行分析(图2)。
2 结果
2.1 体长与体重的关系
本文所研究的12种饵料鱼类分别隶属于3目, 7科, 11属。其中, 样品数量最多的鱼种是六丝钝尾虾虎鱼Amblychaeturichthys hexanema(n=197), 样品数量最少的鱼种为Liza haematocheila(n=43)。结果表明, 12种鱼类的体长与体重均呈显著的幂函数关系(P<0.05), 回归系数b值的范围是 2.871—3.371,平均值为 3.159±0.110(95% CL), 所有鱼种b值的95%的置信区间均在2.5—3.5的范围内。b值最小的鱼种是六丝钝尾虾虎鱼, 最大的是细条天竺鲷Apogon lineatus。t检验表明,和箭鱼衔Callionymus sagittal的b值与3无显著差异(P<0.05), 属等速生长; 李氏鱼衔Callionymus richardsonii和六丝钝尾虾虎鱼的b值显著小于3(P<0.05), 属负异速生长; 其余8种鱼类的b值均显著大于3(P<0.05), 为正异速生长。
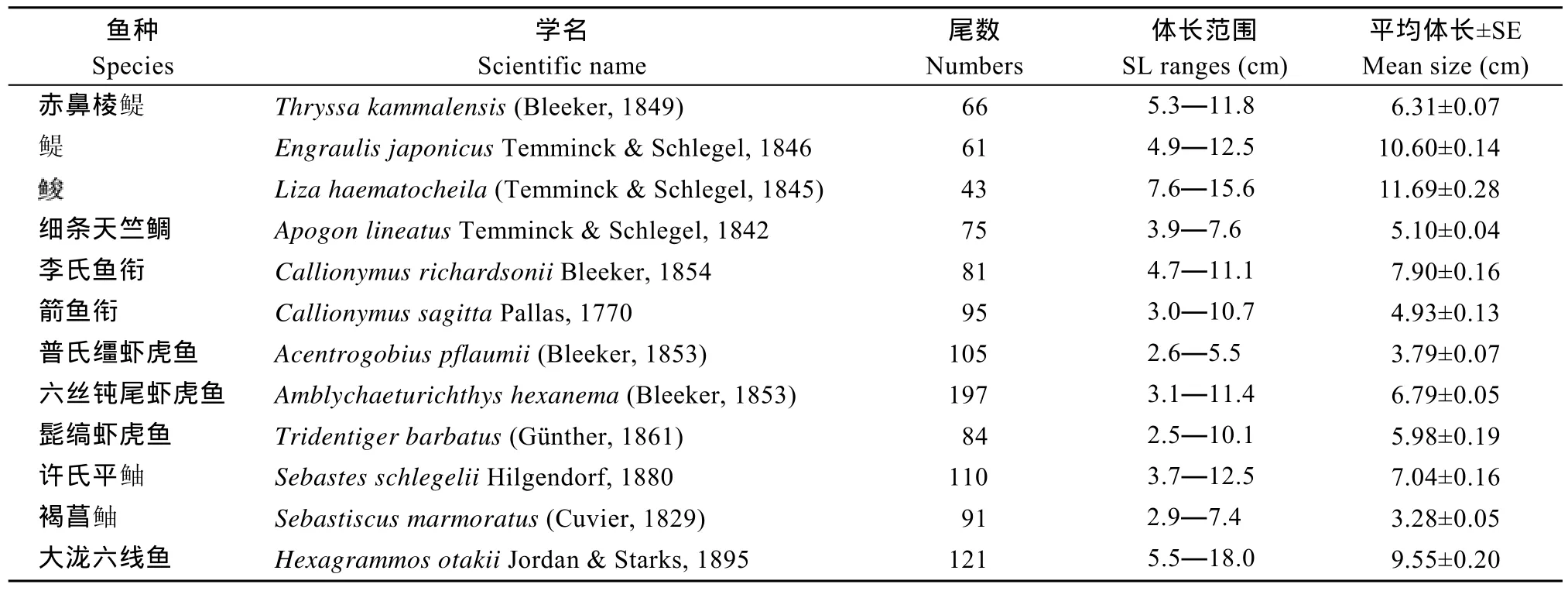
表1 胶州湾12种饵料鱼类的样品数量和体长范围Tab.1 Sample size and size range of twelve prey fish species from Jiaozhou Bay

图2 胶州湾12种饵料鱼类矢耳石的图像(左耳石)Fig.2 Images of sagittal otolith for 12 prey fish species in Jiaozhou Bay (left otolith)
2.2 体长与耳石长度和宽度的关系
方差分析表明, 胶州湾12种饵料鱼类体长与耳石长度和宽度之间都存在极显著的线性回归关系(P<0.01)。在体长与耳石长度的回归方程中, 有9种鱼类的R2值大于0.8, 回归方程的拟合效果较好, 其余3种鱼类(鳀Engraulis japonicus、李氏鱼衔和箭鱼衔)的R2值相对较小(0.7
在12种饵料鱼类中, 有 10种鱼类的体长与耳石长度和耳石宽度回归方程之间的R2值比较接近;而其余 2种鱼类(鳀和箭鱼衔)2个回归方程的R2值相差较大, 拟合效果存在明显差异, 鳀其中体长与耳石长度(R2=0.778)的拟合效果要优于体长与耳石宽度(R2=0.643), 而箭鱼衔体长与耳石宽度(R2=0.923)的拟合效果要明显优于体长与耳石长度(R2=0.742)(表 3)。
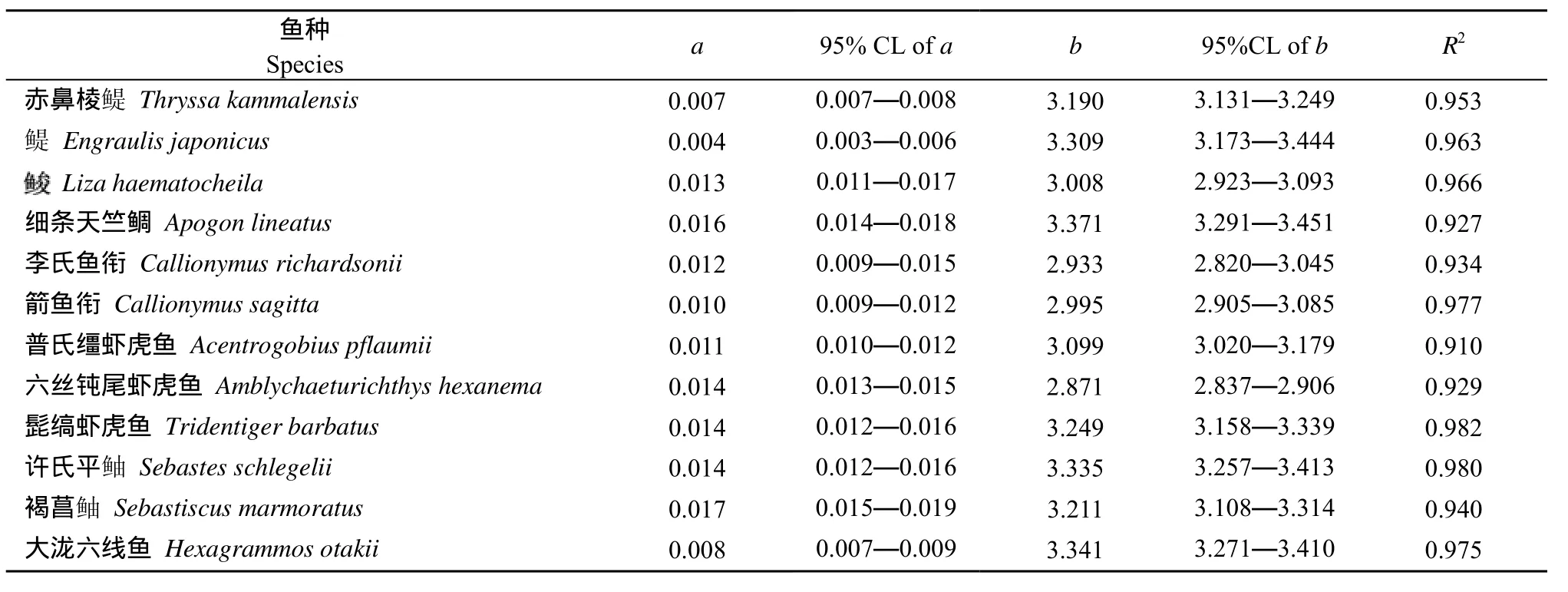
表2 胶州湾12种饵料鱼类体长与体重回归方程的参数及其决定系数(R2)Tab.2 Length-weight relationship parameters and determination coefficient for twelve prey fish species from Jiaozhou Bay
2.3 体长与耳石半径的关系
胶州湾 12种饵料鱼类体长与耳石长半径和短半径之间都存在极显著的线性回归关系(P<0.01)。在体长与耳石长半径的回归方程中, 有9种鱼类的R2值大于0.8, 回归方程的拟合效果较好, 其余3种鱼类(鳀、李氏鱼衔和箭鱼衔)的R2值相对较小(0.7
在12种饵料鱼类中, 有8种鱼类的体长与耳石长半径和耳石短半径回归方程之间的R2值比较接近;其余4种鱼类(鳀、、细条天竺鲷和箭鱼衔)2个回归方程的R2值相差较大, 拟合效果存在较大的差异,其中箭鱼衔的体长与耳石短半径(R2=0.930)的拟合效果要优于体长与耳石长半径(R2=0.750), 而其余 3种鱼类的体长与耳石长半径的拟合效果均优于体长与耳石短半径(表3)。
3 讨论
胶州湾位于黄海之滨, 山东半岛的南岸, 湾内平均水深7 m, 通过一个狭窄的湾口(约3.1 km)与黄海相通, 是一个典型的半封闭型浅海湾[19]。由于胶州湾沿岸有大量的淡水流入, 带来丰富的营养盐, 使得湾内水域生产力高, 饵料生物丰富, 是多种经济鱼、虾、蟹类繁殖、育幼和索饵的场所[19]。本文所研究的 12种鱼类均是目前胶州湾海域数量较为丰富的小型饵料鱼类[20,21], 它们既是小型低营养级饵料生物的捕食者, 又被许多高营养级肉食性鱼类所捕食,在海洋生物群落和食物网中占有重要的地位[22—24]。
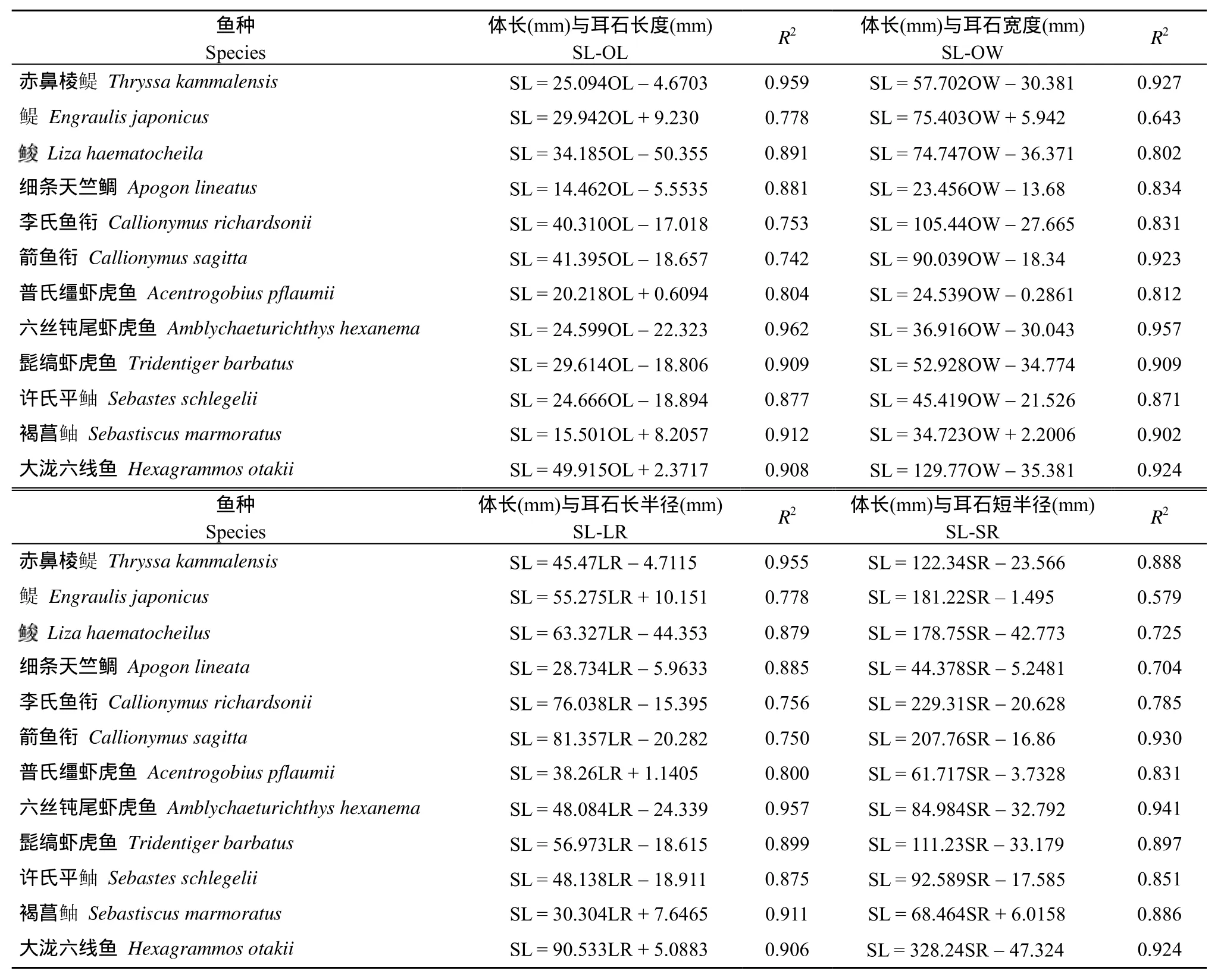
表3 胶州湾12种饵料鱼类体长与耳石长度、宽度、长半径和短半径的回归方程及其决定系数(R2)Tab.3 Regression equations and determination coefficient for fish standard length (SL) with otolith length (OL), width (OW), long radius (LR) and short radius (SR) for twelve prey fish species from Jiaozhou Bay
研究发现, 胶州湾12种饵料鱼类的体长与耳石长度、宽度、长半径和短半径之间均呈显著的线性相关, 这与国内外很多学者的研究结果相似[10,14,16,25]。在所有 48个线性回归方程中, 有 37个回归方程的R2值均大于0.8, 拟合效果较好; 有9个回归方程的R2值在0.7—0.8之间; 其余2个回归方程的R2值小于0.7, 拟合效果略差。其中, 各方程拟合效果都最好的是六丝钝尾虾虎鱼, 其R2值均接近于 1; 各方程拟合效果最差的是 鳀 , 其R2值均小于0.8。各个鱼种的拟合效果存在差异, 可能与不同鱼类及其耳石的生长速率和增长模式不同有关[16,24,26]。
通过比较同种鱼类各个回归方程的决定系数R2值可知, 在这12种饵料鱼类中, 多数鱼种体长与耳石长度和宽度的拟合效果要略好于体长与耳石半径的拟合效果, 而且与耳石半径相比, 耳石的长度和宽度更容易测量, 误差也较小, 因此在实际应用中,可以通过测量耳石的长度和宽度来推算饵料鱼类的体长等形态参数。另一方面, 由于多数鱼类的耳石比较脆, 尤其是耳石的前端更容易破损, 难以准确测量耳石的长度, 因此, 与耳石长度相比, 体长与耳石宽度的回归方程更加适合于实际应用, Pietro,et al.[14]也得出过相同的结论。
需要说明的一点是, 由于耳石在捕食者的胃中会经历一定程度的化学腐蚀或机械磨损[11,27], 因此通过测量胃含物中耳石的大小来推算鱼体长度时可能会存在一定程度的偏差, 因此, 需要进行相应的校对以减小误差。另外, 由于不同海域或不同种群的鱼类, 其体长和耳石的生长模式会存在一定的差异[28], 因此在将本文的研究结论应用于其他海域时,需要考虑到上述因素的影响。
[1] Dou S Z.An introduction to fish otolith research: techniques and applications [J].Studia Marina Sinica, 2007, 48:93—113 [窦硕增.鱼类的耳石信息分析及生活史重建—理论、方法与应用.海洋科学集刊, 2007, 48: 93-113]
[2] Petursdottir G, Begg G A, Marteinsdottir G.Discrimination between Icelandic cod (Gadus morhuaL.) populations from adjacent spawning areas based on otolith growth and shape[J].Fisheries Research, 2006, 80(2-3): 182—189
[3] Xiang J G, Xiang J, Wang X L,et al.Somatic and lapillus otolith ontogenetic growth and development in larval and juvenileElopichthys bambusarichardson in the Xiang River[J].Acta Hydrobiologica Sinica, 2011, 35(5): 817—822 [向建国, 向劲, 王星璐, 等.鳡湘江仔稚鱼个体和耳石生长发育研究.水生生物学报, 2011, 35(5): 817—822]
[4] Zhang G H, Dan S G, Miao Z G,et al.Otolith morphology of six cyprinid species with the use in species and stock discriminations [J].Acta Hydrobiologica Sinica, 1999, 23(6):683—688 [张国华, 但胜国, 苗志国, 等.六种鲤科鱼类耳石形态以及在种类和群体识别中的应用.水生生物学报,1999, 23(6): 683—688]
[5] Potier M, Ménard F, Benivary H D,et al.Length and weight estimates from diagnostic hard part structures of fish, crustacea and cephalopods forage species in the western Indian Ocean [J].Environmental Biology of Fishes, 2011, 92(3):413—423
[6] Fitch J E, Brownell R L.Fish otoliths in cetacean stomach and their importance in interpreting feeding habits [J].Journal of the Fisheries Research Board of Canada, 1968, 25(12):2561—2574
[7] Pierce G J, Boyle P R.A review of methods for diet analysis in piscivorous marine mammals [J].Oceanography and Marine Biology Annual Review, 1991, 29: 409—486
[8] Tollit D J, Steward M J, Thompson P M,et al.Species and size difference in the digestion of otoliths and beaks: placations for estimates of pinniped diet composition [J].Canadian Journal of Fisheries and Aquatic Sciences, 1997, 54(1):105—119
[9] Watanabe H, Kubodera T, Ichii T,et al.Feeding habits of neon flying squidOmmastraphes bartramiiin the transitional region of the central North Pacific [J].Marine Ecology Progress Series, 2004, 266: 173—184
[10] Gamboa D A.Otolith size versus weight and body-length relationships for eleven fish species of Baja California,Mexico [J].Fishery Bulletin, 1991, 89(4): 701—706
[11] Granadeiro J P, Silva M A.The use of otoliths and vertebrae in the identification and size-estimation of fish in predator-prey studies [J].Cybium, 2000, 24(4): 383—393
[12] Harvey J T, Loughlin T R, Perez M A,et al.Relationship Between Fish Size and Otolith Length for 63 Species of Fishes from the Eastern North Pacific Ocean [M].Seattle:NOAA/ National Marine Fisheries Service.2000, 150
[13] Waessle J A, Lasta C A, Favero M.Otolith morphology and body size relationships for juvenile Sciaenidae in the Río de la Plata estuary (35-36°S) [J].Scientia Marina, 2003, 67(2):233—240
[14] Battaglia P, Malara D, Romeo T,et al.Relationships between otolith size and fish size in some mesopelagic and bathypelagic species from the Mediterranean Sea (Strait of Messina, Italy) [J].Scientia Marina, 2010, 74(3): 605—612
[15] China State Bureau of Technical Supervision.Specifications for oceanographic survey—Part 6: Marine biological survey GB/T 12763.6-2007 [S].Beijing: China Standard Press.2007[中国国家技术监督局.海洋调查规范第6部分: 海洋生物调查GB/T 12763.6-2007.北京: 中国标准出版社.2007]
[16] Ou Y J, Liao R, Li J E,et al.Otolith growth characteristics ofCollichthys lucidusfrom the Pearl River Estuary [J].Chinese Journal of Zoology, 2012, 47(1): 88—95 [区又君, 廖锐, 李加儿, 等.珠江口鱼棘头梅童耳石的生长特性.动物学杂志, 2012, 47(1): 88—95]
[17] Anderson R O, Neumann R M.Length, weight and associated structural indices [A].In: Murphy B R, Wills D (Eds.),Fisheries Techniques [C].Bethesda: American Fisheries Society.1996, 447—481
[18] Du R Q.Biostatistics [M].Beijing: China Higher Education Press.1997, 69—211 [杜荣骞.生物统计学.北京: 高等教育出版社.1997, 69—211]
[19] Liu R Y.Ecology and Living Resources of Jiaozhou Bay[M].Beijing: Science Press.1992, 2—3 [刘瑞玉.胶州湾生态学和生物资源.北京: 科学出版社.1992, 2—3]
[20] Xu B D, Zhang F, Mei C,et al.Characteristics of fish community structure in the central Jiaozhou Bay in spring and summer [J].Chinese Journal of Applied Ecology, 2010,21(6): 1558—1564 [徐宾铎, 张帆, 梅春, 等.胶州湾中部海域春、夏季鱼类群落结构特征.应用生态学报, 2010,21(6): 1558—1564]
[21] Mei C, Xu B D, Xue Y,et al.Fish community structure and species diversity during autumn and winter in the central waters of Jiaozhou Bay [J].Journal of Fishery Sciences of China, 2010, 17(1): 110—118 [梅春, 徐宾铎, 薛莹, 等.胶州湾中部海域秋、冬季鱼类群落结构及其多样性研究.中国水产科学, 2010, 17(1): 110—118]
[22] Wei S, Jiang W M.Study on food web of fishes in the Yellow Sea [J].Oceanologia et Limnologia Sinica, 1992, 23(2):182—192 [韦晟, 姜卫民.黄海鱼类食物网的研究.海洋与湖沼, 1992, 23(2): 182—192]
[23] Tang Q S.Strategies of research on marine food web and trophodynamics between high trophic levels [J].Marine Fisheries Research, 1999, 20(2): 1—11 [唐启升.海洋食物网与高营养层次营养动力学研究策略.海洋水产研究,1999, 20(2): 1—11]
[24] Zhang B.Preliminary studies on marine food web and trophodynamics in China coastal seas [D].Thesis for Doctor of Science.Ocean University of China, Qingdao.2005 [张波.中国近海食物网及鱼类营养动力学关键过程的初步研究.博士学位论文, 中国海洋大学, 青岛.2005]
[25] Liu W, Zhan P R, Zhao C G,et al.Study on morphological development of fall chum salmon (Oncorhynchus keta) otoliths in Heilongjiang River [J].Acta Hydrobiologica Sinica,2010, 34(6): 1069—1076 [刘伟, 战培荣, 赵春刚, 等.黑龙江秋大麻哈鱼耳石形态发育研究.水生生物学报, 2010,34(6): 1069—1076]
[26] Xie Y H, Li B, Fu L J,et al.Daily growth increment in otolith and growth for fry—young fish of bighead (Aristichthys nobilis) [J].Journal of Fishery Sciences of China, 1995, 2(2):34—42 [解玉浩, 李勃, 富丽静, 等.鳙仔-幼鱼耳石日轮与生长的研究.中国水产科学, 1995, 2(2): 34—42]
[27] Jobling M, Breiby A.The use and abuse of fish otoliths in studies of feeding habits of marine piscivores [J].Sarsia,1986, 71(3—4): 265—274
[28] Campana S E, Casselman J M.Stock discrimination using otolith shape analysis [J].Canadian Journal of Fisheries and Aquatic Sciences, 1993, 50(5): 1062—1083
