淡水排放对杭州湾湿地浮游动物群落分布的影响
2013-07-24李共国屠霄霞王佩儿王自磐廖何朝兴杨季芳
李共国 屠霄霞 王佩儿 王自磐 廖何朝兴 杨季芳
(1.浙江万里学院生物与环境学院, 宁波 315100; 2.宁波市微生物与环境工程重点实验室, 宁波 315100;3.德国Alfred Wegener 极地与海洋研究所, 不来梅港 27570)
慈溪市杭州湾湿地是中国八大咸水湿地之一,位于杭州湾跨海大桥附近, 是我国长江口以南最大的连片淤积型滩涂, 目前正遭受来自陆地工农业、水产养殖和城镇生活等污水排放的污染[1]。近年来,一些学者开展了海湾浮游生物群落特征与水体富营养之间的相关性研究[2—5], 而另一些则研究了水文变化[6—8]和淡水排放等[9—11]对半咸水河口、港湾等浮游动物群落生态的影响。但对于往复性的不规则半日潮滩涂湿地的浮游动物群落生态及其受淡水排放影响的研究未见报道。浮游动物是海洋生态系统中的主要的次级生产者, 其动态变化对滩涂湿地的结构功能、渔业资源及环境质量产生重要的调控作用[12]。目前, 滩涂湿地浮游动物的相关资料尚属空白。本文试图通过周年调查杭州湾南岸滩涂湿地内陆排水区和非排水区浮游动物的群落结构, 探讨内陆排水对群落分布的影响, 为杭州湾南岸滩涂湿地渔业管理、环境监测和生态综合治理提供依据。
1 材料与方法
1.1 站位布设与采样方法
根据杭州湾南岸滩涂湿地的生态环境特点, 自靠近外海开始选取典型的受农业面源排污(S1)、内陆水产养殖排污(S2)、城镇生活污水排污(S3)、杭州湾跨海大桥东侧(S4)和西侧(S5)设置 5个采样断面,每个采样断面又分别设高潮位(SH)和中潮位(SM)2个采样站(高、中潮位间距约100 m), 共10个采样站(图 1)。采样断面的地理位置 S1: E 121°30.99 N 30°13.21, S2: E 121°26.29 N 30°17.71, S3: E 121°21.59 N 30°20.57, S4: E 121°10.74 N 30°20.77,S5: E 121°08.56 N 30°19.52。2010 年 4 月至 2011 年1月逐季采样, 采样和计数按 《淡水浮游生物研究方法》[13]进行, 定量样品用2.50 L采水器分别于该样站上、下水层, 各采10 L水样, 用25号筛绢制成的浮游生物网(网孔孔径 64 μm)过滤浓缩, 当即用5%甲醛溶液固定, 带回实验室镜检。温度、盐度、pH、溶解氧等环境参数用标定好的YSI 6000 水质分析仪进行现场测定。营养盐(TN、NH4-N、NO2-N、NO3-N、SiO3-Si、PO4-P、CODM)样品取样和分析,参考国家海洋局(1975) 文献进行测定。

图1 各采样断面及其站位分布Fig.1 Distribution of the sampling stations
1.2 标本鉴定与计算方法
轮虫种类按《中国淡水轮虫志》[14]鉴定, 生物量(湿重)按体积法[15]统计; 枝角类和桡足类分别按中国动物志(淡水枝角类)和(淡水桡足类)[16—18]鉴定,生物量分别按各自的体长-体重回归方程式[19,20]计算。桡足幼体和成体数量按该种桡足类成体出现频率乘以样本总数计算。浮游动物物种丰富度按Margalef指数计算公式:d= (S− 1) / lnN,S为群落种类数,N为群落密度。
1.3 数据处理
用 DPS数据处理软件[21]进行显著性差异检验,以及各采样站营养盐年均浓度与浮游动物群落指标平均值之间的相关性分析。
2 结果
2.1 水体水质理化指标
非排水区水体除pH、盐度以及高潮位的NO3-N、SiO3-Si和CODMn含量略高于排水区的外, 水质的其他参数均以排水区较高, 特别是营养盐 NH4-N、NO2-N和PO4-P含量尤为突出, NH4-N、NO2-N含量在排水区和非排水区的差异达到了显著水平, 排水区中潮位PO4-P含量比非排水区中潮位也将近高出1倍(表1)。另外, 排水区中潮位的各种营养盐浓度均高于高潮位, 特别是中潮位 NH4-N、NO2-N和 PO4-P含量分别高出高潮位25.22%、32.54% 和29.00%。非排水区高、中潮位间营养盐浓度相差幅度较小。
2.2 浮游动物群落种类组成及其优势种
经周年调查, 共记录浮游动物38种, 其中轮虫15种, 枝角类 4种, 桡足类 19种(表 2)。除短角蠕形猛水蚤(Horsiella brevicornis)发现于非排水区域外, 其余浮游动物均出现在排水区域。轮虫、枝角类和剑水蚤等淡水种类在非排水区域分布较少, 但哲水蚤、猛水蚤种类在排水和非排水区域分布相当。排水区域浮游动物年平均密度为88.89 ind./L, 高潮区和中潮区均中以轮虫为主, 占 71.40%, 其次为桡足类, 占 27.30%, 枝角类仅占 1.30%。非排水区域浮游动物年平均密度仅 4.21 ind./L, 以桡足类为主,高潮区和中潮区分别占 73.50%和 88.20%, 其次为轮虫, 高潮区和中潮区分别占 26.50%和 7.80%。根据种群的年均密度, 排水区域各类浮游动物的优势种为萼花臂尾轮虫(Brachionus calyciflorus)、短尾秀体 溞 (Diaphanosoma brachyurum)、台湾温剑水蚤(Thermocyclops taihokuensis)、汤匙华哲水蚤(Sinocalanus dorrii)和三角大吉猛水蚤(Tachidius triangularis), 它们均为淡水种类, 且多以中潮区的种群密度较高; 而非排水区域仅桡足类形成稳定种群, 较常见的种群有四刺窄腹剑水蚤(Limnoithona tetraspina)、中华哲水蚤(Calanus sinicus)和跛足猛水蚤(Mesochra), 它们均为咸淡水种类。
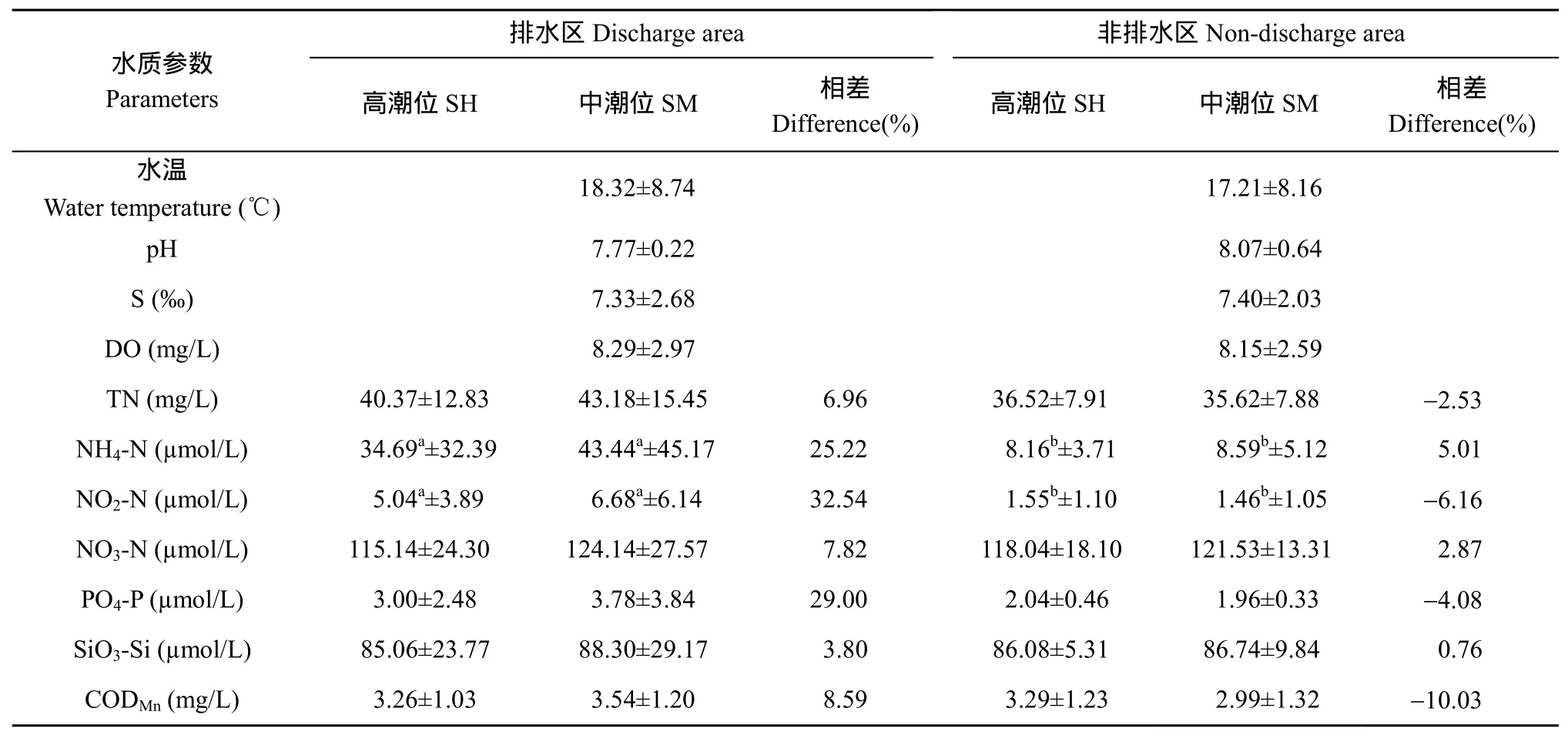
表1 杭州湾南岸滩涂湿地采样站水体水质参数(平均值±标准差)Tab.1 Water quality parameters in the sampling stations in the southern coastal wetlands of the Hangzhou Bay (mean ± SD)
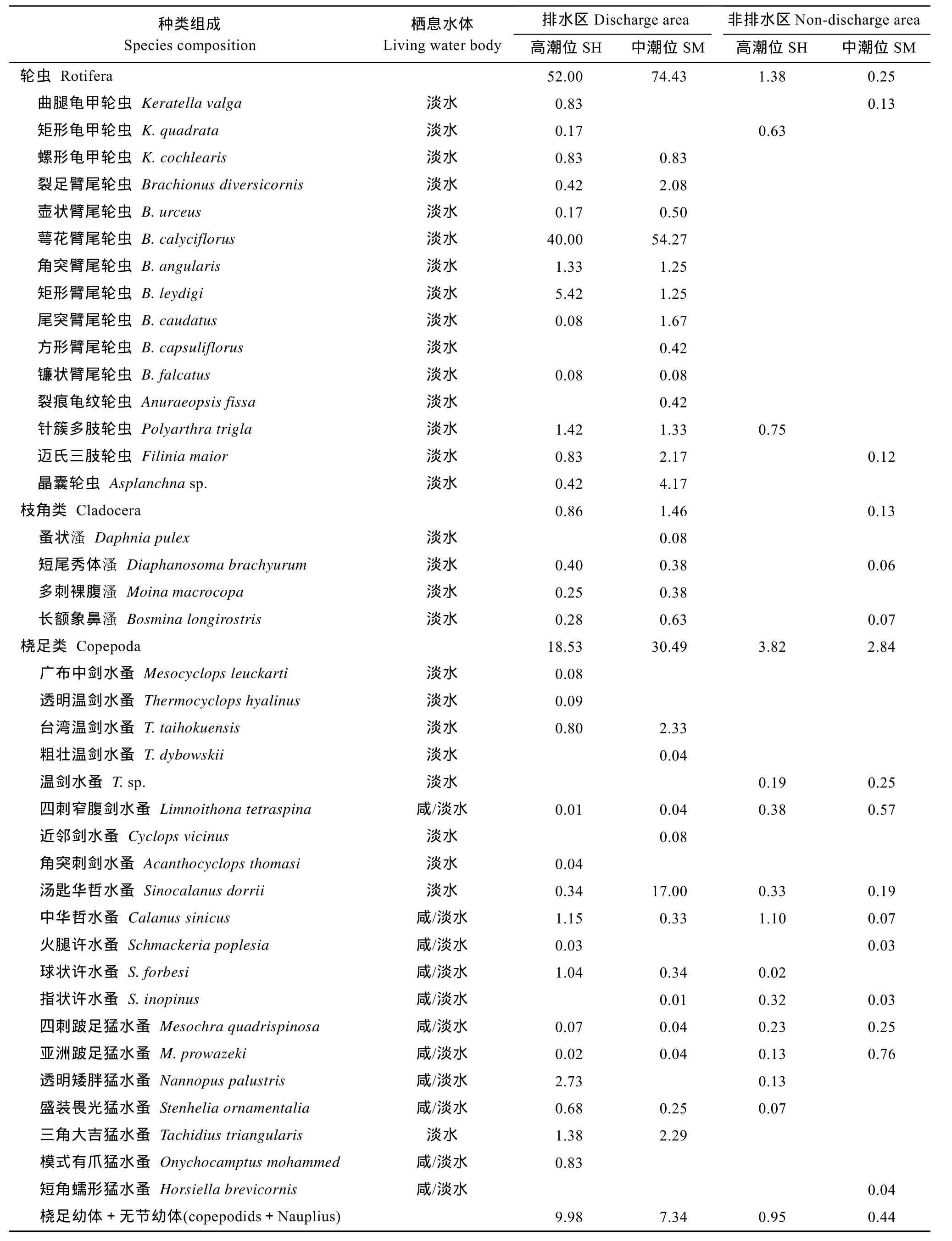
表2 杭州湾南岸滩涂湿地浮游动物的种类组成和种群密度Tab.2 Composition of Zooplankton species composition and average density in the southern coastal wetlands of Hangzhou Bay (ind./L)
2.3 浮游动物生物量的时空变化
排水区域浮游动物群落年均生物量, 以中潮位(0.41 mg/L)>高潮位(0.30 mg/L), 以哲水蚤为主, 其次为轮虫; 而非排水区域则以高潮位(0.10 mg/L)>中潮位(0.03 mg/L), 高潮位中以哲水蚤占绝对优势(94.80%), 中潮位中除哲水蚤(60.00%)外, 猛水蚤生物量也占20.00%(图2)。
排水区域群落生物量在春季形成高峰, 主要为哲水蚤, 其次是以轮虫为主的秋、冬季, 夏季生物量进入低谷。非排水区域群落生物量的季节变化由哲水蚤决定, 春、秋季较高, 夏季和冬季较低(图3)。
2.4 浮游动物群落分布特征
在各采样断面中, 以排水区域的 S2-S3断面中潮位浮游动物密度、生物量的平均值及其标准差较大, 其中, 浮游动物密度及其标准差以S2M站最大;生物量平均值以S2M站最大, 标准差则以S3M站最大。S2断面的种类数和物种丰富度最高, S3断面的高潮位虽有较多的群落种类, 但物种丰富度最低。排水区域的S1断面和非排水区域的S4-S5断面的群落指标差异不大(表3)。浮游动物群落生态指标与环境营养因子之间的关系密切, 群落种类数、密度、生物量分别随着 NH4-N、NO2-N、PO4-P、CODMn值的增大而显著或极显著地增大; 群落密度和种类数随着 TN含量的升高而显著增大, 物种丰富度则与 NO3-N、SiO3-Si含量之间有显著的正相关性(表 4)。
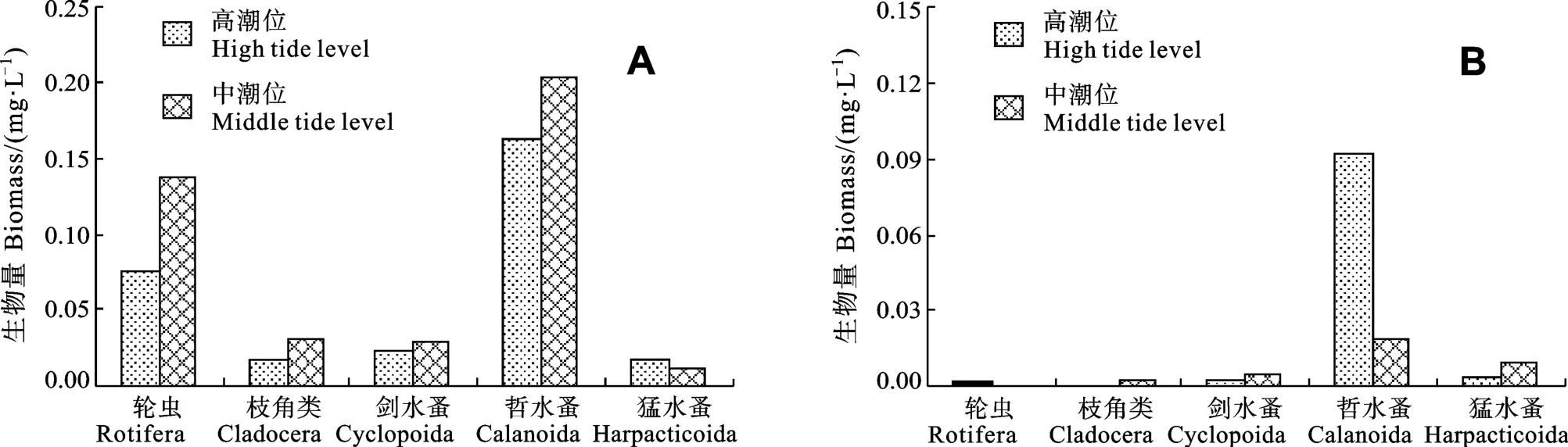
图2 排水区(A)和非排水区(B)不同潮位各类浮游动物的生物量分布Fig.2 Distributions of population biomass in different tide level in the discharge area (A) and non-discharge area (B)

图3 排水区(A)和非排水区(B)各类浮游动物生物量的季节变化Fig.3 Seasonal changes of population biomass in the discharge area (A) and non-discharge area (B)
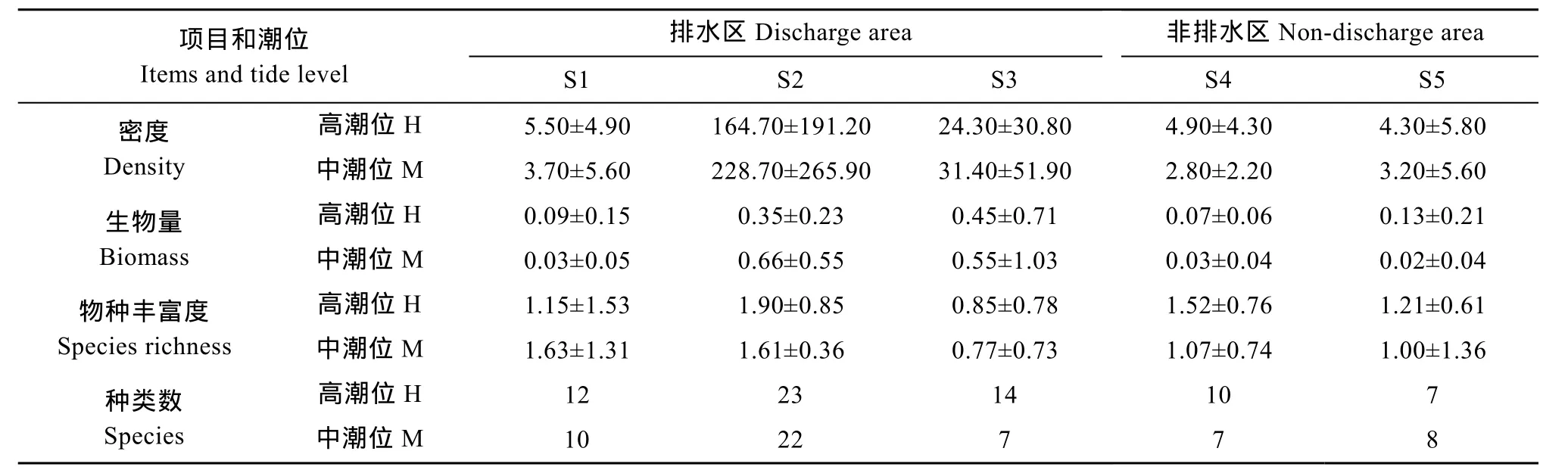
表3 杭州湾南岸滩涂湿地浮游动物种类数、密度(ind./L)、生物量(mg/L)和物种丰富度(平均值±标准差)Tab.3 Number of zooplankton species, density (ind./L), biomass (mg/L) and species richness in the southern coastal wetlands of Hangzhou Bay (mean ± SD)
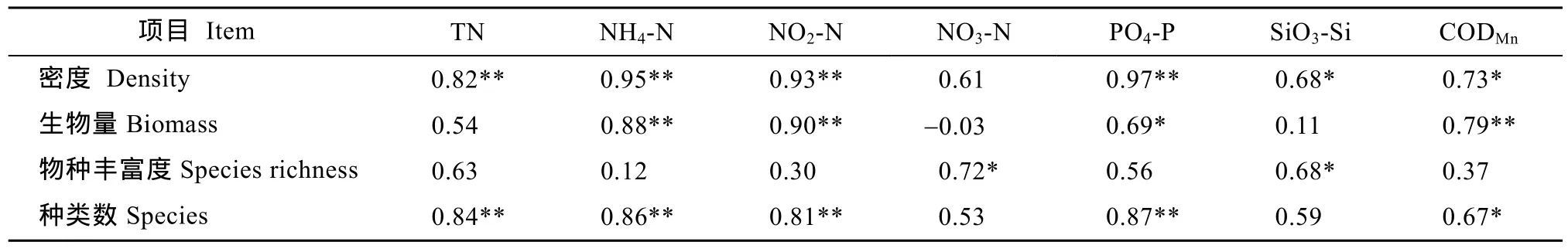
表4 浮游动物群落指标与水质参数之间的相关系数Tab.4 Correlations between number of zooplankton species, density, biomass, species richness and water parameters
3 讨论
咸淡水交汇区盐度的变异来自淡水河流的排放,且排放量与盐度之间呈极显著的负相关关系[22]。随着内陆淡水不断排入湿地, 水体盐度逐渐下降, 杭州湾滩涂湿地排水区浮游动物的淡水种类明显增多,达73.00%(表2), 群落密度以轮虫为主, 生物量以桡足类为主, 轮虫和桡足类的第一优势种分别为萼花臂尾轮虫和汤匙华哲水蚤, 这与杭州湾滩涂湿地的鱼类以淡水种类最多, 且丰度最大的情形相一致[23];而非排水区群落种类则以半咸水种为主, 淡水种类仅占 44.40%, 群落密度和生物量均以桡足类为主,常见种为中华哲水蚤和跛足猛水蚤等。Medeiros,et al.[9]研究盐度和淡水排放对巴西一个半干旱港湾轮虫分布时发现, 有大量淡水排入的雨季是影响轮虫群落组成的主要因素, 而在高盐度和干旱季节, 轮虫的种类丰度和密度均很低。滩涂湿地中轮虫、枝角类、剑水蚤等淡水种类主要分布在盐度含量最低(5.90‰)的S2断面(水产养殖排污口), 可见, 水产养殖排出的废水量最大, 同时携带的淡水浮游动物数量及其变动幅度也最大(表3); 从S3(生活排污口)断面水体盐度(7.30‰)及其下降情况, 推测其也有一定量的排水量, 尽管S3断面的群落种类数和密度明显低于S2断面, 但其群落生物量及其变动幅度最大,这与城镇生活污水除排放生活营养物质、排热等适于生物生长繁殖外, 还可能受到其他不利于生物生长栖息的因素存在, 如对桡足类较为敏感的需氧废水[10], S3断面夏季DO值为全年最低3.84 mg/L, 桡足类生物量也降至谷底0.01 mg/L, 从而导致浮游动物种群剧烈波动, 这与Uriarte,et al.[11]对受污海湾的桡足类丰度和分布的研究结果相类似; S1(农业排污口)断面的盐度达 8.80‰, 排水量最小, 浮游动物群落指标更接近于非排水区的S4-S5断面。群落的季节变化可能与生物种群的季节适应性和内陆水源中浮游动物组成有关, 非排水区群落生物量的季节变化为春>秋>夏>冬, 这与李强等[24]研究崇明东滩潮沟浮游动物数量分布的季节变化相一致, 而排水区秋冬季的群落生物量较大, 主要由轮虫组成, 可能是轮虫在夏秋季密度上升时, 受到养殖鱼类的捕食,使其高峰期推迟到秋冬季出现有关[25]。
水文效应和营养富集是决定沿海湿地浮游动物时空格局的主要因素[7,26]。潮沟是滩涂湿地重要的地貌形态, 是连接邻近水域生态系统和滩涂湿地生态系统的纽带[24]。杭州湾滩涂湿地由内河周期性排水冲刷形成的潮沟, 并被下海渔民利用成为滩涂上的通道, 由于靠近排水口(高潮位)的潮沟大而深,靠近大海(中潮位)的潮沟小而浅, 淡水排放的径流易由位于中潮位浅小的潮沟漫向四周, 遂后被周而复始的潮汐带至高潮位, 这种淡水排放模式类似于“淡水”潮汐作用于滩涂湿地, 并成为后者无机和有机物的来源[27]。一方面, “淡水”潮汐带来的大量无机营养盐、浮游细菌和藻类等, 通过食物链作用促使浮游动物(特别是哲水蚤)增殖[28]; 另一方面, “淡水”潮汐携带的营养盐和淡水浮游动物首先释放于中潮位滩涂中, 这直接导致主要排水断面S2和S3中潮位的水质营养盐浓度、浮游动物密度和生物量等都明显大于高潮位, 并补充了湿地群落的丰度。由于淡水排放的无机和有机物随时空变化极大, 特别是与淡水排放量、排放频率以及物质浓度等关系密切[27],湿地浮游动物群落丰度的上述两种增量已很难评估。因此, 群落种类数、密度、生物量随着NH4-N、NO2-N、PO4-P、CODMn浓度的增大而显著或极显著增大的原因, 可能并不仅仅是由这些生源要素和营养关系决定, 同时还受到排水携带量(营养盐和淡水浮游动物)、潮沟径流特征和潮汐共同影响的结果。随着环境中有机物质的降解, 硝化作用的推进, 生态环境不断得到改善, 浮游动物的物种丰富度明显上升, 从而使NO3-N含量与物种丰富度呈现出显著的正相关性。当然, 这里可能也有淡水浮游动物密度随水文条件变化而被不断稀释, 提高了群落物种丰富度的因素。
[1] Wang M Z.Environment and shellfish culturing in shoals along the southern coast of Hangzhou Bay [J].Rural Eco-Environmen, 2005, 21(4): 33—37 [王美珍.杭州湾南岸滩涂环境状况及与贝类养殖的关系.农村生态环境, 2005,21(4): 33—37]
[2] Zhang S Y, Shao J B, Dai X J.Studies on eutrophication and phytoplankton diversity in Hangzhou Bay [J].Journal of Fisheries of China, 2001, 25(6): 512—517 [章守宇, 邵君波,戴小杰.杭州湾富营养化及浮游植物多样性问题的探讨.水产学报, 2001, 25(6): 512—517]
[3] Song X K, Liu A Y, Ma Y Q,et al.Study on the plankton community in the sea area of Dongying in dry season [J].Transactions of Oceanology and Limnology, 2010, 32(1):95—102 [宋秀凯, 刘爱英, 马元庆, 等.东营近海枯水期浮游生物群落特征研究.海洋湖沼通报, 2010, 32(1): 95—102]
[4] Lan W L, Peng X Y.Eutrophication status and its impact on phytoplankton biomass in the Maowei Sea [J].Journal of Guangxi Academy of Sciences, 2011, 27(2): 109—112, 116[蓝文陆, 彭小燕.茅尾海富营养化程度及其对浮游植物生物量的影响.广西科学院学报, 2011, 27(2): 109—112,116]
[5] Mialet B, Gouzou J, Azémar F,et al.Response of zooplankton to improving water quality in the Scheldt estuary (Belgium) [J].Estuarine,Coastal and Shelf Science, 2011, 93:47—57
[6] Peng J H, Zheng J X, Ma P M,et al.Comparison of planktonic crustaceans in north and south branches at Yangtze River estuary and impact prediction of South-to-North Water Transfer Project [J].Chinese Journal of Ecology, 2008,27(11):1948—1954 [彭建华, 郑金秀, 马沛明, 等.长江口南北支浮游甲壳动物的比较及南水北调工程影响预测.生态学杂志, 2008, 27(11): 1948—1954]
[7] Badosa A, Boix D, Brucet S,et al.Nutrients and zooplankton composition and dynamics in relation to the hydrological pattern in a confined Mediterranean salt marsh (NE Iberian Peninsula) [J].Estuarine,Coastal and Shelf Science,2006, 66: 513—522
[8] Frisch D, Moreno-Ostos E, Green A J.Species richness and distribution of copepods and cladocerans and their relation to hydroperiod and other environmental variables in Doñana,south-west Spain [J].Hydrobiologia, 2006, 556: 327—340
[9] Medeiros A M A, Barbosa J E L, Medeiros P R,et al.Salinity and freshwater discharge determine rotifer distribution at the Mossoró River Estuary (Semiarid Region of Brazil) [J].Brazilian Journal of Biology, 2010, 70(3): 551—557
[10] Nour El-din N M, Al-khayat J A.Impact of industrial discharges on the zooplankton community in the Messaieed Industrial, Area, Qatar (Persian Gulf)[J].International Journal Environment Studies, 2001, 58: 173—184
[11] Uriarte I, Villate F.Differences in the abundance and distribution of copepods in two estuaries of the Basque coast (Bay of Biscay) in relation to pollution [J].Journal of Plankton Research, 2005, 27(9): 863—874
[12] Li Q, An C G, Ma Q,et al.Species composition and diversity of zooplankton in tidal creeks of the Chongming Dongtan intertidal flat [J].Biodiversity Science, 2010, 18(1): 67—75 [李强, 安传光, 马强, 等.崇明东滩潮间带潮沟浮游动物的种类组成及多样性.生物多样性, 2010, 18(1): 67—75]
[13] Zhang Z S, Huang X F.Methods for Study on Freshwater Plankton [M].Beijing: Science Press.1991, 358—371 [章宗涉, 黄祥飞.淡水浮游生物研究方法.北京: 科学出版社.1991, 358—371]
[14] Wang J J.Fauna Sinica of Chinese Freshwater Rotifera [M].Beijing: Science Press.1961, 69—254 [王家楫.中国淡水轮虫志.北京: 科学出版社.1961, 69—254]
[15] Huang X F.Application of the simplified method of weight determination to various species of planktonic rotifers in Lake Donghu, Wuhan [J].Acta Hydrobiologica Sinica, 1981,7(3): 409—416 [黄祥飞.简易测重法在武汉东湖轮虫常见种中的应用.水生生物学集刊, 1981, 7(3): 409—416]
[16] Jiang X Z, Du N S.Fauna Sinica, Crustacea, Freshwater Cladoceran [M].Beijing: Science Press.1979, 86—171 [蒋燮治, 堵南山.中国动物志(淡水枝角类).北京: 科学出版社.1979, 86—171]
[17] Fauna Editorial Committee, Academia Sinica.Fauna Sinica,Crustacea, Freshwater Copepoda [M].Beijing: Science Press.1979, 60—420 [中国科学院动物研究所甲壳动物研究组编.中国动物志(淡水桡足类) .北京: 科学出版社.1979, 60—420]
[18] Zhang W C, Zhao N, Tao Z C,et al.An illustrated Guide to Marine Planktonic Copepods in China Seas [M].Beijing:Science Press.2010, 1—463 [张武昌, 赵 楠, 陶振铖, 等.中国海浮游桡足类图谱.北京: 科学出版社.2010, 1—463]
[19] Huang X F, Hu C Y.Length-weight equation of various species of freshwater Cladocera [A].In: Academic Theses Editorial Committee, Crustacea (Eds.), Crustacea academic theses (The first series) [C].Beijing: Science Press.1986, 147—157 [黄祥飞, 胡春英.淡水常见枝角类体长—体重回归方程式.甲壳动物学论文(第一辑).北京: 科学出版社.1986,147—157]
[20] Chen X M.Biomass calculation of freshwater copepods [J].Acta Hydrobiogica Sinica,1981, 7(3): 397–408 [陈雪梅.淡水桡足类生物量的测算.水生生物学集刊, 1981, 7(3):397—408]
[21] Tang Q Y, Feng M G.DPS Data Processing System— Experimental Design, Statistical Analysis and Data Mining [M].Beijing: Science Press.2007, 59—636 [唐启义, 冯明光.DPS数据处理系统—实验设计、统计分析及数据挖掘.北京: 科学出版社.2007, 59—636]
[22] Beusekom J E E, Weigelt-Krenz S, Martens P.Long-term variability of winter nitrate concentrations in the Northern Wadden Sea driven by freshwater discharge, decreasing riverine loads and denitrification [J].Helgoland Marine Research, 2008, 62: 49—57
[23] Jia X H, Zhang H, Jiang K Y,et al.Seasonal changes of fish species composition and diversity in mudflat wetlands of Hangzhou Bay [J].Chinese Journal of Applied Ecology,2010, 21(12): 3248—3254 [贾兴焕, 张衡, 蒋科毅, 等.杭州湾滩涂湿地鱼类种类组成和多样性季节变化.应用生态学报, 2010, 21(12): 3248—3254]
[24] Li Q, An C G, Xu L L,et al.Quantitative analysis of distribution and variations of zooplankton in tidal creeks of Chongming island [J].Oceanologia et Limnologia Sinica,2010, 41(2): 214—222 [李强, 安传光, 徐霖林, 等.崇明东滩潮沟浮游动物数量分布与变动.海洋与湖沼, 2010,41(2): 214—222]
[25] Milstein A, Valdenberg A, Harpaz S.Fish larvae: zooplankton relationships in microcosm simulations of earthen nursery ponds.II.Brackish water system [J].Aquaculture International, 2006, 14: 431—442.
[26] Michael E S, Gregory S P, Anett S T,et al.Hydrology and nutrient effects on food-web structure in the Lake Superior Coastal Wetlands [J].Wetlands, 2006, 26(4): 951—964
[27] Lehman P W, Mayr S, Mecum L,et al.The freshwater tidal wetland Liberty Island, CA was both a source and sink of inorganic and organic material to the San Francisco Estuary[J].Aquatic Ecology, 2010, 44: 359—372
[28] James N H, Simon M M, Tsuyoshi-Kobayashi,et al.Responses of estuarine bacterioplankton, phytoplankton and zooplankton to dissolved organic carbon (DOC) and inorganic nutrient additions [J].Estuaries and Coasts, 2010, 33:78—91
