不同水质水对体外溶血试验的影响
2013-07-23朱春花曲保恩
高 梅,朱春花,曲保恩
(山东省医药工业研究所,山东省化学药物重点实验室,山东 济南 250101)
水质指的是水体的物理(如色度、浊度、臭味等)、化学(无机物和有机物的含量)和生物(细菌、微生物、浮游生物、底栖生物)的特性及其组成的状况。实验室中的用水一般为饮用水、各种纯化水、注射用水等。饮用水(Drinking water)为天然水经净化处理所得的水;纯化水(Purified water)为原水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水,不含任何附加剂;注射用水(Water for injection)是以纯化水作为原水,经特殊设计的蒸馏器蒸馏、冷凝冷却后经膜过滤制备而得的水。《化学药物刺激性、过敏性和溶血性研究技术指导原则》[1]规定:凡是注射剂和可能引起免疫性溶血或非免疫性溶血反应的其他药物制剂均应进行溶血性试验,附录中溶血试验方法推荐的阳性对照管为蒸馏水。为比较饮用水、各种纯化水、灭菌注射用水等不同水质水对阳性结果的影响,故进行本实验,以便得出在溶血试验中溶血效果更好的阳性对照。
1 材料与方法
1.1 材料
1.1.1 仪器
单列二孔恒温水温锅,型号 DZKEW-C,上海树立仪器仪表有限公司;台式低速大容量离心机,型号TDL-5型,江苏省金坛市医疗仪器厂;紫外分光光度计,型号 UV2201型,日本岛津公司;自动双重纯水蒸馏器,型号SZ-93A,上海亚荣生化仪器厂。
1.1.2 动物
新西兰兔,体重2.5Kg左右,雌雄不限,由济南西岭角养殖繁育中心提供,实验动物生产许可证号【SCXK(鲁)20100005】。取血在本中心普通环境动物实验设施进行,实验动物使用许可证号【SYXK(鲁)20100004】。
1.2 方法[2-5]
1.2.1 几种水质的准备
灭菌注射用水:批号1208222购自天津药业集团新郑股份有限公司;纯净水:批号20120331购自娃哈哈集团有限公司;双蒸水:本中心采用自动双重纯水蒸馏器制备;去离子水:由济南诚言经贸有限公司提供;纯水:本中心采用动物饮用纯水处理器制备。
1.2.2 2%红细胞悬液制备
采用家兔心脏取血方法,取血约10 mL。将血液迅速置烧杯中,用竹签搅拌去除纤维蛋白原,使成脱纤血液。加入约10倍量的0.9%氯化钠注射液,混匀后离心15 min(1500 r/min),去除上清液,再加入0.9%氯化钠注射液按上述方法反复洗涤2~3次,至上层液体不显红色为止。将所得红细胞用0.9%氯化钠注射液稀释成2%(V/V)的混悬液备用。
1.2.3 溶血试验
取洁净试管7支,进行编号,1~7号管为不同水质管,分别为纯水、双蒸水、灭菌注射用水、去离子水、纯净水、饮用水、0.9%氯化钠注射液。按表1所示依次加入2%红细胞混悬液、0.9%氯化钠注射液或各种水质,每个编号设3个平行管将各管轻轻摇匀,立即置恒温水浴锅中(37±0.5)℃保温3 h。
1.2.4 结果判断标准
1.2.4.1 常规溶血试验体外试管法(肉眼观察法)
若试管底无细胞残留或有少量红细胞残留,溶液呈澄明红色,表示完全溶血,记为“+”;若试管中红细胞逐渐下沉,上层液体无色澄明或药物颜色澄明,表明无溶血发生,记为“-”;若试管中红细胞逐渐下沉,试管底有大量红细胞残留,溶液呈澄明红色,表示部分溶血,记为“±”。若溶液中有棕红色或或红棕色絮状沉淀,振摇试管后絮状沉淀不分散,或用滴管吸取凝聚的絮状物滴在载玻片上,在凝聚物边缘滴加2滴0.9%氯化钠注射液,置显微镜下观察,凝聚物不被冲散者为真凝聚,记为“+”;若溶液中有棕红色或红棕色絮状沉淀,振摇试管后絮状沉淀均匀分散开,或用滴管吸取凝聚的絮状物滴在载玻片上,在凝聚物边缘滴加2滴0.9%氯化钠注射液,置显微镜下观察,凝聚物能被冲散者为假凝聚,记为“-”。
1.2.4.2 改进的体外溶血试验法(分光光度法)
恒温水浴锅37℃温孵3 h,离心15 min(1500 r/min),每管取上清3 mL于石英杯中,用分光光度计测定。0.9%氯化钠注射液调零后,于545 nm波长处测定各管上清液吸收度。
1.2.5 数据统计处理法
采用DAS1.0软件对各管的吸光度值进行统计分析,结果以表示。
2 结果
2.1 体外溶血肉眼观察
将不同水质水与2%兔血红细胞混合,通过肉眼观察其溶血程度。结果见表2。试验结果表明,纯水、双蒸水、灭菌注射用水、去离子水、纯净水、饮用水等几种不同水质水均有溶血现象发生,但是溶血程度不同。纯水、双蒸水、灭菌注射用水、去离子水、纯净水等5种水质随着时间的延长,肉眼观察并无差异,上清均为澄明红色,而饮用水随着时间的延长,红细胞破裂较少,大量红细胞下沉,上清为澄明淡黄色。显微镜下观察,饮用水管红细胞数量明显多于其它各管,各管均未见红细胞凝聚。各管经振摇后可见红细胞均匀散开,证明无红细胞凝聚。
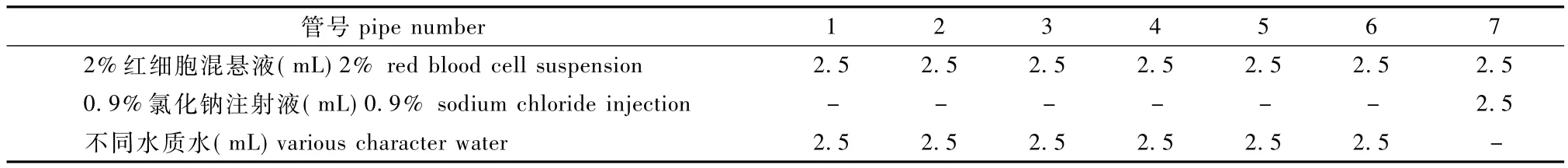
表1 体外溶血试验加样表Tab.1 Sample list of hemolysis test in vitro

表2 几种不同水质水的溶血作用(肉眼观察法)Tab.2 Hemolysis of several character water(macroscopic observation methods)
2.2 体外溶血的吸光度比较
分别用紫外分光光度计测定各管的吸光度,测定其对红细胞的影响。结果见表3。试验结果表明,分光光度计法与肉眼观测结果一致,溶血程度轻的饮用水管吸光度也小,其它各管吸光度也有差异。几种水质对兔血红细胞的溶血程度为灭菌注射用水>纯净水 >双蒸水 >纯水 >去离子水 >饮用水。
3 讨论
天然水质中通常含有很多杂质,包括电解质、有机物质、颗粒物、微生物和溶解气体等,生活中的饮用水其质量必须符合国家的标准GB5749—2006《生活饮用水卫生标准》。水的纯化,就是指去掉这些杂质,杂质去除的越彻底,水也就越纯净。蒸馏
水与超纯水,去离子水,其实都是纯度非常高的水,水中的杂质含量很少,一般电导率都在1us/cm以下,主要区别在于制作工艺的不同,以及有些杂质含量有区分。去离子水的制备是饮用水完全或不完全地去除离子物质,主要采用过RO膜和混床树脂处理方法;蒸馏水的制备则是利用液体混合物中各组分挥发度的差别,使H2O汽化并随之使蒸气部分冷凝分离而得的水,双蒸水是指将经过一次蒸馏后的水,再次蒸馏所得到的水;纯水也称RO水,是通过反渗透膜过滤后的水,反渗透膜的孔径一般为10~100A之间,所以它能够去除95%以上的离子态杂质;纯净水也称为双级反渗透水、双级RO水,娃哈哈纯净水采用美国二级反渗透技术,注射用水是纯化水再次蒸馏得到,中国药典则规定注射用水的生产工艺必须是蒸馏,可以分别以纯化水、去离子水等为源水,制备得到符合标准的注射用水。按2010版中国药典规定[6],饮用水可作为药材净制时的漂洗、制药用具的粗洗用水,纯化水可作为配制普通的药物制剂溶剂或试验用水,不得用于注射剂的配制与稀释,注射用水可作为配制注射剂用的溶剂,灭菌注射用水用于灭菌粉末的溶剂或注射液的稀释剂。由此可见,水的等级顺序由低到高依次是是饮用水、去离子水、纯水(RO水)、双蒸水、纯净水(双级反渗透水、双级RO水)、灭菌注射用水。
对溶血试验操作报道的文献较多,方法不尽相同,程大任等[7]就其不同的方法以及可能会对结果产生影响的条件进行了考察,结果显示,动脉或静脉血用于试验对溶血结果没有显著影响,故本实验采用易于操作的心脏取血法。本试验研究结果表明:灭菌注射用水、纯净水、双蒸水、纯水、去离子水、饮用水等几种水质,均能发生肉眼及显微镜下可见的溶血反应,但同时也可以看到,不同水质对家兔红细胞的溶血反应不尽相同。由试验结果可知,水的纯度越大,所含离子越少,吸光度越高,溶血反应越大。在溶血试验中阳性对照推荐使用灭菌注射用水。
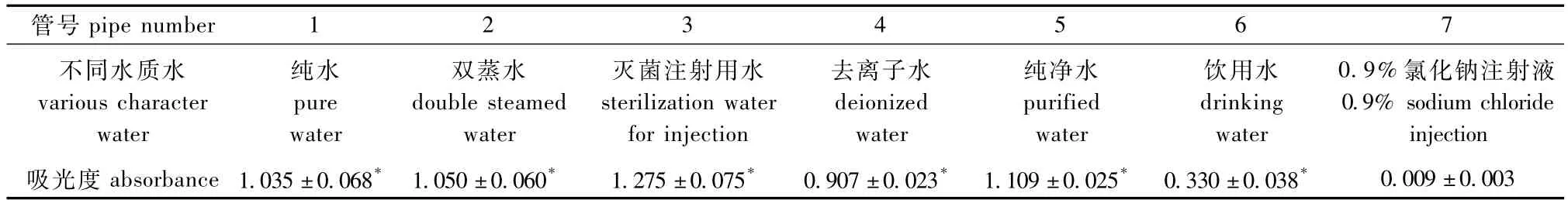
表3 几种不同水质水的溶血作用(分光光度法)(n=3)Tab.3 Hemolysis of several character water(spectrophotometry)
[1]化学药物刺激性、过敏性和溶血性研究技术指导原则》课题研究组.化学药物刺激性、过敏性和溶血性研究技术指导原则[S].国家食品药品监督管理局药品审评中心,2005:25-27.
[2]沈放,杨黎江,彭永芳,等.重楼皂苷类化合物溶血作用研究[J].时珍国医国药,2010,21(9):2280-2281.
[3]邓元荣,卓仪荣,王玲.油茶皂苷的体外溶血试验研究[J].海峡药学,2008,20(12):9-32.
[4]张剑峰,项峥,窦德强.血塞通注射液溶血检测方法研究[J].中国现代中药,2011,13(1):34-38.
[5]袁伯俊,廖明阳,李波.药物毒理学试验方法与技术[M].第1版.北京:化学工业出版社,2007:259-261.
[6]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录XVI.
[7]程大任,付锐,窦德强.人参皂苷溶血及抗溶血作用研究[J].中国现代中药,2007,9(4):19-23.
