利用质谱分析法从酶谱鉴定嗜热真菌木聚糖酶
2013-07-22吴亚宁刘刚余少文李水明王娟
吴亚宁,刘刚,余少文,李水明,王娟,*
(1.深圳大学生命科学学院,深圳市微生物基因工程重点实验室,广东深圳 518060;2.深圳大学生命科学学院,深圳市海洋生物资源与生态环境重点实验室,广东深圳 518060)
嗜热真菌是一类最低生长温度为20 ℃或20 ℃以上,最高生长温度为50 ℃或50 ℃以上的特殊真菌类群[1-2]。因其极端的生长环境,其内部蕴含大量的耐高温降解酶系,是耐高温酶的主要来源。因此,从分离的嗜热真菌中鉴定耐高温的木质纤维素降解酶、克隆相关基因,在可再生生物资源的有效利用方面具有重要社会和经济意义。
随着生物质谱技术的快速发展,质谱分析为蛋白质的鉴定提供了重要的技术保障,使蛋白质的鉴定更加快速化、准确化和灵敏化,从而可以在蛋白质水平上得到更多的基因表达信息,这对促进生命科学的发展具有重要的意义。而蛋白酶做为蛋白质家族的重要成员,其对生命活动的调控发挥着巨大作用,所以利用质谱技术对蛋白酶的快速鉴定,无疑可加快人们对蛋白酶的开发利用。目前,质谱分析技术在酶鉴定中的应用已越来越广泛。如孙明忠等利用激光解吸飞行时间质谱对白眉蝮蛇蛇毒酶进行了研究[3];吕磊等利用生物质谱对耐药相关果糖二磷酸醛缩酶C 进行了分析与鉴定[4];黄河清等利用基质辅助激光解吸/电离质谱法对海兔卵多肽内切酶的组成、结构与功能进行了研究[5];Peterson 等使用质谱分析法鉴定了真菌的甘露聚糖酶[6]。
木聚糖酶是一类可以将木聚糖降解成低聚木糖或木糖的复合酶系,广泛应用于造纸、食品、饲料等行业。本文利用质谱技术对嗜热踝节菌中诱导与非诱导酶谱差异条带进行分析,成功鉴定到一个糖苷第11 家族的内切木聚糖酶TtXynA,并通过TAIL-PCR 扩增获得其全长序列,该基因是从嗜热踝节菌中克隆到的第一个木聚糖酶基因。
1 材料与方法
1.1 菌株的培养
1.1.1 培养基
PDA 培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂15 g/L~20 g/L。
液体种子培养基:Mandels 营养盐浓缩液100 mL/L,Mandels 微量元素浓缩1.0 mL/L,葡萄糖10 g/L,蛋白胨1 g/L,1 mol/L 的柠檬酸缓冲液(pH4.5)50 mL/L,吐温80 1.5 mL/L。
木聚糖酶诱导培养基:玉米芯粉30 g/L,Mandels 营养盐浓缩液200mL/L,Mandels 微量元素浓缩液1.0mL/L,葡萄糖3 g/L,蛋白胨1 g/L,1 mol/L 的柠檬酸缓冲液(pH4.5)50 mL/L,吐温80 1.5 mL/L。
非诱导培养基:Mandels 营养盐浓缩液200 mL/L,Mandels 微量元素浓缩液1.0 mL/L,葡萄糖3 g/L,蛋白胨1 g/L,1 mol/L 的柠檬酸缓冲液(pH4.5)50 mL/L,吐温80 1.5 mL/L。
1.1.2 诱导及非诱导培养
将纯化菌株在PDA 培养基中培养7 d 左右,然后用无菌水洗孢子,取3 mL 接种于含有30 mL 液体种子培养基的三角摇瓶中,于50 ℃,250 r/min 条件下震荡培养3 d~4 d 后,各取3 mL 液体种子分别接种到含有30 mL 木聚糖酶诱导培养基及非诱导培养基的三角摇瓶中,于50 ℃,250 r/min 条件下震荡培养4 d 后,分别取其发酵液于12 000 r/min 离心5 min,取上清液进行木聚糖酶酶活测定[7]。
1.2 木聚糖酶酶活测定
木聚糖酶酶活测定参照Bailey 等的方法[8]进行。木聚糖酶活力的测定方法是根据木聚糖酶可将木聚糖水解成木糖的原理。活力单位采用国际单位,定义为在水解反应中每分钟形成1 μmol 的还原糖量(以木糖计)所需要的酶量为一个活力单位(IU)。具体步骤如下:在25 mL 刻度反应管中加入1.8 mL 2%的木聚糖(使用0.05 mol/L,pH5.5 的柠檬酸钠缓冲液配制),50 ℃预热5 min,然后加入0.2 mL 适当稀释的发酵液上清,于复式恒温水浴(50 ℃)中振荡5 min;取出反应管,迅速加入3 mL DNS 试剂,沸水浴15 min;流水冷却后,在540 nm 下测定吸光值;根据木糖标准曲线计算出酶反应过程所释放的木糖量。空白对照组:在25mL 刻度反应管中加入1.8 mL 2 %的木聚糖,50 ℃预热5 min,加入3 mL DNS 试剂,加入0.2 mL 适当稀释的发酵液上清迅速沸水浴15 min,流水冷却后,在540 nm下调零。
1.3 非变性胶的配制及电泳
非变性胶5×Loading Buffer(不含SDS 及β—疏基乙醇)为250 mmol/LTris-HCl(pH 6.8)、0.5%(g/mL)溴酚兰和50%(体积比)甘油。非变性胶电泳缓冲液为不含SDS 的1×Tris-Glycine Buffer(0.025 mol/L Tris,0.25 mol/L Glycine)。
配12%的非变性胶(不加SDS,其它组份不变),在胶板上将最左侧的泳道标为1,与1 相邻的泳道标记为2,其余泳道不标记。[将诱导及非诱导的上清与非变性胶5×Loading Buffer 进行1 ∶4(体积比)的混合](不加热)后上样,第1 泳道加样孔上非诱导的上清,第2 及其余泳道均为诱导上清,进行非变性聚丙烯酰胺凝胶电泳,电泳过程在冰上进行,保持低温,以免蛋白变性。电泳结束后,将第1 和第2 泳道连在一起切下进行快速考染(用微波炉加热煮沸2 次~3 次后,染色10 min~20 min)和快速脱色(脱色10 min~20 min),剩余胶块用保鲜膜包好后置于4 ℃冰箱内保存。
快速脱色后,将其与原来未染色的胶块放在一起,拼成一块完整的胶。以第1 泳道为对照,在未染色的胶块中将第2 泳道和第1 泳道显著不同的条带对应的胶块切下,置于1.5 mL 的EP 管中并加入适量的柠檬酸钠缓冲液(pH5.5),用小研棒将胶块细细研磨。离心取上清,测木聚糖酶酶活。
1.4 SDS-PAGE
配制15%的变性胶,在胶板上取3 个相邻的泳道分别标记为1、2、3,第1 泳道为非诱导上清,第2 泳道为诱导上清,第3 泳道为切胶回收后有酶活的上清。上样后,进行SDS-PAGE,常规染色及脱色。
1.5 切胶
将200 μL 枪头在约1cm 处剪断,在剪断的枪头内吸少量超纯水(易于将切下的蛋白胶粒打出),将所需蛋白质点用已剪断的枪头切下,并放入装有100 μL超纯水的小PCR 管中。在温控板上25 ℃振荡并进行水洗、平衡、脱色、平衡。
1.6 质谱分析
参照Li 等[9]已报道的胶内酶切法进行预处理,利用质谱仪(Bruker Daltonios)对得到的肽段进行MALDI-TOF 质谱鉴定。得到蛋白样品的肽质量指纹图,通过本地化的MASCOT 软件(Version 2.2,Matrix Science)在数据库[NCBInr 20120922]中进行蛋白质检索。设定参数为:Max Missed Cleavages:1;Fixed Modifications;Carboxymethyl(C);Variable Modifications:Oxidation(M);Mass values:MH+、Monoisotopic;Peptide Mass Tolerance:±0.2Da。若鉴定结果得分大于83分(P<0.05),说明搜库结果可信。
1.7 同源片段的克隆
根据质谱分析的肽段序列设计简并引物PF:5'-TGGAAYCCNGGNYTNAAYGC -3';PR:5' -GCCCAN GCRTCRAARTGRCANCC-3',以嗜热踝节菌基因组DNA 为模板进行PCR 扩增。将目的片段切胶回收,连接pMD18-T 载体测序,得出中间序列。
1.8 TAIL-PCR 克隆全长基因
利用TAIL-PCR 方法[10]分别扩增TtXynA 基因的5'末端和3'末端,TAIL-PCR 扩增过程中用到的特异性引物(Specific primer)见表1,随机引物(Arbitrary degenerate primer,AD)参考刘自勇等的文献[11]。TAIL-PCR 的反应体系和反应参数设置参考Takara 公司的Genome Walking Kit 说明书,即3 条特异性引物分别与7 条随机引物进行三轮反应后,将第三轮的目的片段切胶回收,连接pMD-19-T 载体测序。根据获得的全长序列,设计引物TtxynF 及TtxynR(表1)扩增TtXynA 基因全长。
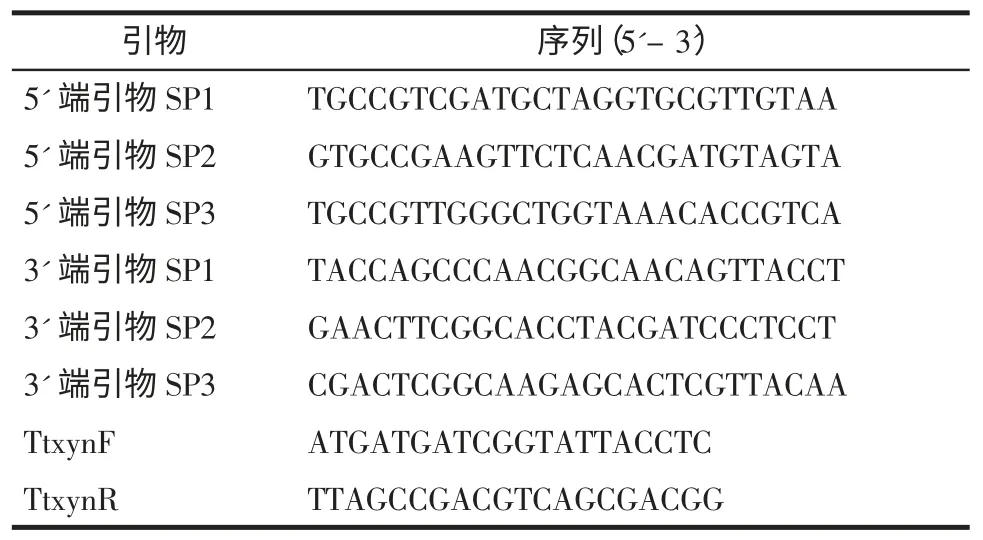
表1 Tail-PCR 特异性引物Table 1 The specific primers of Tail-PCR
1.9 TtXynA 同源蛋白的进化分析
根据Kimura 双参数模型用临近相邻法(Neighbor-Joining,NJ)构建TtXynA 及其同源蛋白的进化树[12]。
2 结果与分析
2.1 酶谱分析
用非变性胶对粗酶液进行第一次分离纯化,根据对非变性胶中酶谱的分析,可以进行切胶回收,测酶活,如果有酶活,再将有酶活的酶液进行第二次分离纯化即进行SDS-PAGE,再根据对变性胶中酶谱的分析,可以确定出目的蛋白条带。诱导及非诱导的酶谱见图1。
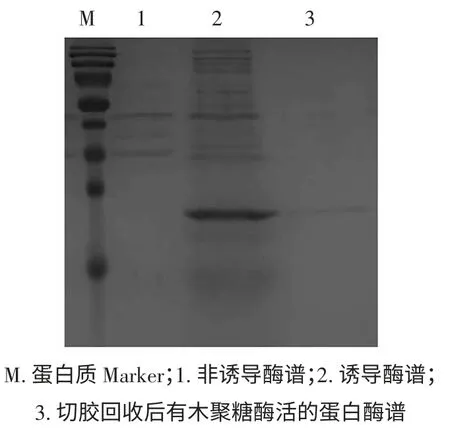
图1 嗜热踝节菌产木聚糖酶诱导及非诱导的酶谱Fig.1 The zymogram of Talaromyces thermophilus with induced and non-induced culture
2.2 质谱分析结果
MASCOT 软件在数据库[NCBInr 20120922]中进行蛋白质检索的结果表明,该蛋白与拟青霉属Paecilomyces sp.J18 的内切木聚糖酶(GeneBank 编号:ACS26244.1)高度同源,鉴定结果得分为188 分,表明搜库结果可信。另外,还与长枝木霉Thermomyces lanuginosus 的内切木聚糖酶(gi|335371365)具有一定同源性,鉴定结果得分为83 分。
2.3 基因全长的获得
根据质谱分析获得的肽段序列设计简并引物进行PCR 扩增,获得嗜热踝节菌木聚糖酶基因的中间序列,利用TAIL-PCR 技术扩增该基因的5'和3'端序列。经过各三轮TAIL-PCR 扩增,得到一个900 bp 左右的5'端片段和一个500 bp 左右的3'端片段。将两个片段进行测序,并与拟青霉木聚糖酶基因进行核苷酸序列比对,最后,将测序结果与已扩增的中间同源片段拼接,得出基因全长序列为788 bp,根据设计的上下游引物TtxynF、TtxynR,成功扩增出TtXynA 基因全长序列见图2,其DNA 序列已提交至NCBI,登录号为KC422245。该基因含有一个内含子,无CBM 结构域。对应的蛋白质属于糖苷水解酶第11 家族的成员。
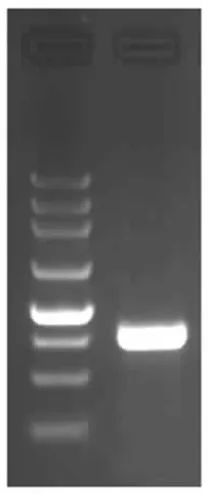
图2 TtXynA 基因全长Fig.2 Full-length of TtXynA
2.4 TtXynA 及其同源蛋白的进化分析
将嗜热踝节菌TtXynA 蛋白序列与GenBank 中数据进行比对,从中得到多种不同来源的木聚糖酶基因,与TtXynA 蛋白具有较高的序列同源性。其种类(登录号)分别为:Paecilomyces sp.J18(ACS26244)、Thermomyces lanuginosus(AEH57194)、Trichoderma reesei(AAB29346)、Aspergillus fumigates(ADM47839)、Humicola grisea var.thermoidea(AAG16891)、Myceliophthora thermophila ATCC 42464(XP_003664784)、Chaetomium thermophilum var.thermophilum DSM 1495(EGS20234)。利用CLUSTAL X 软件将这8 个蛋白序列匹配排列后,再利用MEGA 5.0 软件采用NJ 法构建系统发育树见图3,通过进化树分析,发现与嗜热踝节菌TtXynA 蛋白序列同源性较高的是拟青霉(Paecilomyces sp.J18)木聚糖酶,与来自疏棉状嗜热丝孢菌、里氏木霉、烟曲霉的木聚糖酶亲缘关系较近,与来自灰腐质霉高温变种、嗜热毁丝霉和嗜热毛壳霉变种的木聚糖酶关系相对较远。

图3 根据Kimura 双参数模型用NJ 法构建TtXynA 及其同源蛋白的进化树Fig.3 Phylogenetic trees based on homologous TtXynA sequences using NJ method by Kimura’s two-parameter model
3 讨论
我们通过前期实验分离鉴定了具有木聚糖酶活性的嗜热踝节菌WYN9,该菌属于蓝状菌属真菌,但该菌种基因组序列未知,基因库中相关序列极少。我们曾收集蓝状菌属及与其亲缘关系较近种属来源的11家族木聚糖酶序列信息,设计简并引物扩增对应木聚糖酶基因序列,但未获得任何有意义的基因片段。通过对嗜热踝节菌产木聚糖酶诱导与非诱导酶谱的分析,发现诱导后出现的条带清晰,对应蛋白大小与11 家族木聚糖酶大小吻合,约23 kDa 左右。结合质谱分析技术成功鉴定到一个糖苷第11 家族的内切木聚糖酶TtXynA,并通过TAIL-PCR 扩增获得TtXynA 基因全长序列。本研究的结果表明通过质谱-酶谱方法联合分析未知蛋白是一种快速高效的鉴定蛋白质的方法。
TtXynA 基因是从嗜热踝节菌中克隆到的第一个木聚糖酶基因,但对应蛋白序列与拟青霉木聚糖酶100%同源,与疏棉状嗜热丝孢菌Thermomyces lanuginosus 木聚糖酶(AEH57194.1)同源性为82%,以及结合TtXynA 同源基因的进化分析,结果表明在真菌中半纤维素降解酶超蛋白家族的成员广泛存在,并在降解过程中发挥重要作用。在蛋白酶的长期进化过程中,推测该蛋白因具有较强的木聚糖降解能力而在不同种属的菌株中被完整的保存下来。目前,在真菌中发现的11 家族木聚糖酶已有多种,主要分布在木霉[14]、曲霉属[15]、青霉属[16]、链格孢属[17]等丝状真菌中。然而,其中具备嗜热特性的木聚糖酶并不多,我们对嗜热踝节菌WYN9 胞外木聚糖酶的酶学性质进行初步研究的结果表明,其胞外粗酶液于60 ℃保存30 min 后,酶活可保持原始酶活的95%以上(未发表),因此,可初步判断TtXynA 具有耐热的特点。有热稳定特性的木聚糖酶具有更广泛的应用,在后续研究中,我们将对该基因进行异源表达、纯化,进一步确认该蛋白的酶学性质、催化活性及底物降解特异性等,并在相关的领域进行应用。
[1]Cooney D G,Emerson R.Thermophilic Fungi:An account of their biology,activities and classification[M].WHFreeman&Co,San Francisco,1964:27-42
[2]Mouchacca J.Thermophilic Fungi:Biodiversity and Taxonomic Status[J].Cryptogamie mycology,1997:18(1):19-69
[3]孙明忠,刘志强,丁兰,等.白眉蝮蛇蛇毒及蛇毒酶的激光解吸飞行时间质谱研究[J].高等学校化学学报,2000,21(4):538-540
[4]吕磊,刘志强,李丽,等.耐药相关果糖二磷酸醛缩酶C 的生物质谱分析与鉴定[J].化学学报,2006,64(16):1700-1704
[5]黄河清,陆永进,林庆梅,等.基质辅助激光解吸/电离质谱法研究海兔卵多肽内切酶组成、结构与功能[J].分析化学研究报告,2007,35(8):1105-1110
[6]Peterson R,Grinyer J,Joss J,et al.Fungal proteins with mannanase activity identified directly from a Congo Red stained zymogram by mass spectrometry[J].Journal of microbiological methods,2009,79(3):374-377
[7]麦国琴,许晓萍,余翠媚,等.产木聚糖酶和纤维素酶真菌的酶学性质分析[J].食品研究与开发,2011,32(9):179-182
[8]Bailey M J,Biely P,Poutanen K.Interlaboratory testing of methods for assay of xylanase activity[J].Journal of biotechnology,1992(23):257-270
[9]Li J K,Feng M,Zhang L,et al.Proteomics analysis of major royal jelly protein changes under different storage conditions[J].Journal of proteome research,2008,7(8):3339-3353
[10]Liu Y,Whittier R F.Thermal asymmetric interlaced PCR:automatable amplification and sequencing of insert end fragment from P1 and YAC clones for chromosome walking[J].Genomics,1995,25(3):674-681
[11]刘自勇,孙宪昀,曲音波.斜卧青霉114-2 cbh1 基因的TAIL-PCR克隆及与抗阻遏突变株JU-A10 的比较[J].微生物学报,2008,48(5):667-671
[12]李焰焰,聂传朋,曹家树.十字花科蔬菜BcMF13 同源基因的克隆及进化分析[J].应用与环境生物学报,2011,17(2):207-210
[13]Roy A,Kucukura A,Zhang Y.I-TASSER:a unified platform for automated protein structure and function prediction[J].Nature protocols,2010,5(4):725-738
[14]Li J,Wang J,Wang S,et al.Achieving efficient protein expression in Trichoderma reesei by using strong constitutive promoters[J].Microb Cell Fact,2012,11(6):84-93
[15]Zhang H,Wu M,Li J,et al.Cloning and expression of a novel xylanase gene(Auxyn11D)from Aspergillus usamii E001 in Pichia pastoris[J].Applied biochemistry and biotechnology,2012,167(8):2198-2211
[16]Wang J,Mai GQ,Liu G,et al.Molecular cloning and heterologous expression of an acid-stable endoxylanase gene from Penicillium oxalicum in Trichoderma reesei[J].J Microbiol Biotechnol,2013,23(2):251-259
[17]Liangwei Mao,Po Meng,Cheng Zhou,et al.Molecular cloning and heterologous expression of an acid stable xylanase gene from Alternaria sp.HB186[J].World J Microbiol Biotechnol,2012,28(3):777-784
