转基因大豆A5547-127品系成分LAMP快速检测方法的建立
2013-07-22蔡颖周广彪刘津高东微凌莉刘静宇易敏英吴少云李志勇
蔡颖,周广彪,刘津,高东微,凌莉,刘静宇,易敏英,吴少云,李志勇,*
(1.汕头出入境检验检疫局技术中心,广东汕头, 515031;2.广东检验检疫技术中心,广东广州 510623;3.华南理工大学生物科学与工程学院,广东广州 510641)
转基因大豆A5547-127 品系是美国拜尔公司研发的抗草胺磷除草剂的转基因大豆品种,1998 年已获美国官方批准使用,并相继在墨西哥、加拿大、日本、阿根廷、巴西等国家获准进行商业化种植或作为食品原料进口[1]。该品系在我国未批准许可进口及使用,为非法转基因大豆品系。
我国每年从国外进口大量的大豆,2011 年进口量达5 264 万t,约占全球大豆进口量的60%[2],其中绝大部分都是转基因大豆。另外,由于大豆制品在食品中广泛使用,进口食品中也可能含有转基因大豆成分。为了保护我国大豆种质资源安全,保护我国消费者的知情权,农业部和国家质检总局分别颁布了《农业转基因生物进口安全管理办法》[3]和《进出境转基因产品检验检疫管理办法》[4]等法律法规,要求实行转基因标识和进口审核制度。
《进出境转基因产品检验检疫管理办法》规定,为了防止含有非法转基因大豆成分的产品进入我国,必须对进口大豆和相关食品进行转基因检测,保证其实际转基因成份与批准文件相符。目前,国内对转基因大豆A5547-127 及其衍生品种的检测使用农业部1485 号公告-8-2010《转基因植物及其产品成分检测耐除草剂大豆A5547-127 及其衍生品种定性PCR 方法》[5],采用的是普通PCR 方法。普通PCR 方法检测操作繁琐,灵敏度比较低,容易造成交叉污染和结果出现假阳性、假阴性的比例偏高。如果参照欧盟的方法[6]采用荧光PCR 方法,由于成本昂贵、技术要求高,需要大型的仪器设备,并不适合于基层实验室的日常检测。
环介导等温扩增法[7](LAMP,Loop-mediated Isothermal Amplification)是Notomi T 等在PCR 基础上发明的一种新颖的恒温核酸扩增方法,由于不需要昂贵的大型仪器,不需要荧光标记,可快速、高效扩增目标片段,灵敏度高,操作简便快速、结果判读简便等优点,现在已广泛应用于多个领域的检测,如病毒、细菌、真菌和寄生虫等[8-12]。
本研究旨在建立转基因大豆A5547-127 品系成分的LAMP 快速检测方法,并对方法的特异性、灵敏度和稳定性进行测试。
1 材料与方法
1.1 材料与仪器
1.1.1 转基因标准品
转基因大豆标准品:A5547-127(100%)、DP356043(10%)、DP305423(10%)、GTS40-3-2(10%)、MON89788(100%);转基因玉米标准品:GA21(100%)、MON810(10 %)、MON89034(100 %)、98140(10 %)、MIR604(100%)、Bt-176(5%);转基因水稻标准品:KMD(100%)、Bt63(5%),分别购自于AOCS、IRMM 和ERM。
1.1.2 样品
包括非转基因大豆(5 份)、非目的转基因大豆制品(5 份)、其他转基因植物样品(5 份)、其他植物加工产品(5 份)均来自于进口商品。
1.1.3 模拟样品DNA
由于未获得含A5547-127 成分的大豆样品及豆制品,本试验使用由A5547-127 标准品提取的DNA与阴性大豆样品、豆制品提取的DNA 进行混配,制成3 类模拟样品DNA:第一类,将阳性标准品DNA 与一份阴性大豆DNA 按不同比例进行混合,制成人工混配的系列浓度模拟阳性样品;第二类,将阳性标准品DNA 与多份阴性大豆DNA 分别进行混合,制成阳性模拟大豆样品;第三类,将阳性标准品DNA 与多份阴性豆制品DNA 分别进行混合,制成含阳性模拟大豆制品。
1.1.4 试剂
CTAB、Tris、EDTA 等:北京鼎国生物技术有限公司;Ex Taq:宝生物工程(大连)有限公司;甜菜碱、Bst DNA聚合酶:Sigma 公司;SYBR GreenⅠ:厦门百维信生物科技公司。
1.1.5 仪器
LA-320C LAMP 检测实时浊度仪:日本荣研化学株式会社。
1.2 DNA 的提取
按国家标准GB/T 19495.7-2004《转基因产品检测抽样和制样方法》[13]制备样品,按GB/T 19495.3-2004《转基因产品检测核酸提取纯化方法》[14]提取样品DNA(采用CTAB 法)。
1.3 引物设计、合成和筛选优化
根据转基因大豆A5547-127 品系特异靶序列,采用LAMP 专用引物设计软件在线设计软件Primer Explorer Version 3 设计3 套LAMP 引物。使用含量为100%的A5547-127 标准品进行引物筛选比较试验,最终确定一套最佳特异性引物。
1.4 LAMP 方法的建立
初步确定25 μL 的LAMP 反应体系,其成分包括:1×ThermoPol 缓冲液、外引物F3 和B3 各0.2 μmol/L、内引物FIP 和BIP 各1.6 μmol/L、环状上游引物LB 0.8 μmol/L、1.4 mmol/L dNTPs、0.8 mol/L 甜菜碱、6 mmol/L硫酸镁、0.32 U/μL Bst DNA 聚合酶、DNA 模板200 ng。参照LAMP 浊度仪使用说明书,将混合物置于反应孔中,在反应管中加入1 滴石蜡油,管盖内壁加入1 μL 0.1%的SYBR GreenⅠ。然后将其置于65 ℃恒温反应90 min,最后80 ℃灭活5 min 结束反应。浊度仪实时观察反应管中是否发生扩增,如果发生反应,产生焦磷酸镁沉淀,浊度增加,浊度仪上会出现相应的峰段。反应结束后,将反应管盖内壁的SYBR GreenⅠ离心,观察反应管中液体颜色,进一步验证是否发生扩增反应,如发生扩增,溶液为绿色,否则保持SYBR GreenⅠ橙色不变。
1.5 LAMP 反应体系和反应条件的优化
使用筛选出的最佳特异性引物,选取Mg2+浓度、甜菜碱浓度、dNTPs 浓度和反应温度4 个变量参数,进行单因素变化实验,对LAMP 反应条件进行优化。
1)Mg2+浓度优化:设置4 个Mg2+浓度梯度依次为4、6、8、10 mmol/L;
2)甜菜碱浓度优化:设置4 个甜菜碱浓度梯度依次为0.6、0.8、1.0、1.2 mol/L;
3)dNTPs 浓度优化:设置4 个dNTPs 浓度梯度依次为1.2、1.4、1.6、1.8 mmol/L;
4)反应温度优化:设置4 个反应温度梯度依次为61、63、65、67 ℃。
根据实验结果选择最佳的反应体系和反应条件。
1.6 对所建立的LAMP 方法的评价
按照优化好的反应体系和条件进行标准品、样品、模拟样品等的LAMP 扩增反应,对所建立的LAMP方法进行灵敏度(检测低限)、特异性和稳定性评价,同时与欧盟官方方法实时荧光PCR 方法[6]的检测结果进行比较。
1.7 样品及模拟样品检测
利用建立的LAMP 方法对共计20 份阴性样品(见1.1.2)、5 份阳性模拟大豆样品和5 份阳性模拟大豆制品(见1.1.3)进行检测,同时与实时荧光PCR 方法的检测结果进行比对。
2 结果与分析
2.1 引物的筛选与优化
引物筛选比较试验显示:第1 套引物没有发生扩增反应;第2 套引物出现了假阳性,而且出峰时间50 min 左右,比较晚;第3 套引物发生了扩增反应,出峰时间为34 min 左右,峰高为0.15,出峰时间和峰高值都适中,而且峰也较光滑。综上所述,初步选定第3 套引物:
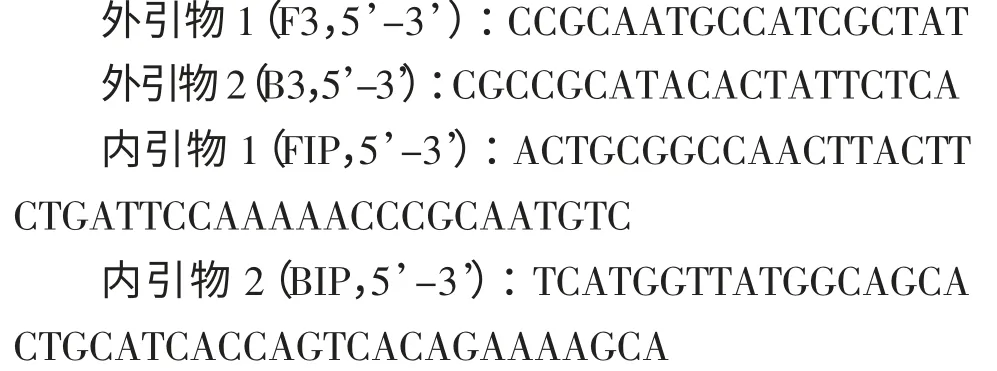
外引物扩增片段长度:208 bp
2.2 反应体系和反应条件的优化
选取Mg2+浓度、甜菜碱浓度、dNTPs 浓度和反应温度4 个变量参数,使用第三套引物进行单因素变化实验,采用浊度仪中该反应曲线的出峰时间和出峰高度作为评价的指标,选择最佳的反应参数。实验结果表明:在25 μL 反应体系中,当MgSO4浓度为6 mmol/L,甜菜碱浓度:0.8 mol/L,dNTPs 浓度:1.4 mmol/L 时,在63 ℃恒温反应90 min,然后在80 ℃灭活5 min 结束反应,转基因大豆A5547-127 品系的特异性扩增效果最好。
2.3 特异性试验
为验证LAMP 方法的特异性,使用优化后的LAMP 方法检测13 份不同品系的转基因大豆、玉米、水稻标准品(见1.1.1)。实验结果显示,仅转基因大豆A5547-127 品系有峰值出现,且SYBR Green I 显色为绿色,在其他转基因大豆品系中均未得到任何扩增产物。说明本研究建立的LAMP 方法对转基因大豆A5547-127 品系具有严格的特异性。
2.4 灵敏度实验
LAMP 显色法结果显示抗除草剂转基因大豆A5547-127 的10%模拟样品、1 %模拟样品、0.5 %模拟样品、0.1%模拟样品,空白样品(0%)的阴阳性结果均正确,准确率达到100%,与实时荧光PCR 方法的检测结果一致(图1、图2)。从LAMP 显色结果可看出转基因含量越高,颜色变化越明显(图3)。LAMP 实时20 份阴性样品、10 份阳性模拟样品的LAMP 反应结果全部正确,准确率达到100%,与荧光PCR 反应的检出结果一致(见表1),说明用LAMP 方法检测各类样品和制品的转基因大豆A5547-127 品系成分方法特异性良好。浊度法的检测结果图也显示转基因含量越高,开始出现大量扩增的时间越短。灵敏度实验表明,LAMP 显色法、实时浊度法的检测低限均至少可达0.1%。
图1 灵敏度实验的LAMP 实时浊度法检测结果Fig.1 Results of sensitivity test by LAMP real-time turbidity method

表1 特异性试验检测结果Table 1 Results of specificity test
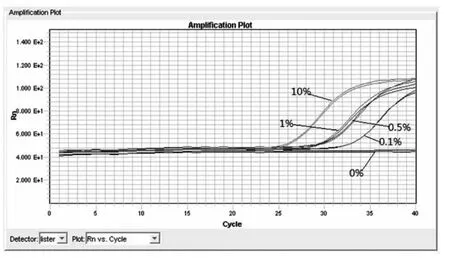
图2 灵敏度实验的实时荧光PCR 法检测结果Fig.2 Results of sensitivity test by real-time fluorescent PCR method

图3 灵敏度实验的LAMP 显色法检测结果Fig.3 Results of sensitivity test by LAMP coloration method
由左至右分别为转基因大豆A5547-127 品系10 %模拟样品、1%模拟样品、0.5%模拟样品、0.1%模拟样品和0%空白样品的荧光PCR 扩增曲线。
2.5 稳定性实验
为评估LAMP 方法的稳定性,用本研究建立的LAMP 显色法、LAMP 实时浊度法分别对4 个不同浓度(0%、1%、5%、10%)的模拟样品进行检测,每个模拟样品重复20 次,同时与实时荧光PCR 方法进行比对。结果显示,各种试验浓度的模拟样品的LAMP 显色法、LAMP 实时浊度法检测结果均合格,准确率达到100 %,和实时荧光PCR 方法的结果一致。说明用LAMP 方法检测转基因大豆A5547-127 品系成分稳定性良好。
2.6 样品及模拟样品检测
LAMP 显色法与LAMP 实时浊度法的结果显示,
3 结论
本文建立转基因大豆A5547-127 品系特异性的LAMP 快速检测方法,该方法适用于大豆及其制品中转基因大豆A5547-127 品系成分特异性检测,灵敏度达到0.1%,具有良好的稳定性和高度的特异性,用于实际阴性样品和阳性模拟样品检测时与实时荧光PCR 方法相比检测结果一致,假阴性率和假阳性率均为0%。
LAMP 实时浊度法采用浊度仪判读结果,解决了传统LAMP 法无法实时监控实验反应的问题,还可根据出峰时间,峰值高低以及峰型的光滑程度对反应体系和反应条件进行优化,极大缩短了优化反应参数的过程。而LAMP 显色法不需要另外购置设备,仅凭肉眼根据颜色便可准确判断结果,大大降低了实验成本,而且对实验人员的技术要求不高,满足了基层实验室的检测业务需求要求,是适合大宗粮谷现场检验或基层实验室推广使用的一种快速检测方法。
[1]Center for Environmental Risk Assessment.GM Crop Database,[DB/OL].http://cera-gmc.org/index.php?action=gm_crop_database&mode=Submit&evidcode=A5547-127,2012-01-31
[2]中美签署进口大单国产大豆淡定应对[EB/OL].http://finance.aweb.com.cn/20120227/483618732.shtml,2012-01-31
[3]中华人民共和国农业部令第9 号《农业转基因生物进口安全管理办法》[DB/OL].http://www.gov.cn/gongbao/content/2002/content_61848.htm,2012-01-31
[4]中华人民共和国国家质量监督检验检疫总局令第62 号《进出境转基因产品检验检疫管理办法》[DB/OL].http://www.gov.cn/gongbao/content/2005/content_63203.htm,2012-01-31
[5]农业部科技发展中心.农业部1485 号公告-8-2010 转基因植物及其产品成分检测耐除草剂大豆A5547-127 及其衍生品种定性PCR 方法[S/OL].http://down.foodmate.net/d/search.php?keyword=%C5%A9%D2%B5%B2%BF1485%BA %C5 %B9 %AB%B8%E6-8-2010&mod=do&n=1,2012-01-31
[6]Joint Research Centre,Institute for Health and Consumer Protection,Biotechnology&GMOs Unit.Event-specific Method for the Quantification of Soybean Event A5547-127 Using Real-time PCR:CRLVL01/08VP corrected version 1[DB/OL].http://www.gmcrop.cn/uploads/upload_files/month_1011/1109120832.pdf,2012-01-31
[7]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic acids research,2000,28(12):63-68
[8]Yamazaki W,Taguchi M,IshibashiM,et al.Development of a loopmediated isothermal amplification assay for sensitive and rapid detection of Campylobacter fetus[J].Veterinary microbiology,2009,13:393-396
[9]Hara-Kudo Y,Konishi N,Ohtsuka K,et al.Detection of verotoxigenic Escherichia coli O157 and O26 in food by plating methods and LAMP method:A collaborative study[J].International journal of food microbiology,2008,122:156-161
[10]Yoneyama T,Kiyohara T,Shimasaki N,et al.Rapid and real-time detection of hepatitis A virus by reverse transcription loop-mediated isothermal amplification assay[J].Journal of virological methods,2007,145:162-168
[11]Fukuda S,Takao S,Kuwayama M,et al.Rapid detection of norovirus from fecal specimens by real-time reverse transcription-loop-mediated isothermal amplification assay[J].Journal of clinical microbiology,2006,44:1376-1381
[12]Iwamoto T,Sonobe T,Hayashi K.Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex,M.avium,and M.intracellulare in sputum samples[J].Journal of clinical microbiology,2006,41:2616-2622
[13]中华人民共和国辽宁出入境检验检疫局.GB/T 19495.7-2004转基因产品检测抽样和制样方法[S].北京:中国标准出版社,2007:6-7
[14]中华人民共和国山东出入境检验检疫局.GB/T 19495.3-2004转基因产品检测核酸提取纯化方法[S].北京:中国标准出版社,2007:14
