TLR4/MyD88 在实验性自身免疫性肝炎小鼠中的表达和意义
2013-07-19范翔雪张元亚焦云桃黄加权严伟明
艾 国,肖 芳,范翔雪,张元亚,焦云桃,黄加权,严伟明,宁 琴
华中科技大学同济医学院附属同济医院感染科,湖北 武汉 430030
Toll 样受体(Toll-like receptors,TLRs)被内、外源性配体不恰当的激活,分子模拟和抗原提呈细胞活化导致的自身抗原提呈的增强以及TLR 介导的调节性T细胞(Tregs)数量及功能的缺失会导致自身免疫现象。作为脂多糖(LPS)作用的优先受体,TLR4 参与LPS介导的细胞激活及损伤。TLR4及其信号转导在HBV感染、酒精性肝炎、原发性胆汁性肝硬化、肝脏纤维形成、肝脏缺血再灌注等肝脏的各种损伤中发挥不同的重要作用。然而其在自身免疫性肝炎中的表达和作用目前鲜有报道,本实验拟通过对实验性自身免疫性肝炎(EAH)小鼠模型的研究,探讨TLR4 在自身免疫性肝炎中的表达和作用机制。
1 材料与方法
1.1 材料 SPF级C57BL/6 小鼠32只,雌性,4周龄,体质量18~20 g,购自中国科学院上海实验动物中心,饲养于华中科技大学同济医学院附属同济医院感染免疫室动物房IVC(智能型独立送回风净化笼具),常规供给清洁饲料及饮水。
1.2 试剂 兔抗TLR4 多克隆抗体及无关抗体兔IgG(购于武汉博士德生物有限公司)、免疫组化SP 兔二步法试剂盒及DAB 试剂盒(北京中杉生物技术有限公司);TRIzol 试剂(美国Invitrogen 公司);逆转录试剂盒、TaqDNA 聚合酶、SYBR GreenⅠ荧光染料(日本东洋纺Toyobo 公司);PCR 扩增引物(北京擎科新业生物技术有限公司);弗氏完全佐剂(美国Sigma 公司)。
1.3 EAH 模型的建立及分组 将4只4周龄雌性C57BL/6 小鼠的肝脏用冷磷酸盐缓冲液(PBS)行门静脉灌注;取出肝脏置于冰上剪碎,匀浆后以150×g 离心10 min 以去除细胞核部分,使肝细胞内蛋白质充分释出;以100 000×g的速度超速离心1 h,该上清液即含肝抗原(S-100 抗原);采用90 cm 琼脂糖凝胶Sepharose CL-6B 柱(Pharmacia 公司)分离S-100,收集10 mg/L的第1 峰(S-100/1)作为刺激T 细胞的抗原即LSP(liver-specific lipoprotein)。将小鼠按照数字分组方法随机分为2组,每组各12只;正常组不给予任何处理,模型组第1 天和第7 天以新鲜制备的0.5~2 g/L的LSP 0.5 ml 与等体积的弗氏完全佐剂(CFA)充分乳化后予以小鼠腹腔注射。两组小鼠于第28 天各处死6只:乙醚麻醉后摘取眼球采集外周血,离心后收集血清送本院检验科检测生化指标,并于采血后脱颈处死小鼠,取出肝脾组织,部分以4%多聚甲醛固定、石蜡包埋、切片,部分用液氮冻存备用。
1.4 肝组织病理学观察 肝脏用4%多聚甲醛固定并石蜡包埋、切片,然后行HE 染色,显微镜下观察肝组织病理变化。
1.5 血清中自身抗体免疫荧光检查 取新鲜正常大鼠的胃平滑肌进行冰冻切片,分别滴加对照组和模型组的血清(均按1∶5 稀释),37℃湿盒孵育60 min;PBS清洗;滴加FITC 羊抗小鼠IgG(1∶50),37℃湿盒孵育30 min;PBS 清洗;防荧光淬灭剂封片;荧光显微镜下观察,拍照。荧光显微镜下可见到较为明显的线性荧光,证明血清中存在抗平滑肌抗体即呈阳性。
1.6 Masson 胶原纤维染色 石蜡切片常规脱蜡至水,苏木素染液5~10 min,流水稍洗,1%盐酸分化。流水冲洗数分钟。Masson 复合染色液5~10 min,蒸馏水稍冲洗。1%磷钨酸液处理约5 min,直接用苯胺蓝液复染5 min,然后1%冰醋酸水处理1 min。无水乙醇脱水,二甲苯透明,中性树胶封固。结果判定:胶原纤维呈灰蓝色(用苯胺蓝液复染),胞质、肌纤维和红细胞呈红色,胞核呈蓝色。
1.7 Realtime-PCR 检测肝脾组织TLR4 mRNA和MyD88 mRNA的表达 将100 mg 肝组织或脾脏组织加入1 ml TRIzol 置匀浆器中,氯仿-异丙醇法提取总RNA。经紫外分光光度计定量后,取1μg RNA,20μl逆转录体系合成cDNA,然后用SYBR GreenⅠ荧光染料技术行实时定量PCR 反应:即在20μl PCR 反应体系进行PCR 扩增。引物设计:①内参GADPH:5'-CAGTGCCAGCCTCTGCTCAT-3' (上 游),5'-ATACTCAGCACCAGCACAT-3' (下游);②TLR4:5'-GCAAAG TCCCTGATGACATTCC-3' (上 游),5'-AAGCCATGCCATGCCTTGTC-3' (下游);③MyD88:5'-GCATGGTGGTGGTTGTTTCTG-3' (上 游),5'-GAATCAGTCGCTTCTGTTGG-3' (下游)。PCR 反应条件:95℃预变性1 min,95℃变性15 s,60℃退火15 s,72℃延伸45 s,主循环40个,72℃终延伸10 min。实时荧光定量PCR结果分析采用2-△△CT法,通过Ct 值计算获得最终结果。
1.8 肝组织TLR4 免疫组化检测 肝组织石蜡切片经二甲苯脱蜡及梯度酒精脱水后,每张玻片加1 滴过氧化酶阻断液室温孵育10 min,PBS 冲洗3次,每次5 min。用枸橼酸盐缓冲液微波修复(高火5 min,然后低火15 min),自然冷却,加1 滴非免疫性动物血清,室温孵育15 min,倾去不洗,加50 ul 一抗(兔抗TLR4 多克隆抗体,稀释比例为1:100),4℃孵育过夜,PBS 冲洗,加1 滴羊抗兔二抗溶液,室温孵育30 min,PBS 冲洗3次,滴加新鲜配制的DAB 溶液约10 s染色,PBS 冲洗10 min,苏木素复染约8 s,注意显微镜下观察控制染色时间。梯度酒精脱水后中性树胶封片。细胞胞质、胞核或胞膜呈棕黄色且背景清晰者为阳性。
1.9 统计学处理 采用SPSS 15.0 进行统计学分析,GraphPad prism 5.0 作统计绘图,实验数据用表示,两组计量资料数比较用两独立样本非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1 EAH 小鼠肝脏病理学改变及Masson 胶原染色模型组小鼠在汇管区和小叶中央观察到不同程度的炎症反应。淋巴细胞弥漫性分布于中央静脉周围的肝血窦内,部分肝细胞出现气球样变和嗜酸性坏死,部分肝小叶正常结构被破坏,呈点灶状坏死(见图1)。正常组Masson 染色只在血管壁弹力纤维显色,胞质、肌纤维和红细胞呈红色,而模型组除此之外,在淋巴细胞浸润的地方及窦周间隙也有胶原纤维沉积呈现灰蓝色,说明肝脏有肝纤维化的表现(见图2)。将血清滴加在大鼠胃肠平滑肌冰冻切片上行血清中自身抗体免疫荧光检查,于荧光显微镜下可见到较为明显的线性荧光,证明血清中存在抗平滑肌抗体呈阳性(见图3)。
2.2 EAH 小鼠肝、脾组织TLR4的mRNA 水平表达Realtime-PCR 检测肝脏及脾脏组织内TLR4 mRNA的表达水平,模型组小鼠肝组织内TLR4 mRNA 表达水平较正常组明显升高,差异具有统计学意义(P=0.0357);而脾脏TLR4 mRNA 表达水平较正常组降低,但差异无统计学意义(P=0.1429,见图4)。

图1 小鼠肝脏HE 染色(200×);图2 小鼠肝脏Masson 胶原染色(200×);图3 小鼠的血清中抗平滑肌抗体的表达(免疫荧光400×) A:正常组;B:模型组Fig 1 Liver HE staining of C57BL/6(200×);Fig 2 Liver Masson staining of C57BL/6(200×);Fig 3 Expression of serum anti-smooth muscle antibody of C57BL/6(Immuno fluorescence 400×) A:normal group;B:EAH group
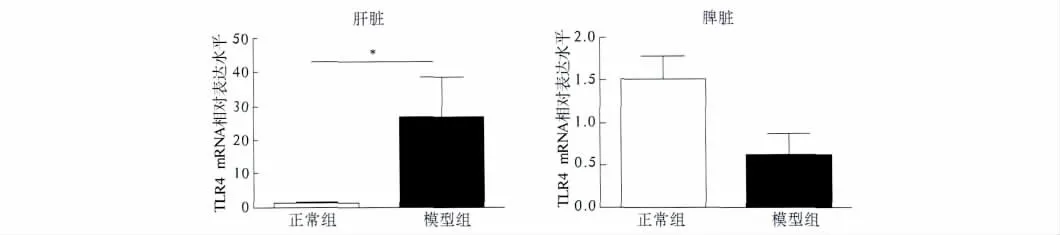
图4 TLR4 mRNA 在EAH 肝脾中的表达(两组比较,* P<0.05)Fig 4 Expression of TLR4 mRNA in liver and spleen of C57BL/6
2.3 EAH 小鼠肝、脾组织MyD88的mRNA 水平表达 Realtime-PCR 检测肝脏及脾脏组织内MyD88 mRNA的表达水平,模型组小鼠肝组织内MyD88 mRNA表达水平较正常组明显增高(P=0.0384),而脾脏MyD88 mRNA 表达水平较正常对照组略低,差异无统计学意义(P=1.0,见图5)。

图5 MyD88 mRNA 在EAH 肝脾中的表达(两组比较,* P<0.05)Fig 5 Expression of MyD88 mRNA in liver and spleen of C57BL/6
2.4 TLR4 蛋白在EAH 小鼠模型肝脏组织中的表达免疫组化检测TLR4的表达,阳性结果为细胞浆/细胞膜着棕黄色,胞核呈淡蓝色。高倍镜下观察正常组小鼠肝组织中未见明显TLR4 表达,而模型组小鼠肝组织可见到中央静脉周围,肝细胞坏死区和淋巴细胞浸润区域有阳性细胞染色(见图6)。
3 讨论
TLR 是近年发现的一类主要表达于天然免疫细胞表面的模式识别受体,能选择性识别大量的病原相关分子模式,快速启动天然免疫应答;TLR对获得性免疫的调节主要是通过诱导抗原提呈细胞(antigen presenting cell,APC)的成熟,上调共刺激分子的表达并促进其分泌细胞因子实现的。此外,TLR 也可以直接调节T 细胞应答[1]。近来研究发现,TLR 表达于各种肝脏细胞中,可以调节肝脏细胞的天然免疫反应,参与肝脏病理生理过程[2]。TLR 能够识别损伤与感染信号,是连接组织损伤、感染和炎症的桥梁[3],但过度的TLR 信号也与自身免疫疾病的发生有关[4]。自身免疫性肝炎是自身免疫系统攻击肝脏引起的慢性炎症和肝细胞坏死,其病理发病机制目前尚未完全阐明,在PBC中已有相关研究证明TLR4 在患者进展期门静脉周围肝细胞及小叶间肝细胞上表达,参与了其炎症过程[5],推测在自身免疫性肝炎中TLR4及其信号转导可能亦涉及。
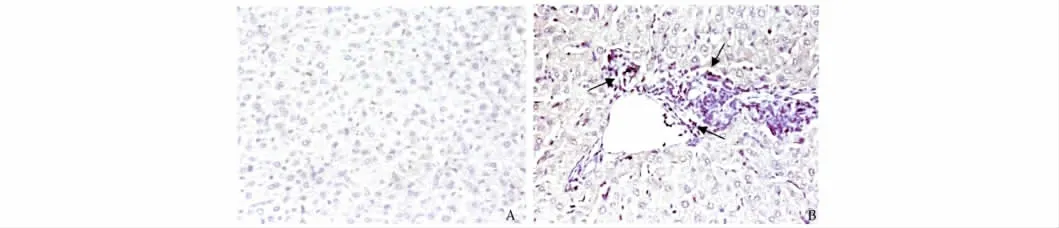
图6 免疫组化染色检测TLR4 蛋白在肝脏组织中的表达(400×) A:正常组;B:模型组Fig 6 Expression of TLR4 protein in liver of C57BL/6 by immunohistochemistry (400×) A:normal group;B:EAH group
TLR4 是TLRs 家族中最早发现的成员,其主要作用是识别G-细菌细胞壁脂多糖(lipopolysaccharide,LPS),启动机体的固有免疫系统。活化TLR4可以启动不同的信号通路,诱导产生一系列的炎症介质包括细胞因子、趋化因子等从而产生强有力的炎症反应。TLR4 信号通路包括MyD88 依赖性和MyD88 非依赖性两个途径。MyD88 依赖性途径主要通过TIK (Toll/IL-1 receptor)向胞内传递信号,激活c-Jun 氨基端蛋白激酶(INK)和核因子-KB(NF-κB)等转录因子,引起多种炎性细胞因子和化学因子的释放,如白介素-1(IL-1)、白介素-6(IL-6)、白介素-8(IL-8)、白介素-10(IL-10)和肿瘤坏死因子-a(tumour necrosis factor-alpha,TNF-a)[6]。
目前已获国内外广泛认可及使用的自身免疫性肝炎动物模型为采用易感动物C57BL/6 小鼠,以同种系肝抗原与完全弗氏佐剂充分乳化后经腹腔注射诱导出EAH。该模型肝脏组织学病理改变与人自身免疫性肝炎的组织学特征相似,都有大量炎症细胞特别是淋巴细胞的浸润,伴有不同程度肝细胞坏死和血清转氨酶升高,并且可通过免疫荧光检测出自身抗体。
本研究成功建立EAH 小鼠模型,肝组织病理学显示肝脏汇管区和小叶中央观察到不同程度的炎症反应,免疫荧光检查证明血清中存在抗平滑肌抗体阳性。进一步发现肝脏中的TLR4 mRNA及MyD88 mRNA 表达水平均较正常组明显增加,脾脏无统计学意义改变,表明肝脏中TLR4/MyD88 信号转导途径在自身免疫性肝炎的发生发展中发挥了重要作用。
自身免疫性肝炎由于慢性肝损伤往往伴有不同程度的肝纤维化。Masson 胶原染色可以观察到自身免疫性肝炎小鼠肝脏淋巴细胞浸润的地方及窦周间隙有胶原纤维沉积呈现灰蓝色,有肝纤维化形成。研究表明,LPS/TLR4 途径在肝纤维化形成中具有重要作用,尽管在肝脏中枯否细胞表达高水平的TLR4 且被认为是LPS的主要靶点,但表达于肝星状细胞上的TLR4 则主要促进肝纤维化[7]。因此,肝脏中的TLR4 表达水平增高可能促进肝纤维化,从而参与了自身免疫性肝炎的疾病进程。
TLR4 信号转导通路是目前发现的重要的炎性通路之一,与许多疾病的发生及发展过程相关,TLR4/MyD88 途径在自身免疫性疾病中的作用研究仍在进行中,临床上针对各种阻断或抑制TLR4 信号通路上各个节点药物的研制也是目前医学领域研究的热点,对TLR和MyD88 以及IL-1R 家族的信号转导深入探索有助于理解天然免疫、适应性免疫与自身免疫之间的关系,阐明这些机制将有助于在细胞生物化学水平上更进一步了解自身免疫性疾病的发病机制,为自身免疫性肝炎等器官特异性自身免疫疾病的基础和临床研究提供重要依据。
[1]Takeda K,Kaisho T,Akira S.Toll-1ike receptors[J].Annu Rev Imnununol,2003,21(1):335-376.
[2]Seki E,Brenner DA.Toll-like receptors and adaptor molecules in liver disease:update[J].Hepatology,2008,48(1):322-335.
[3]Piccinini AM,Midwood KS.DAMPening inflammation by modulating TLR signalling[J].Mediators Inflamm,2010,pii:672395.
[4]Iwasaki A,Medzhitov R.Toll-like receptor control of the adaptive immune responses[J].Nat Immunol,2004,5(10):987-995.
[5]Wang AP,Migiita K,Ito M,et al.Hepatic expression of toll-like receptor 4 in primary biliary cirrhosis [J].J Autoimmun,2005,25(1):85-91.
[6]Lu YC,Yeh WC,Ohashi PS.LPS/TLR4 signal transduction pathway[J].Cytokine,2008,42(2):145-151.
[7]Seki E,De Minicis S,Osterreicher CH,et al.TLR4 enhances TGFbeta signaling and hepatic fibrosis[J].Nat Med,2007,13(11):1324-1332.
