免疫- PCR检测技术及其应用
2013-07-17刘京,许杨,王丹,邹龙
刘 京,许 杨,王 丹,邹 龙
(南昌大学食品科学与技术国家重点实验室,中德联合研究院,江西南昌 330047)
随着科学技术水平的发展,人类对分析精度的要求也日益增高,痕量检测已成为生命科学和环境分析的热点问题。1991年Sano[1]等首次将PCR技术引入免疫反应,把抗原抗体反应的强特异性与PCR技术的高敏感性、强扩增能力结合在一起,开发了免疫-PCR技术(immuno polymerase chain reaction,IPCR)。免疫-PCR凭借PCR的庞大的扩增能力和特异性,比现有的多种形式的免疫检测方法都灵敏,能够将检测的灵敏度提高几个数量级,理论上可以检测到一个抗原分子。免疫-PCR尽管具有非常高的灵敏度,但其要求掌握ELISA和PCR技术且试剂的稀缺,很长一段时间对它的研究都受到限制,应用也处于探索阶段。近年来,新型连接分子的出现,即用型试剂的使用及与其它技术(如纳米技术)的结合使得免疫PCR成为诊断检测的选择之一。目前,已应用于临床医学、环境监测、食品安全等各个领域。
1 IPCR的原理及类型
1.1 IPCR的原理
IPCR的基本原理与 ELISA(enzyme-linked immuno sorbent assay,酶联免疫吸附实验)基本相似,不同的是将一段可扩增的DNA分子代替ELISA中的酶促反应信号[2]。具体步骤如下[3-4]:选择具有分别针对标记物和抗体的双特异性连接分子M;选择能够与抗原-抗体复合物特异性连接的标记物,通常是典型的DNA、RNA、DNA-RNA复合物以及它们的衍生物、片段或类似物,这类标记物可进行PCR扩增;PCR的扩增产物通过现有的方法检测,如通过琼脂糖凝胶电泳、荧光定量PCR来进行分析等,原理图如图1所示。

图1 免疫-PCR的原理[3]Fig.1 The principle of immuno polymerase chain reaction[3]
1.1.1 标记物分子与抗体的连接 免疫-PCR需要适当的方法将标记分子与抗体连接起来。目前,常见的方法有以下两类:a.使用连接蛋白(传统方法),常用的为链亲和素-生物素系统及亲和素-生物素系统。生物素能与IgG的Fc端连接,同时也能标记双链DNA,因此以链亲和素(或亲和素)为桥梁,可以将抗体与 DNA连接。该法需要多个步骤,较为费时[5-6]。b.使 用 化 学 试 剂,常 用 的 有 SMCC(succinimidyl-4-(N-maleimidomethyl)cyclohexane-1-carboxylate,4-(N-马来酰亚胺甲基)环已烷-1-羧酸琥珀酰亚胺酯)和sulfo-SMCC。该方法步骤简单,反应时间短,减少了发生在孵育阶段的不完全结合或非特异结合,灵敏性超过了传统方法[7-9]。
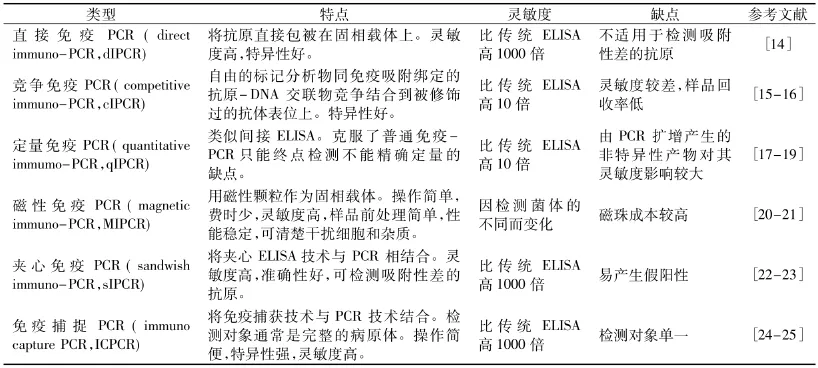
表1 不同类型的IPCRTable1 The different types of IPCR
1.1.2 标记物的选择 理论上,任何DNA、RNA或DNA-RNA复合物都可以作为免疫-PCR系统的标记物,但标记物需有较高的纯度及较好的扩增效果,与PCR系统存在的其他DNA分子不具同源性,以避免DNA污染造成的非特异性扩增。最早Sano等使用的是pUC19质粒,而后又出现了pUC18、舌兰病毒、pGL2 等。2006 年,Guo[10]等提出了噬菌体为标记物的新型IPCR技术,展示在噬菌体表面的单链抗体可替代传统IPCR中的单克隆抗体,噬菌体的DNA可作为IPCR中的标记物,该设计克服了单链抗体低检测灵敏度的缺陷,操作简单,耗费低,灵敏度高。
1.1.3 检测方法
1.1.3.1 电泳法 常用琼脂糖凝胶电泳,取PCR产物进行溴化乙淀染色,在琼脂糖凝胶上电泳,凝胶成像系统反转成像。宋云扬[11]等用夹心免疫-PCR检测金葡菌肠毒素B时,采用琼脂糖凝胶电泳分析,其方法是将PCR产物用溴化乙淀染色,在1%琼脂糖凝胶上电泳,而后通过凝胶成像系统成像,检测灵敏度达0.1ng/L,而普通ELISA检测灵敏度为1μg/mL。该法操作简单,耗费低,但灵敏度较其它检测方法差。
1.1.3.2 荧光定量PCR 荧光定量PCR是美国Applied Biosystems公司于1996年推出的定量实验技术,它通过荧光染料或荧光标记的特异性的探针标记跟踪PCR产物,实时在线监控反应过程,结合相应的软件分析产物,计算待测样品模板的初始浓度。Ye[12]等在用免疫-PCR检测萘时,采用了荧光定量PCR检测系统,其方法是在产物扩增时加入荧光标记的探针,使用荧光定量PCR仪实时监控,结合相应软件分析扩增产物,最低检测限达1fg/mL。该法操作简单,灵敏度高,准确性好,但需特殊设备,价格昂贵。
1.1.3.3 PCR-ELISA 即用ELISA来检测PCR产物。在PCR扩增后,借助ELISA反应原理,使用酶标抗体,在微孔板上进行固相杂交来实现定量。Niemeyer[13]等用免疫-PCR检测乙肝病毒表面抗原,其PCR产物分别通过琼脂糖凝胶电泳、直接荧光染料染色以及ELISA分析。对于ELISA,作者采用了两种显色底物作为对比,其方法是将系列稀释的兔IgG包被在微孔板上,生物素化的鼠单抗、链亲和素以及生物素化的DNA按顺序加样、孵育、洗涤,而后进行PCR扩增,扩增时加入地高辛标记的dNTP,最终检测用碱性磷酸酶标记的抗地高辛抗体,采用的底物分别为 pNPP(para-nitro-phenylphosphate,亚硝基磷酸单苯酯)或荧光素Attophos。结果表明琼脂糖凝胶电泳、直接荧光染料染色的灵敏度分别为2×10-1和6.8×10-3ng/mL,用 pNPP 和 Attophos 作 底 物 的ELISA 灵敏度分别为 1.1 ×10-3和 3.2 ×10-5ng/mL。该法灵敏度高,特异性好,但操作繁琐,易引起假阳性。
1.2 IPCR的类型
目前IPCR已发展了许多不同类型,其介绍见表1。
除上表介绍的几种IPCR技术外,Joo[26]等建立了一种新颖的免疫-PCR技术来检测小分子,学术上称作实时PCR分析噬菌体-抗原抗体复合物(phage anti- immunocomplex assay real- time PCR,PHAIAPCR),即先将一段短的肽环展示到噬菌体表面,然后该多肽特异性绑定到抗原抗体复合物上,这样就可以进行非竞争检测小分子,用噬菌体编码的这段肽可以被PCR扩增,这种方法消除了半抗原与DNA的交联作用,提高了检测灵敏度。Jonas[27]等建立了用纳米粒放大的免疫-PCR检测呼吸多核病毒,在PCR扩增标记物之前,进行50倍的纳米价的放大步骤,结果表明这种方法比传统的ELISA灵敏度高出了4000倍。张伟华[28]等初步建立了一种全新的核酸信标配基介导的新型免疫-PCR检测方法,采用了SELEX(Systematic evolution of ligand by exponential enrichment,指数富集的配体系统进化)技术从随机寡核苷酸文库中筛选抗体的Fc片段特异寡核苷酸配基,设计并合成了信标配基,通过不对称PCR法制备了IgG Fc片段的核酸信标分子,并用32P标记,制备了IgG Fc特异性寡核苷酸信标配基-抗体复合检测分子,结果表面该复合检测分子有效完成了信号传递和实时定量PCR信号放大过程,可有效提高现有IgG类抗体免疫检测的灵敏度和特异性。此外还有T7 RNA聚合酶扩增的免疫-PCR技术,滚环DNA扩增的免疫-PCR技术等。
2 IPCR的应用领域
IPCR因其高灵敏性,已被广泛应用于临床医学、动物疾病诊断、农业、环境科学、食品安全等各个领域。
2.1 临床医学
免疫PCR的高敏感性使低于常规检测方法极限的痕量抗原的检测成为可能。目前,主要用于检测病毒抗原(如人类免疫缺陷病毒、禽流感病毒、志贺病毒等)、各种细胞因子(如白细胞介素、肿瘤坏死因子等)、癌症(如胃癌、鼻咽癌等)、神经毒素等等。Zhang[29]等用免疫-PCR检测中国高危人群血清中与胃癌相关的MG7-Ag物质,从而诊断胃癌,该方法检测胃癌的灵敏度为77.5%,特异性为95.62%,准确度为73.12%。蒲荣[30]等建立了诊断早期梅毒的免疫-PCR方法,并将其与 ELISA、TPPA(treponema pallidum particle assay,梅毒螺旋体被动明胶颗粒凝集实验)、TURST(syphilis toluidine red untreated serum test,梅毒甲苯胺红不加热血清实验)进行比较,对其灵敏度、特异性、重复性进行评价,结果表明免疫-PCR检测梅毒螺旋体敏感性高(比ELISA敏感性强 103倍,比 TPPA、TURST强105倍),特异性强(免疫-PCR、ELISA、TPPA、TURST的特异性分别为100%、98%、100%、95%),重复性好,可作为诊断早期梅毒的方法。Malou[31]等首次采用免疫-PCR检测鼠疫杆菌抗原,它能够检测的蛋白浓度比普通ELISA低70倍,在检测的34例牙髓中,免疫PCR检测出14例,PCR法检测出10例,ELISA法仅检测出3例。Hashimoto[32]等采用免疫-PCR定量大脑内引发老年痴呆症的淀粉质的β肽,结果表明免疫-PCR可检测低至2×10-8mol/μL的淀粉质β肽。
2.2 动物疾病诊断
随着养殖业的不断发展,动物疾病的发生与流行形势日趋严峻,因此实现对动物疾病的快速灵敏地诊断有着重要的意义。Ozaki[33]等用免疫-PCR方法诊断马的流行性感冒抗原,结果表明免疫-PCR检测的灵敏度比 RT-PCR高10倍。Ding[34]等用金标纳米粒改良的免疫-PCR技术检测口蹄疫疾病病毒,目标病毒颗粒被多克隆抗体包被的ELISA微板捕捉,然后加入金标纳米颗粒修饰的寡核苷酸及口蹄疫病毒的特异性单克隆抗体,形成一个夹心免疫复合物,经过PCR扩增后,信号DNA被释放并用实时PCR识别,结果表明传统 ELISA的检测限为100ng/mL,而该方法的检测限低至10-5ng/mL。
2.3 农业方面
人们对植物病变及各种杀虫剂的危害已越发关注,提高对此类物质的检测灵敏度十分必要。Rajesh[18]等用免疫-PCR检测转基因玉米中的植物源杀虫剂蛋白,检测限达 1ng/mL。Silva[35]等用免疫-PCR的方法检测苏云金杆菌杀虫剂Cry1Ac的毒性,该实验采用聚氯乙烯微滴定板及链霉素包被颗粒为载体,在其表面进行抗原抗体反应,结果表明该方法对毒素的最低检测限为21.6ng/μL。
2.4 环境科学
环境问题已成为一个国际化关注的问题,各种污染已给人类造成了很大的困扰,生活环境的污染对人类的健康极其不利,急需建立快速灵敏的方法来监控环境中的有害物质。He[36]等用夹心实时定量免疫-PCR的方法检测环境中的志贺毒素2及其变种,结果表明该方法在磷酸缓冲液环境下的检测限为0.1pg/mL,其定量范围为10~100000pg/mL,在相同环境下,其灵敏度是传统 ELISA的10000倍。Chen[37]等用实时免疫-PCR检测土壤样品中的多氯联苯类物质,在最优的条件下,得到的最低检测限为5fg/mL。
2.5 食品安全
民以食为天,食品安全是最基本的民生问题。在食品安全领域,食源性致病菌、抗生素、农兽药残留和生物毒素污染的检测,以及转基因食品的监控备受公众关注。许多致病菌和抗生素等的残留都是微量的,因此免疫-PCR吸引了众多研究者的目光。Dinesh[9]等建立了免疫磁珠捕获实时定量PCR技术检测黄曲霉毒素B1,分别采用了单克隆抗体直接夹心和多克隆抗体间接夹心免疫PCR检测,结果表明最好的方法是用单克隆抗体捕捉的直接夹心法,其检测范围为 0.1~10ppb,相关性为 0.97,效能为99.5%,这为免疫-PCR检测食品中小分子抗原奠定了基础。He[38]等建立了免疫-PCR技术检测牛肉、液态鸡蛋及牛奶中的蓖麻毒素,结果表明用IPCR检测鸡蛋、牛奶、牛肉的检测限分别为10、10、100pg/mL,而用传统ELISA检测鸡蛋、牛奶、牛肉的检测限分别为 104、103、103pg/mL。Rajkovic[39]等分别用 ELISA 和定量免疫-PCR方法分别检测含1%BSA(bovine serum albumin,牛血清蛋白)的PBS(phosphate buffer solution,磷酸盐缓冲液)及半脱脂牛奶中的肉毒杆菌神经毒素(Clostridium botulinum neurotoxins,BoNT)A、B,结果表明用ELISA检测BoNT/A的检测限分别为15、30ng/mL,检测 BoNT/B的检测限分别为15、30ng/mL;用定量免疫-PCR检测BoNT/A的检测限均为0.09ng/mL,检测BoNT/B的检测限分别为0.37、0.75pg/mL。Leenalitha[40]等采用了免疫-PCR 信号放大技术分别检测牛奶、柠檬奶油派、金枪鱼沙拉及火鸡中的金黄色葡萄球菌肠毒素,其检测限均低至7.5fg/mL。
3 展望
近几年,免疫-PCR凭借其无可比拟的高灵敏性在各个领域得到了迅猛的发展,逐渐走向标准化,该技术与其它技术(如噬菌体展示)[10,28]的结合已成为发展的趋势。
目前,国内外检测食品中小分子抗原的研究应用报道主要局限于液相色谱、质谱、酶联免疫分析法等,然而对一些小分子抗原的痕量检测无法达到国内外规定的最低检测限。考虑到日益成熟的免疫-PCR的高灵敏性及高特异性,本文认为免疫-PCR方法是分析测定食品中小分子抗原残留可行的筛选方法,值得大力推广应用。研制针对食品领域的试剂盒,标准化IPCR的操作,使其实现商品化生产,对食品领域有着重大意义。
[1]Sano T,Smith C L,Cantor C R.A Streptavidin- Protein a Chimera that allows one-step production of a variety of Specific Antibody Conjugates[J].Nature Biotechnology,1991(9):1378-1381.
[2]焦奎,张书圣.酶联免疫分析技术及应用[M].北京:化学工业出版社,2004:1-7,84-140.
[3]Sano T,Cantor C R,Smith C L.Immuno-polymerase chain reaction system for antigen detection[P].Official gazette of the United States patent and trademark office patents,1997,1002(2):1313.
[4]Sano T,Smith C L,Cantor C R.Immuno-PCR-Very sensitive antigen-detection by means of specific antibody-DNA conjugates[J].Science,1992,258(2):120-122.
[5]AdlerM,WackerR,NiemeyerC M.Sensitivityby combination:immuno- PCR and related technologies[J].Critical Review,2008,133(6):685-824.
[6]Nada M,Didier R.Immuno-PCR:a promising ultrasensitive diagnostic method to detect antigens and antibodies[J].Trends in Microbiology,2011,19(6):295-302.
[7]Niemeyer C M,Adler M,Gao S,et al.Nanostructured DNA-protein aggregates consisting ofcovalentoligonucleotidestreptavidin conjugates[J].BioconjugateChem,2001,12:364-371.
[8]Lind K,Kubista M.Development and evaluation of three realtime immuno- PCR assemblages for quantification of PSA[J].Journal of Immunological Methods,2005,304:107-116.
[9]Dinesh B,Peter M.Immunomagnetic bead-based recovery and realtime quantitative PCR(RT iq-PCR)forsensitive quantification of aflatoxin B(1) [J].Journal of Microbiological Methods,2011,86(2):188-194.
[10]Guo Y C,Zhou Y F,Zhang X E,et al.Phage display mediated immuno-PCR[J].Nucleic Acids Research,2006,34(8):e62.
[11]宋云扬,吴方晖,张靖,等.夹心免疫PCR方法检测金葡菌肠毒素 B[J].中国公共卫生,2004,20(7):832-833.
[12]Ye Q Y,Zhuang H S,Zhou C.Detection of naphthalene by real- time immuno- PCR using molecular beacon[J].Molecular and Cellular Probes,2009,23:29-34.
[13]Niemeyer C M,Adler M,Blohm D.Fluorometric polymerase chain reaction(pcr)enzyme-linked immunosorbent assay for quantification of immuno - PCR products in microplates[J].Analytical Biochemistry,1997,246:140-145.
[14]Wu H C,Huang Y L,Lai S C et al.Detection of Clostridium botulinum neurotoxin type A using immuno-PCR[J].Letters in Applied Microbiology,2001,32:321-325.
[15]Niemeyer C M,Wacker R,Adler M.Hapten-functionalized DNA-streptavidin nanocircles as supramolecular reagents in a competitive immuno- PCR assay[J].Angewandte Chemie-International Edition,2001,40(17):3169.
[16]Zhou C,Zhuang H S.Determination of fluoranthene by antigen-coated indirect competitive real-time immuno-PCR assay[J].Journal of Environmental Monitoring,2009,11(2):400-405.
[17]McKie A,Samuel D,Cohen B et al.Development of a quantitative immuno-PCR assay and its use to detect mumpsspecific IgG in serum[J].Journal of Immunological Methods,2002(261):167-175.
[18]Rajesh K.A Quantitative Immunopolymerase Chain Reaction Method forDetection ofvegetative insecticidalprotein in genetically modified crops[J].Journal of Agricultural and Food Chemistry,2011,59(19):10448-10053.
[19]Janet B,Amelita B,Niel C.Immunomagnetic quantitative immuno-PCR for detection of less than one HIV-1 virion[J].Journal of Virological Methods,2009,157(2):122-132.
[20]Widjojoatmodjo M N,Fluit A C,Torensma R,et al.Evaluation of the magnetic immuno pcr assay for rapid detection of salmonella[J].European Journal of Clinical Microbiology &Infectious Diseases,1991,10(11):935-938.
[21]Deng M J,Long L,Xiao X Z,et al.Immuno-PCR for one step detection of H5N1 avian influenza virus and Newcastle disease virus using magnetic gold particles as carriers[J].Veterinary Immunology and Immunopathology,2011,141(3-4):183-189.
[22]宋云扬,刘娟,应天翼,等.夹心免疫PCR方法检测蓖麻毒素[J].免疫学杂志,2002,18(3):229-231.
[23]李辉,许汴利,邓艳,等.弓形虫抗原检测方法的研究[J].中国寄生虫学与寄生虫病杂志,2006,24(1):67-69.
[24]高荣凯.免疫捕捉PCR技术及其应用[J].国际免疫学杂志,2006,29(4):248-252.
[25]Antonio P L,Raimundo R R J,Helvecio D C F,et al.Assessment of the diagnostic potential of Immmunocapture-PCR and Immuno- PCR for citrus variegated chlorosis[J].Journal of Microbiological Methods,2008,75(2):302-307.
[26]Hee-Joo K,Mark M,Shirley G,et al.Noncompetitive Phage Anti-Immunocomplex Real- Time Polymerase Chain Reaction for sensitive detection of small molecules[J].Analytical Chemistry,2011,83(1):246-253.
[27]Jonas W P,Elizabeth A V,Patricia K R,et al.Detection of respiratory syncytial virus using nanoparticle amplified immunopolymerase chain reaction[J].Analytical Biochemistry,2011,410(1):141-148.
[28]张伟华,王晓清,廖世奇,等.抗体Fc片段特异寡核苷酸配基介导的实时定量免疫PCR[J].生物技术通报,2012,23(2):215-219.
[29]Zhang L,Ren J,Pan K F,et al.Detection of gastric carcinoma-associated MG7-Ag by serum immuno-PCR assay in a high- risk Chinese population,with implication for screening[J].International Journal of Cancer,2010,126(2):469-473.
[30]蒲荣,梁玉冰,梁浩凡,等.Immuno-PCR法诊断早期梅毒的方法学建立及其应用[J].中国微生态学杂志,2010,22(6):563-564.
[31]Malou N,Tran N,Nappez C,et al.Immuno-PCR-a new tool for Paleomicrobiology:the plague paradigm[J].Plos One,2012,7(2):1-8.
[32]Hashimoto M,Aoki M,Winblad B,et al.A novel approach for Aβ1-40quantification using immune - PCR [J] .Journalof Neuroscience Methods,2012(205):364-367.
[33]Ozaki H,Sugita S,Kida H.A rapid and highly sensitive method for diagnosis of equine influenza by antigen detection using immuno-PCR[J].Japanese Journal of VETERINARY RESEARCH,2001,48(4):187-195.
[34]Ding Y Z,Liu Y S,Zhou J H,et al.A highly sensitive detection for foot-and-mouth disease virus by gold nanopariticle improved immuno- PCR[J].Virology Journal,2011(8):148-152.
[35]Silva R C,Rogelj S,Cordova S E,et al.An immuno-PCR method for detecting Bacillus thuringiensis Cry1Ac toxin[J].Journal of Immunological Methods,2006(308):109-115.
[36]He X H,Qi H Y,Beatriz Q,et al.Sensitive Detection of Shiga Toxin 2 and Some of Its Variants in Environmental Samples by a Novel Immuno- PCR Assay[J].Applied and Environmental Microbiology,2011,77(11):3558-3564.
[37]Chen H Y,Zhuang H S.Real-time immuno-PCR assay for detecting PCBs in soil samples[J].Analytical and Bioanalytical Chemistry,2009,394(4):1205-1211.
[38]He X H,Stephanie Mc M,Thomas Mc K,et al.Development of a novel immuno-PCR assay for detection of ricin in ground beef,liquid chicken egg,and milk[J].Journal of Food Protection,2010,73(4):695-700.
[39]Rajkovic A,El Moualij B,Zorzi W,et al.Detection of Clostridium botulinum neurotoxins A and Bin milk by ELISA and immuno-PCR at higher sensitivity than mouse bio-assay[J].Food Anal Methods,2012(5):319-326.
[40] Panneerseelan Leenalitha, Muriana Peter M.An immunomagnetic PCR signal amplification assay for sensitive detection of staphylococcus aureus enterotoxins in foods[J].Journal of food protection,2009,72(12):2538-2546.
