紫菜酶解物的制备及其特性
2013-07-17郑惠彬郑温翔翁武银
郑惠彬,郑温翔,翁武银
(集美大学生物工程学院,福建厦门 361021)
我国是紫菜生产大国,2010年产量已经达到10.7万t[1]。其中,福建省近年来实现了坛紫菜品种改良技术的突破,紫菜产量逐年递增,目前已经达到全国的47.7%[1]。然而,由于紫菜加工长期停留在干制品和烤紫菜层面,精深加工品种少,结果导致高产量的紫菜没有实现更大的经济效益回报。紫菜含有丰富的人体必需氨基酸、维生素和矿物质,属于高蛋白、低脂肪的理想保健食品原料[2]。有研究报道显示,紫菜提取物不仅具有降压功效[3],还具有一定的抗肿瘤效果[4]。然而,由于紫菜具有特殊的细胞壁,它在人体内是一种不容易消化的食品[5],因此有必要利用体外酶解方式对紫菜进行深加工,提高人体对紫菜功效成分的消化吸收,有效利用紫菜中的营养成分。利用酶解方法,Sheih等[6]采用胃蛋白酶从海藻加工副产物中提取了具有良好抗氧化活性功能的蛋白肽,姚兴存等[7]采用木瓜蛋白酶制备了具有降血压活性的条斑紫菜蛋白寡肽。本文针对紫菜的细胞壁,将利用纤维素酶结合木瓜蛋白酶对紫菜进行酶解,初步探讨紫菜酶解物的自由基清除能力和理化特性,为紫菜深加工提供基础数据。
1 材料与方法
1.1 材料与仪器
坛紫菜干制品 购于厦门集美农贸市场,根据凯氏定氮法获知紫菜蛋白含量为34.3%;冰乙酸、硼酸、三羟甲基氨基甲烷(Tris) 国药集团化学试剂有限公司;无水乙醇、氯化钠、氢氧化钠 广东光华化学厂有限公司;盐酸、磷酸二氢钠、磷酸氢二钠、三氯乙酸、一水合柠檬酸、抗坏血酸 西陇化工股份有限公司;柠檬酸钠、硼砂上海恒信化学试剂有限公司;纤维素酶 酶活力10000U·g-1,北京生物技术有限公司;木瓜蛋白酶 酶活力650000U·g-1,广西南宁庞博生物工程有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 日本和光纯药株式会社;实验所用试剂均为分析纯。
高速冷冻离心机 美国Beckman有限公司;UV-2600A型紫外分光光度计 上海元析仪器有限公司;日立835-50型高速氨基酸分析仪 日本日立制造所。
1.2 实验方法
1.2.1 紫菜酶解物的制备 紫菜酶解物的制备是根据预实验的结果对文献[8]报道的方法进行适当的改动,也就是将干紫菜与1mg/mL的酶液以4∶100的固液比混合均匀,将溶液pH调至5.5后利用55℃水浴酶解。酶解一段时间后,利用100℃水浴加热灭酶5min,冷却后离心(8000 ×g,4℃,15min)获得紫菜酶解物上清液。另外,利用复合酶对紫菜进行酶解时纤维素酶与木瓜蛋白酶按1∶1的比例混合组成。
酒精溶液与紫菜酶解液按体积比3∶1进行搅拌混合均匀后于4℃下浸提一段时间,离心(10000×g,4℃,20min)后获得紫菜浸提液,经冷冻干燥后获得紫菜酶解物。
1.2.2 紫菜酶解物的固形物得率及蛋白提取率 将提取后不溶性残渣放置105℃烘箱中干燥至恒重,紫菜的固形物得率和蛋白提取率分别按下式计算:
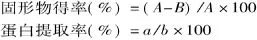
式中,A为紫菜原料的干重(g);B为紫菜提取后不溶性残渣的干重(g);a为紫菜酶解物的蛋白含量(g);b为紫菜原料的总蛋白含量(g)。
1.2.3 DPPH自由基清除率的测定[9]在2mL紫菜酶解液(固形物含量为3mg/mL)中加入等体积的0.2mol/L的DPPH酒精溶液,混合均匀后,在暗处静置30min后测定其在517nm处的吸光度,同时以蒸馏水和抗坏血酸作为对照。DPPH自由基清除率(K)按下式进行计算:

式中,A样为样品的吸光度;A对照为蒸馏水对照组的吸光度。
1.2.4 氨基酸组成分析 将紫菜粉末和紫菜酶解物粉末利用6mol/L HCl于110℃下水解24h,水解液过滤后用2mol/L氢氧化锂溶液将pH调节至2.2,经0.22μm水系过滤膜过滤后,利用氨基酸自动分析仪测定样品的氨基酸组成。
1.2.5 蛋白溶解性的测定[10]准确称取0.5g紫菜酶解物粉末溶于不同pH的缓冲溶液(pH3~8)中,离心(10000 ×g,4℃,10min)后,利用Lowry法测定溶解在上清中的蛋白含量,而紫菜酶解物粉末的总蛋白含量根据微量凯氏定氮法测定。上清液中的蛋白含量与酶解物粉末总蛋白含量的比值即为紫菜酶解物的蛋白溶解率。
1.2.6 乳化性和乳化稳定性的测定 将紫菜酶解物粉末溶于6mL 0.2mol/L柠檬酸-柠檬酸钠缓冲液(pH3)中配制成0.5%的紫菜酶解物溶液,加入2mL食用油,利用均质机在室温下高速搅拌(11000r/min,1min)制成乳状液,利用0.1%SDS溶液稀释50倍后于500nm处测定吸光值,其中以0.1%SDS溶液替代样品液作为空白,紫菜酶解物在pH3下的乳化性指数(EAI,cm2/mg)[11]按下式进行计算:
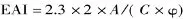
式中:A为乳状液在500nm处的吸光值,C为紫菜酶解物的质量(mg);φ为乳状液中油所占的体积比(0.25);
将用于EAI测定的乳状液在室温下静置30min,再测定其乳化性指数EAI',并根据下式计算紫菜酶解物在 pH3 下的乳化稳定性(ESI,min)[12]。

式中,Δt为时间间隔(min)。
另外,按照上述方法测定紫菜酶解物在 pH7(0.2mol/L磷酸氢二钠-磷酸二氢钠缓冲液)和pH9(0.2mol/L硼酸-硼砂缓冲液)下的EAI和ESI。
2 结果与分析
2.1 酶解方法对紫菜提取率的影响
图1显示了纤维素酶、木瓜蛋白酶及其复合酶酶解对紫菜固形物得率和蛋白提取率的影响。从图1a可以看出,当利用纤维素酶对紫菜进行酶解时,紫菜固形物得率随着酶解时间的延长出现上升趋势。当利用木瓜蛋白酶对紫菜进行酶解时,紫菜固形物提取率的变化趋势与利用纤维素酶进行酶解的变化趋势基本一致,但提取率出现一定程度的增加。紫菜细胞壁及细胞膜的破碎程度决定了紫菜提取物的得率[13],细胞壁主要由胶质层与纤维层构成,而细胞膜的主要成分为糖蛋白与磷脂[14]。当紫菜经过纤维素酶和木瓜蛋白酶的复合酶解,固形物提取率明显提高(图1a),表明了纤维素酶和木瓜蛋白酶的共同作用可以促进紫菜细胞破碎溶解。这可能是紫菜在纤维素酶和木瓜蛋白酶的复合酶解作用下,细胞壁和细胞膜同时被降解,结果使紫菜固形物提取率进一步增加。王在贵等[15]报道了蛋白酶虽然对纤维素酶会产生一定的分解作用,但纤维素酶的活性仍比较稳定。而且,Zhang等[16]还报道了蛋白酶可以提高纤维素酶的水解效率。因此,可以利用纤维素酶和木瓜蛋白酶对紫菜进行复合酶解。另一方面,由图1b可以发现,利用木瓜蛋白酶酶解得到的蛋白提取率明显高于纤维素酶,而利用木瓜蛋白酶结合纤维素酶对紫菜进行复合酶解时,尤其经过6h酶解后,蛋白提取率没有进一步得到提高,表明了纤维素酶主要促进紫菜纤维溶解,木瓜蛋白酶则主要使紫菜蛋白溶解。
2.2 紫菜酶解物的抗氧化性
2.2.1 紫菜酶解物的DPPH自由基清除率 利用自由基清除率表征物质抗氧化活性是目前普遍采用的方法[17]。由于利用纤维素酶、木瓜蛋白酶及其复合酶提取的紫菜酶解物中蛋白和多糖成分明显不同(图1),因此通过测定紫菜酶解物的DPPH自由基清除率分析紫菜酶解物的抗氧化性,结果如图2所示。由图可以发现,利用纤维素酶对紫菜进行酶解时,紫菜酶解物的DPPH自由基清除率随着酶解时间的延长出现一定程度的降低,这个趋势与利用复合酶酶解的结果类似。然而当利用木瓜蛋白酶对紫菜进行酶解时,紫菜酶解物的DPPH自由基清除率明显比添加纤维素酶的样品高。这可能是纤维素酶使酶解物中多糖含量增加,蛋白相对含量就减少,结果表明了紫菜酶解的抗氧化性主要来源于紫菜蛋白及其小分子肽。因此,对紫菜酶解物的DPPH自由基清除率与蛋白含量之间的相关性进行了分析(图3),结果发现DPPH自由基清除率随蛋白含量的增加逐渐上升,而且清除率与蛋白含量之间存在显著的相关关系(R2=0.92)。
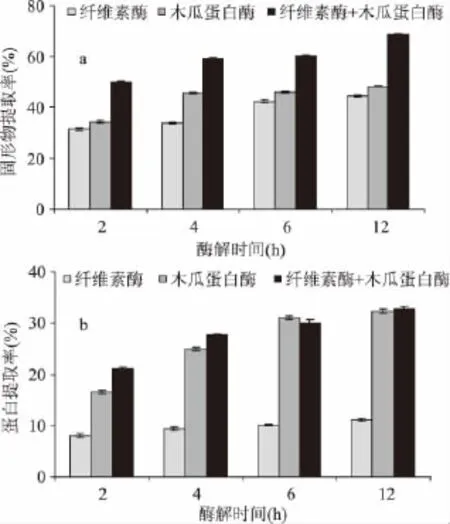
图1 酶解时间对紫菜固形物得率(a)和蛋白提取率(b)的影响Fig.1 Effect of enzymatic hydrolysis time on the extraction rate of solid(a)and protein(b)from Porphyra haitanensis
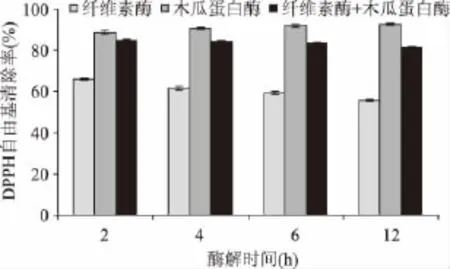
图2 酶解对DPPH自由基清除率的影响Fig.2 Effect of enzymatic hydrolysis on DPPH radical scavenging activity of hydrolysates from Porphyra haitanensis
2.2.2 紫菜酶解物中的抗氧化活性物质分析 酒精会使蛋白或大分子肽段、多糖等发生沉淀,在藻类多糖提取纯化过程中经常添加浸提液3倍体积的浓度为95%的酒精使多糖沉淀[18-19]。因此,在本研究中采用终浓度为75%的酒精对复合酶酶解的紫菜提取物进行浸提,考察了浸提前后紫菜酶解物的DPPH自由基清除率的变化,结果如表1所示。由表可以看出,无论酶解时间长短,经酒精浸提后紫菜酶解物的DPPH自由基清除率都可以得到提高(表1),表明利用酒精除去酶解物中的部分蛋白质、高分子多肽及多糖后,具有抗氧化活性氨基酸或小肽可以得到浓缩,进而提高紫菜酶解物的DPPH自由基清除能力。当利用抗坏血酸作为阳性对照进行比较,发现酒精浸提获得的紫菜酶解物的DPPH自由基清除能力大约是抗坏血酸的1/3,但紫菜酶解物主要是由多肽和寡糖组成,对人体不会有副作用,将具有更广阔的应用前景。
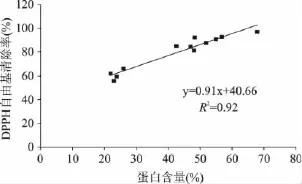
图3 DPPH自由基清除率与蛋白含量的关系Fig.3 Relation between the DPPH radical scavenging activity and the protein content of hydrolysates from Porphyra haitanensis
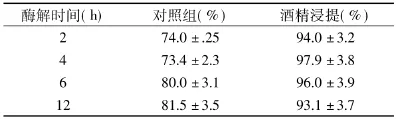
表1 酒精浸提对紫菜复合酶解物DPPH自由基清除率的影响Table1 Effect of alcohol extract on DPPH radical scavenging activity of hydrolysates from Porphyra haitanensis with composite enzyme
为进一步了解酶解过程和酒精浸提过程中紫菜提取物成分的变化,对紫菜及其提取物的氨基酸组成进行了测定,结果如表2所示。由表可知,紫菜中富含多种氨基酸,经酶解后,除了Cys、His以外,其余氨基酸含量均有一定程度的增加。其中Glu增加最多,其次是 Pro、Tyr、Asp、Gly等,而且这些氨基酸经酒精浸提后含量进一步得到提高。据报道,Pro、Tyr、Met、Lys、Asp、His 是抗氧化肽中的主要氨基酸[20],尤其Tyr具有酚羟基结构,能提供质子从而猝灭自由基。His含有咪唑环,可以螯合金属离子拥有良好的抗氧化活性[21],而且含有His的二肽和三肽都具有很强的自由基清除活性[22]。有报道显示,Tyr和Gly氨基酸自身就具备抗氧化活性[23]。因此,紫菜经复合酶解和酒精浸提后,提取物的DPPH自由基清除率可以得到显著提高(表1)。
2.3 紫菜酶解物的理化特性
以上结果表明紫菜经复合酶解、酒精浸提后,提取物具备良好的抗氧化活性,但在实际应用过程中往往还需要考虑产品的溶解性,乳化性和乳化稳定性等理化特性。因此,对紫菜酶解物的这些理化特性进行了考察。
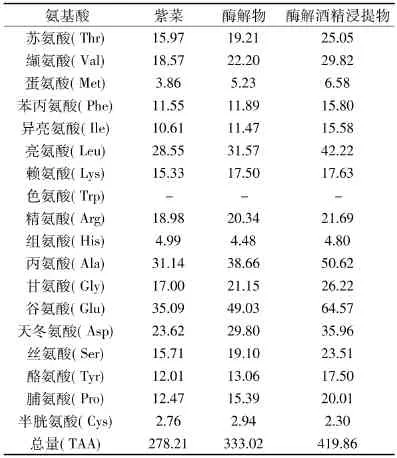
表2 紫菜及其酶解提取物的氨基酸组成(mg/g)Table2 Effect of enzymatic hydrolysis on amino acid composition of Porphyra haitanensis(mg/g)
2.3.1 溶解性 图4显示了紫菜酶解物在不同pH下的蛋白溶解性。由图可以看出,当酶解时间较短(2h)时,紫菜提取物在pH6下溶解度为82.5%,而在其他pH条件下则其溶解度都接近100%,表明紫菜蛋白的等电点可能在pH6附近。随着酶解时间的延长,紫菜提取物即使在pH6下其溶解度也逐渐接近100%,表明了酶解提高了紫菜蛋白的溶解性。这主要是紫菜蛋白经过酶解后形成小分子肽和氨基酸,分子由卷曲状态成为较伸直的状态,分子表面的电荷增加,加强了分子自身之间、分子与水溶液之间的静电作用[24],从而提高了酶解物的蛋白溶解性。
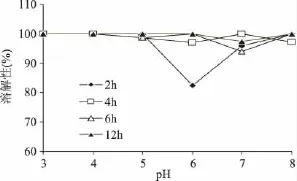
图4 紫菜酶解物的溶解性Fig.4 The solubility of hydrolysates from Porphyra haitanensis
2.3.2 乳化性和乳化稳定性 对紫菜酶解物在不同pH条件下的乳化性及乳化稳定性进行了测定,结果如图5所示。不论酶解时间长短,在pH3和pH7下,紫菜酶解物的乳化性都相对较差,而在pH9下乳化性相对较好(图5a)。这可能是pH的上升会使紫菜提取物蛋白中的负电荷增加[25],结果提高了紫菜提取物的乳化性。同时还可以发现,相同的pH下,酶解时间对紫菜提取物的乳化性影响不显著。另一方面,在紫菜酶解物的乳化稳定性分析结果(图5b)显示,在pH3下乳化稳定性随着酶解时间延长逐渐降低,经过6h酶解后逐渐稳定;在pH7下,乳化稳定性几乎不受酶解时间的影响;然而在碱性pH条件下,紫菜酶解物的乳化稳定性随酶解时间的延长呈现先上升后下降的趋势,在酶解6h时乳化稳定性最好。一般而言,蛋白质在等电点附近时,乳化颗粒之间缺乏排斥力,乳化稳定性较差。在本研究中紫菜酶解物在pH3以及pH9下的乳化稳定性均高于pH7,类似于姚兴存[25]等报道的结果,进一步表明了紫菜酶解提取的蛋白等电点在中性pH附近(图4)。
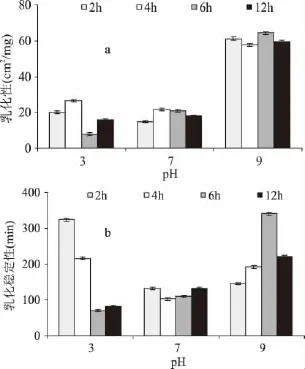
图5 紫菜酶解物的乳化性(a)和乳化稳定性(b)Fig.5 The emulsion activity(a)and emulsion stability(b)of hydrolysates from Porphyra haitanensis
3 结论
利用纤维素酶与木瓜蛋白酶对坛紫菜进行复合酶解后可以获得具有一定抗氧化功能的物质,经酒精浸提后该提取物的抗氧化活性还可以进一步得到提高。紫菜酶解物的DPPH自由基清除率与蛋白含量之间存在显著的正相关关系,而且还发现利用酒精浸提可以增加抗氧化功能的氨基酸比例,提取物DPPH自由基清除率也随之提高,表明了紫菜酶解物中的抗氧化活性物质可能来源于紫菜蛋白分解的小分子肽及氨基酸。此外,紫菜酶解物在任一pH下蛋白溶解性都可以接近100%,同时还具有良好的乳化性及乳化稳定性,表明利用复合酶解、酒精浸提的方法获得的紫菜酶解物可以作为制备抗氧化功能保健食品的蛋白多肽原料。
[1]农业部渔业局,中国渔业年鉴[M].中国农业出版社,2011:181-186.
[2]张全斌,赵婷婷,綦慧敏,等.紫菜的营养价值研究概况[J].海洋科学,2005,29(2):69-72.
[3]王茵,刘淑集,吴成业.紫菜降血压肽酶法制备工艺的优化[J].福建水产,2008,12(4):64-68.
[4]顾佳雯,张陆曦,徐红丽,等.条斑紫菜多糖的分离纯化和抗肿瘤活性[J].中国生物工程杂志,2007,27(7):50-54.
[5]萩野浩志.海苔由来の健康機能性成分とその利用[J].ジャパンフ-ドサイエンス,2007,46(1):44-53.
[6]Sheih IC,Wu TK,Fang TJ.Antioxidant properties of a new antioxidative peptide from algae protein waste hydrolysate in different oxidation systems[J].Bioresource Technology,2009,100(13):949-957.
[7]姚兴存,蒋栋磊,盘赛昆,等.条斑紫菜蛋白酶解物降血压活性[J].食品与发酵工业,2011,37(2):62-69.
[8]姚兴存,蒋卉,舒留泉,等.条斑紫菜活性肽的抗氧化作用[J].食品科学,2011,32(7):104-108.
[9]Yang JI,Liang WS,Chow CJ,et al.Process for the production of tilapiaretorted skin gelatin hydrolysateswith optimized antioxidative properties[J].Process Biochemistry,2009,44:1152-1157.
[10]邓成萍,薛文通,孙晓琳,等.不同分子量段大豆多肽功能特性的研究[J].食品科学,2006,27(5):109-112.
[11]Chobert JM,Catherine BH,Nicolas MG.Solubility and emulsifying properties of caseins and whey proteins modified enzymatically by trypsin[J].Journal of Agricultural and Food Chemistry,1988,36:883-892.
[12]Krasaechol N,Sanguandeekul R,Duangmal K,et al.Structure and functional properties of modified threadfin bream sarcoplasmic protein[J].Food Chemistry,2008,107:1-10.
[13]蔡春尔,周铭,李春霞,等.条斑紫菜藻胆蛋白提纯方法优化探索[J].生物技术通报,2009(2):98-102.
[14]沈颂东,戴继勋,周立冉.条斑紫菜(Porphyra yezoensis)丝状体的超微结构观察[J].海洋通报,2000,19(3):38-44.
[15]王在贵,韩薇,刘朝良,等.家蚕肠道环境对外源纤维素酶活力稳定性影响的研究[J].激光生物学报,2012,21(1):31-35.
[16]Zhang Y,Chen S,Xu M,et al.Characteriztion of thermobifida fusca cutinase Carbohydrate-Binding Module Fusion Proteins and their potential application in bioscouring[J].Applied and Environmental Microbiology,2010,76(20):6870-6876.
[17]Maria IG,Francisco AT.Antioxidant activity of pomegranate juice and its relationship with phenolic composition and processing[J].Journal of Agricultural and Food Chemistry,2000,48:4581-4589.
[18]刘青梅,杨性民,邓红霞,等.紫菜多糖提取分离及纯化技术研究[J].浙江大学学报,2005,31(3):293-297.
[19]Na YS,Kim WJ,Kim SM,et al.Purification,characterization and immunostimulating activity of water-soluble polysccharide isolated from Capsosiphon fulvescens[J] .International Immunopharmacology,2010,10(3):364-370.
[20]Pihlanto A.Antioxidative peptides drived from milk propeins[J].Internatinal Dairy Journal,2006,16(11):1306-1314.
[21]张莉莉,严群芳,王恬.大豆生物活性肽的分离及其抗氧化活性研究[J].食品科学,2007,28(5):208-210.
[22]Saito K,Jin DH,Ogawa T,et al.Antioxidative properties of tripeptide libraries prepared by the combinatorial.Chemistry[J].Journal of Agricultural and Food Chemistry,2003,51(12):3668-3674.
[23]Chen HM,Yamauchi F,Fujimoko K,et al.Antioxidative propties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].Journal of Agricultural and Food Chemistry,1998,46(1):49-53.
[24]刘长江,曹向宇,刘剑利,等.麦麸多肽的酶法制备及其特性研究[J].食品工业,2009,1:34-36.
[25]姚兴存,李静,舒留泉,等.条斑紫菜活性肽的制备及其功能性质研究[J].食品研究与开发,2011,32(12):12-15.
