三七总皂苷对急性肺损伤大鼠血清和支气管肺泡灌洗液肿瘤坏死因子α、白介素6和白介素10水平的影响
2013-07-16陈宇清
陈宇清,荣 令,周 新
多发性创伤和严重感染常可引起急性肺损伤 (acute lung injury,ALI)甚至急性呼吸窘迫综合征 (acute respiratory distress syndrome,ARDS)。目前认为ALI/ARDS是由多种炎性递质及效应细胞共同参与,并呈级联放大的瀑布样炎症与继发性弥漫性肺实质损伤。ALI时肺毛细血管通透性增加,富含蛋白的水肿液进入肺间质甚至肺泡,导致严重通气/血流比例失调,继而造成顽固性低氧血症。在参与炎症反应与肺损伤中的众多炎症递质中,肿瘤坏死因子α(TNF-α)、白介素6(IL-6)和白介素10(IL-10)是最有影响的促炎症细胞因子,其与ALI的发病和死亡率密切相关[1-2]。三七总皂苷 (saponins of panax notoginseng,PNS)是五加科人参属植物三七的提取物,能阻断受体操纵性钙通道、增强一氧化氮 (NO)的扩张血管作用、改善微循环以及抗缺血再灌注损伤,对心、肝、肾、脑及肠黏膜屏障等均具有良好的抗损伤作用[3-5]。本研究采用油酸-脂多糖序贯诱导急性肺损伤 (OA-ALI)大鼠模型,观察PNS对OA-ALI大鼠氧合能力、肺含水量与病理学变化的影响,以及对血清与支气管肺泡灌洗液 (BALF)中TNF-α、IL-6和IL-10水平的影响。现将结果报道如下。
1 材料与方法
1.1 一般材料 Wistar雄性健康大鼠28只,体质量250~300g,由中国科学院上海实验动物中心提供,饲养于上海交通大学附属第一人民医院动物实验中心 (证书号 No.283)。实验前饲养1周,清洁级恒温 (25℃)环境,标准饲料,自由取水。油酸 (oleic acid,OA)和脂多糖 (lipopolysaccharide,LPS)由美国Sigma公司提供,TNF-α、IL-6和IL-10试剂盒均由上海越研生物技术有限公司提供。
1.2 方法 按随机数字表法将动物分为4组,每组7只。A组为正常对照组,B组为ALI模型对照组,C组为ALI模型+PNS治疗组,D组为ALI模型+PNS治疗+机械通气组。实验动物用10%水合氯醛 (0.35ml/kg)腹腔注射麻醉,肝素(400U/kg)腹腔注射抗凝,B、C和D组动物下腔静脉置管缓慢注射OA 0.2ml/kg,再给予0.9%氯化钠溶液0.08ml尾静脉注射,4h后给予LPS(4mg/ml)5mg/kg腹腔注射。经腹主动脉采血0.3~0.5ml测定动脉血气。动脉血氧分压/吸入氧浓度(PaO2/FiO2)≤300mmHg(1mmHg=0.133kPa) 时认为ALI模型建立成功。D组大鼠气管插管后与ALC-V8型动物呼吸机(上海奥尔科特生物科技有限公司,上海)连接。机械通气参数设置:通气模式为控制通气 (controlled mandatory ventilation,CMV),潮气量 (VT):15ml/kg,通气频率:40次/min,吸呼时间比:1∶1,呼气末正压 (PEEP):0 cm H2O(1cmH2O=0.098 kPa),吸入氧浓度 (FiO2):21%。C、D两组动物尾静脉注射PNS 100mg/kg(云南植物药业有限公司提供);B组则予以等体积0.9%氯化钠溶液代替。
1.3 BALF的采集、病理学检查 建模成功后4h用质量分数为10%的氯化钾处死动物,处死动物前留取动脉血1~2ml,枸橼酸钠抗凝。打开胸腔后夹闭双侧肺门,以手术线分别结扎左右主支气管,取套针扎入左主支气管近端,以4℃无菌肝素盐水 (200U/ml)15ml,分3次灌入左肺,每次盥洗2遍,最终回收到 BALF 12~13ml。将 BALF 1000r/min离心10min,13000×g离心30min后备用。于远离结扎处剪下右肺,上叶置于10%中性甲醛中固定48h后常规制备石蜡切片后,进行苏木精-伊红 (HE)和维多利亚蓝-立春红 (VP)染色。游离左肺,迅速用吸水纸吸干表面水分和血液,电子天平精确称湿质量 (wet weight,W),经 -0.06kPa×70℃脱水 24h后,再称量干质量 (dry weight,D),以肺W/D比值表示肺组织含水量。
1.4 酶联免疫 (ELISA)法检测 TNF-α、IL-6和IL-10操作流程 (双抗体夹心法)依照试剂明书。终止反应后,将酶标板放入酶标仪槽内,选择450nm波长进行检测,确定标准品和空白对照区域,由酶标检测检测计算并绘制标准曲线,打印全部样本检测结果。
1.5 统计学方法 使用SPSS 11.0统计软件包进行数据处理,计量资料以(±s)表示,多组间均数比较采用单因素方差分析 (One-way ANOVA),组间比较采用Bonfferoni t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 肺组织病理 A组大鼠肺呈均匀淡粉红色,包膜完整,弹性好,表面未见病损灶,无液体溢出;光镜下肺组织结构完整,肺泡间隔均匀一致,肺泡腔清晰,肺泡壁光滑,仅可见少量粒细胞;B组大鼠的肺脏体积显著增大,充血水肿明显,弹性降低;光镜下可见肺间质及肺泡内出血,炎症细胞浸润,肺泡间隔增宽,伴有灶性肺不张;注射PNS后C、D两组大鼠的肺组织病理损伤较B组减轻 (见图1)。

图1 ALI大鼠的肺组织病理改变Figure 1 Change of ALI in rat lung tissue pathologic
2.2 肺组织W/D与氧合的比较 4组大鼠动脉血二氧化碳分压 (PaCO2)比较,差异无统计学意义 (P>0.05)。OA-LPS序贯注射后B组、C组和D组3组大鼠的PaO2/FiO2均≤300mmHg,4组PaO2/FiO2、W/D比较,差异均有统计学意义(P<0.05)。C、D组大鼠PaO2/FiO2与B组比较,差异有统计学意义 (P<0.01);B组与A组比较,差异有统计学意义(P<0.01)。B组大鼠的肺W/D值较A组比较,差异有统计学意义 (P<0.01);PNS注射后C、D两组大鼠的W/D值与B组比较,差异有统计学意义 (P<0.01,见表1)。
2.3 血清、BALF的TNF-α、IL-6和IL-10水平的比较4组大鼠血清、BALF的TNF-α、IL-6和IL-10水平比较,差异均有统计学意义 (P<0.01)。B组大鼠血清 TNF-α、IL-6和IL-10水平与A组比较,差异均有统计学意义 (t值分别为 -27.815、 -27.559、 -49.731,P <0.01);B 组大鼠BALF中的TNF-α、IL-6和IL-10水平与A组比较,差异均有统计学意义 (t值分别为 -34.407、-40.261、 -19.410,P<0.01);B组大鼠BALF中的TNF-α、IL-6和IL-10水平与血清比较,差异均无统计学意义 (P>0.05)。C、D两组大鼠在注射PNS后其血清TNF-α、IL-6和IL-10水平与B组比较,差异均有统计学意义 (P<0.01);C、D两组大鼠BALF中的TNF-α、IL-6和IL-10水平与B组比较,差异均有统计学意义 (P<0.01);C、D两组大鼠BALF中的IL-6水平与血清IL-6水平比较,差异有统计学意义 (P<0.05)。正压机械通气支持30min后,D组大鼠血清与BALF中的TNF-α、IL-6和IL-10水平比较,差异均无统计学意义 (P>0.05,见表2)。
表1 4组大鼠的PaO2/FiO2、PaCO2、W/D的比较(±s)Table 1 Comparison of PaO2/FiO2,PaCO2,W/D in the 4 groups of rats

表1 4组大鼠的PaO2/FiO2、PaCO2、W/D的比较(±s)Table 1 Comparison of PaO2/FiO2,PaCO2,W/D in the 4 groups of rats
注:与A组比较,△P<0.01; 与B组比较,*P<0.01
组别 只数 PaO2/FiO2(mmHg)PaCO2(mmHg)W/D A组7 440.4 ±33.2 39.5 ±2.6 4.90 ±0.70 B 组 7 249.8 ±24.8△ 38.7 ±2.6 7.65 ±0.55△C 组 7 288.4 ±17.4* 39.4 ±1.3 7.25 ±0.44*D 组 7 291.0 ±22.6* 38.9 ±2.4 7.03 ±0.65*F 178.10 0.427 31.991 P值值<0.001 >0.5 <0.001
表2 4组大鼠血清和BALF中TNF-α、IL-6和IL-10水平比较(±s,ng/L)Table 2 Comparison of TNF-α,IL-6 and IL-10 levels in serum and BALF in the 4 groups of rats
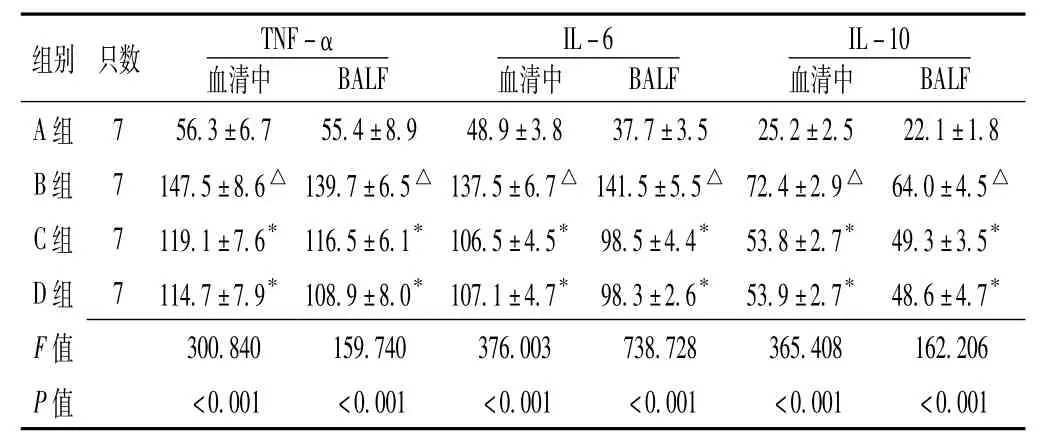
表2 4组大鼠血清和BALF中TNF-α、IL-6和IL-10水平比较(±s,ng/L)Table 2 Comparison of TNF-α,IL-6 and IL-10 levels in serum and BALF in the 4 groups of rats
注:与A组比较,△P<0.01; 与B组比较,*P<0.01
BALF组别 只数 TNF-α血清中A 组 7 56.3±6.7 55.4±8.9 48.9±3.8 37.7±3.5 25.2±2.5 22.1±1.8 B组 7 147.5±8.6△ 139.7±6.5△ 137.5±6.7△ 141.5±5.5△ 72.4±2.9△ 64.0±4.5△C 组 7 119.1±7.6* 116.5±6.1* 106.5±4.5* 98.5±4.4* 53.8±2.7* 49.3±3.5*D 组 7 114.7±7.9* 108.9±8.0* 107.1±4.7* 98.3±2.6* 53.9±2.7* 48.6±4.7*F 300.840 159.740 376.003 738.728 365.408 162.206 P值值<0.001 <0.001 <0.001 <0.001 <0.001 <0.001 BALF IL-6血清中BALF IL-10血清中
3 讨论
目前建立ALI动物模型的方法主要有OA、LPS和大剂量0.9%氯化钠溶液肺泡灌洗3种,OA序贯小剂量LPS造模旨在模拟在严重创伤基础上并发重度感染所致ALI,且尤其适用于表现ALI向ARDS演变的过程。本研究显示应用OA-LPS二次致伤后,大鼠出现明显呼吸窘迫症状,氧合 (PaO2/FiO2)显著恶化;肺组织充血水肿明显,有较严重的炎症细胞浸润。PNS注射后,ALI大鼠的肺组织充血水肿程度明显减轻,肺W/D 值由 (7.65±0.55) 降至 (7.25 ±0.44),有显著性差异,而PaO2/FiO2也得到显著改善。
炎症细胞与炎性递质是ALI形成的重要递质。有研究显示,TNF-α、IL-6在ALI/ARDS的发生和发展过程中具有重要作用,并反映了肺损伤的严重程度。TNF-α是炎症细胞因子网络中的重要环节,ALI/ARDS发生后,血清TNF-α水平早期即出现增高并迅速达到峰值。TNF-α对肺有强烈的毒性,能诱导肺内皮细胞活化、白细胞迁移、中性粒细胞脱颗粒和毛细血管渗漏,肺泡内积聚的水肿液进一步阻碍肺泡细胞的血流灌注和氧气交换,加重低氧血症。TNF-α亦可诱导内皮细胞和巨噬细胞释放IL-6。IL-6也是一种重要的炎症细胞因子,可诱导急性期炎症反应的产生,促进多种细胞的分化、活化,激活T细胞、B细胞而调节免疫反应。在ALI/ARDS中,IL-6具有促进炎症反应,增强白细胞聚集、渗透,介导组织损害,加重肺损伤的作用。IL-6水平的增高反过来又可增强组织细胞对 TNF-α的敏感性[6-7]。本研究中,经过OA-LPS二次致伤后,ALI大鼠血清和BALF中的TNF-α和IL-6水平均较正常对照组显著增高,PNS注射后,血清和BALF中的TNF-α和IL-6水平则呈显著降低,表明PNS有助于减轻肺内的炎症反应,抑制促炎症细胞因子的释放,对肺脏具有一定的保护作用。PNS联合正压机械通气支持组大鼠的血清与BALF中的TNF-α和IL-6水平虽较单独注射PNS时有所改变,但无差异。
IL-10是主要的免疫抑制性细胞因子。IL-10由多种细胞产生,其中以Th2细胞、巨噬细胞、CD+8T细胞为主,具有广泛的抑制促炎症细胞因子的作用。IL-10可能是通过直接抑制T细胞增殖和分泌细胞因子、抑制抗原提呈细胞间接抑制T细胞应答、抑制气道炎症,最终减轻ALI的发生发展。孙荣青等[8]发现IL-10水平与脓毒症严重程度相关,且随着疾病进展IL-10对炎症反应起到抑制作用。Li等[9]对42例MODS患者动态检测TNF-α、IL-6及IL-10水平的变化,结果显示3种炎症细胞因子在疾病早期均明显升高,与对照组比较差异有统计学意义。有研究发现,PNS不仅能够抑制树突状细胞和巨噬细胞等产生TNF-α等炎症细胞因子,并对炎症造成的血管内皮细胞损伤具有保护作用[10-11]。本研究显示,OALPS序贯诱导ALI大鼠的血清与BALF中的IL-10水平也较NS对照组显著增高,表明在ALI病程中,机体可能同时存在促炎症反应和抗炎症反应,二者平衡的失调是导致ALI加重并发展为ARDS的重要机制之一。PNS具有较强的抗炎作用,在本研究中PNS不仅能够降低OA-LPS诱导ALI大鼠肺组织中TNF-α和IL-6水平,同时IL-10的水平也得到显著降低,显示PNS在减轻肺组织的炎症反应的同时,也可能有助于纠正促炎症反应和抗炎症反应的失衡,减缓或阻止ALI向ARDS的发展。
OA-LPS诱导ALI后,大鼠体内同时存在促炎症反应和抗炎症反应,PNS对其具有一定保护作用,可以明显减低ALI大鼠的血清和BALF中的TNF-α、IL-6及IL-10水平,可能有助于减缓或阻止ALI向ARDS发展。同时,PNS通过促进肺泡内液体的主动转运,降低血管外肺水含量,减轻肺水肿,从而改善肺顺应性,缓解低氧血症[12]。血清和 BALF中TNF-α、IL-6及IL-10水平的动态变化对ALI/ARDS的进展具有重要的诊断参考价值。早期干预炎症反应可能有助于改善ALI的预后。
1 Waage A,Brandtzaeg P,Halstensen A,et al.The complex pattern of cytokines in derum from patients with meningococcal septic shock.Association between interleukin 6,interleukin 1,and fatal outcome[J].J Exp Med,1989,169(1):333-338.
2 Steinhauser M,Hogaboam C,Kunkel S,et al.IL-10 is a major mediator of sepsis-induced impairment in lung antibacterial host defense[J].J Immumol,1999,162:392-399.
3 Ng TB.Pharmacological activity of sanchi ginseng(Panax notoginseng)[J].J Pharm Pharmacol,2006,58(8):1007-1019.
4 魏宏建,付春来,荣令.三七总皂苷对肠黏膜屏障保护作用的研究[J].中国中西医结合急救杂志,2006,13(5):309-312.
5 黄侃,邓祥坚,罗健东,等.三七皂甙增强一氧化氮介导的慢性缺氧大鼠肺动脉舒张作用[J].广州医药,1999,30(4):54.
6 Fattori E,Cappelletti M,Costa P,et al.Defective inflammatory response in interleukin 6-deficient mice[J].J Exp Med,1994,180(4):1243-1250.
7 Bauer TT,Monton C,Torres A,et al.Comparison of systemic cytokine levels in patients with acute respiratory distress syndrome,severe pneumonia,and controls[J].Thorax,2000,55(1):46-52.
8 孙荣青,张少雷.脓毒症早期血清白细胞介素-18和10在疾病严重程度及预后评估中的价值研究 [J].中国危重病急救医学,2011,23(5):299-301.
9 Li YH,Jiang XQ,Sun HZ,et al.IL-6,IL-10 and TNF-α in acute organophosphorus pesticide poisoning induced MODS role and clinical significance[J].Critical Care Medicine,2006,26(11):804-805.
10 Wang Y,Peng D,Huang W,et al.Mechanism of altered TNF-alpha expression by macrophage and the modulatory effect of Panax notoginseng saponins in scald mice [J].Burns,2006,32(7):846-852.
11 陈剑鸿,王碧江,刘松青,等.三七总皂苷对内毒素损伤血管内皮细胞炎症特性的影响 [J].中国医院药学杂志,2004,24(3):140-141.
12 陈宇清,荣令,周新.三七总皂甙对急性肺损伤犬血管外肺水及呼吸力学的影响 [J].中国中西医结合急救杂志,2008,15(6):350-352.
