不同厂家布洛芬缓释胶囊体外释放度比较
2013-07-13彭秋燕许煜静许文婷李翔宇杨金荣
彭秋燕,许煜静,许文婷,李翔宇,杨金荣
(天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070)
布洛芬(ibuprofen)系非甾体类解热消炎镇痛药,在临床上广为应用。1964年由美国Boots公司首先研制并于1969年在英国上市[1]。1991年,布洛芬缓释胶囊(芬必得)在中国上市,其独有的12 h缓释技术,成功填补了我国在缓释胶囊制作工艺上的空白。目前国内有多厂家生产布洛芬缓释胶囊,质量各异。释放度实验是能在很大程度上体现生物利用度的一种常用方法。本实验对国内9个不同厂家布洛芬缓释胶囊的体外释放度进行研究,并与芬必得缓释胶囊进行了比较。
1 材料与方法
1.1 仪器与试药
1.1.1 仪器 安捷伦1200系列高效液相色谱仪,RCZ-8A智能药物溶出仪(天津市鑫洲科技有限公司),万分之一电子天平(赛多利斯科学仪器有限公司)。
1.1.2 试剂 布洛芬对照品(中国药品生物制品检定所,批号:100179-201105);布洛芬缓释胶囊(中美天津史克制药有限公司:批号10050632,以下简称芬必得;其余9个厂家的布洛芬缓释胶囊分别以字母作代号:A厂:批号 091204;B厂:批号20110605;C 厂:批号 111108;D 厂:批号 111201;E 厂:批号20111009;F厂:批号20111104;G厂:批号20120307;H 厂:批号 1111104;I厂:批号10302003);乙腈(J&K SCIENTIFIC TLD)和甲醇(天津基准化学试剂有限公司)均为色谱纯;其余试剂均为分析纯。
1.2 方法
1.2.1 色谱条件 色谱柱为Agilent XDB-C18柱(150 mm×4.6 mm,5 μm);流动相为乙腈-pH 值为2.5的醋酸盐缓冲液(60:40);流速为1 mL/min;检测波长为263 nm;进样量为20 μL;柱温为35℃。
1.2.2 储备液的配制 精密称取布洛芬对照品150 mg,置50 mL容量瓶中,以甲醇溶解,并稀释至刻度,混匀,即得布洛芬储备液。
1.2.3 标准曲线的制备方法 精密量取布洛芬储备液 0.10、0.20、0.40、0.60、0.80、1.00、1.20 mL,分别置10 mL量瓶中,加释放介质稀释至刻度,摇匀,分别于上述色谱条件下测定。
1.2.4 释放度测定方法 取样品6粒,按照《中华人民共和国药典》2010年版释放度测定法[2],采用溶出度测定法第一法装置,以经脱气处理的磷酸盐缓冲液(pH6.0±0.05)900 mL为释放介质,转篮转速为30 r/min,温度(37±0.5)℃,依法操作。分别在 1、2、3、4、5、7、10、12 h 时取样 5 mL 滤过,并及时补充同温度释放介质5 mL,取续滤液20 μL注入液相色谱仪,记录色谱图。以外标法计算每粒胶囊在不同时间的累积释放百分率。
1.2.5 结果判定方法
1.2.5.1 药典标准:布洛芬缓释胶囊在1、2、4 h与7 h时布洛芬的释放量应分别为标示量的10%~35%、25%~55%、50%~80%和75%以上。
1.2.5.2 相似因子法:将各厂家溶出曲线与芬必得溶出曲线计算相似因子。相似因子的计算公式为式中Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放度,n为测试点数。若受试与参比制剂的溶出曲线间的f2值不小于50,则认为两者相似[3-4]。
1.2.6 模型拟合与参数比较 将释药曲线进行释药模型拟合[5],包括零级方程、一级方程、Higuchi方程、Ritger-Peppas方程和威布尔方程[6-7]。对所得威布尔参数T50、Td分别与芬必得进行比较(t检验)[8]。
2 结果
2.1 布洛芬标准曲线的线性范围 以布洛芬标准溶液浓度C为横坐标、相应的峰面积A为纵坐标,求得pH6.0释放介质中的布洛芬标准曲线方程为A=1.566 C+0.2619 ,(r=0.9999,n=3)。可见在 pH6.0磷酸盐缓冲液介质中,布洛芬于30~360 μg/mL浓度范围内,有良好的线性关系。
2.2 释放度结果 芬必得及9个厂家的布洛芬缓释胶囊平均累积释放百分率数据见表1。
表1 芬必得及9个厂家布洛芬缓释胶囊平均累积释放百分率(%)(n=6,±s)Tab 1 Accumulate dissolution percent of fenbid and ibuprofen sustained capsules from nine manufacturers in different time(%)(n=6,±s)
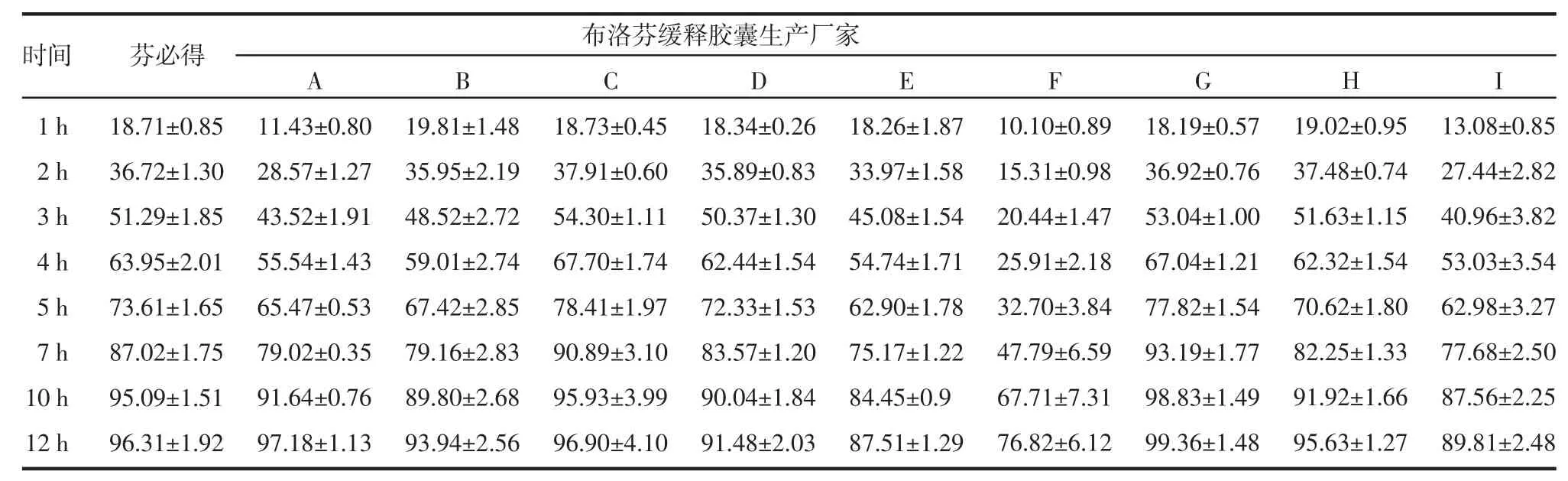
表1 芬必得及9个厂家布洛芬缓释胶囊平均累积释放百分率(%)(n=6,±s)Tab 1 Accumulate dissolution percent of fenbid and ibuprofen sustained capsules from nine manufacturers in different time(%)(n=6,±s)
1 h 2 h 3 h 4 h 5 h 7 h 10 h 12 h B 19.81±1.4835.95±2.1948.52±2.7259.01±2.7467.42±2.8579.16±2.8389.80±2.6893.94±2.56 A 11.43±0.8028.57±1.2743.52±1.9155.54±1.4365.47±0.5379.02±0.3591.64±0.7697.18±1.1318.71±0.8536.72±1.3051.29±1.8563.95±2.0173.61±1.6587.02±1.7595.09±1.5196.31±1.92 E 18.26±1.8733.97±1.5845.08±1.5454.74±1.7162.90±1.7875.17±1.2284.45±0.987.51±1.29 D 18.34±0.2635.89±0.8350.37±1.3062.44±1.5472.33±1.5383.57±1.2090.04±1.8491.48±2.03 C 18.73±0.4537.91±0.6054.30±1.1167.70±1.7478.41±1.9790.89±3.1095.93±3.9996.90±4.10 G 18.19±0.5736.92±0.7653.04±1.0067.04±1.2177.82±1.5493.19±1.7798.83±1.4999.36±1.48 F 10.10±0.8915.31±0.9820.44±1.4725.91±2.1832.70±3.8447.79±6.5967.71±7.3176.82±6.12 I 13.08±0.8527.44±2.8240.96±3.8253.03±3.5462.98±3.2777.68±2.5087.56±2.2589.81±2.48 H 19.02±0.9537.48±0.7451.63±1.1562.32±1.5470.62±1.8082.25±1.3391.92±1.6695.63±1.27布洛芬缓释胶囊生产厂家时间 芬必得
2.3 结果判定
2.3.1 药典标准 从表1中可看出只有F厂的产品在1、2、4 h与7 h时的释放不符合要求,其余各厂家产品各释放点数据均符合要求。
2.3.2 相似因子 将各厂家溶出曲线与芬必得溶出曲线计算相似因子,结果见表2。
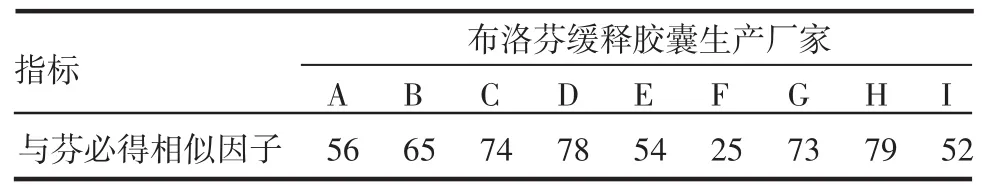
表2 不同厂家布洛芬缓释胶囊与芬必得释放曲线的相似因子Tab 2 f2factor of ibuprofen sustained capsules from nine manufacturers with fenbid
从表2中可看出,只有F厂的产品与芬必得溶出曲线的相似因子小于50,与芬必得不相似,其余厂家产品与芬必得溶出曲线的相似因子均大于50,与芬必得相似,其中H厂的产品与芬必得相似因子最高,为79。
2.4 模型拟合与参数比较 根据上述释放度测定的结果,对芬必得及9个厂家产品进行释药模型拟合,结果除F厂家外,其余厂家产品威布尔方程拟合的相关系数最高,均大于等于0.997,其次拟合相关系数较高的是一级方程。将各平均累积释放百分率数据代入威布尔(weibull)概率分布函数表达式提取参数m(形态参数)、T50(释放50%所需时间)、Td(释放63.2%所需时间),结果见表3。对所得参数T50、Td分别与芬必得进行比较(t检验),结果见表4及表5。
表3 芬必得及9个厂家布洛芬缓释胶囊的溶出参数(n=6,±s)Tab 3 Dissolutions degrees parameters of fenbid and ibuprofen sustained capsules from nine manufacturers(n=6,±s)
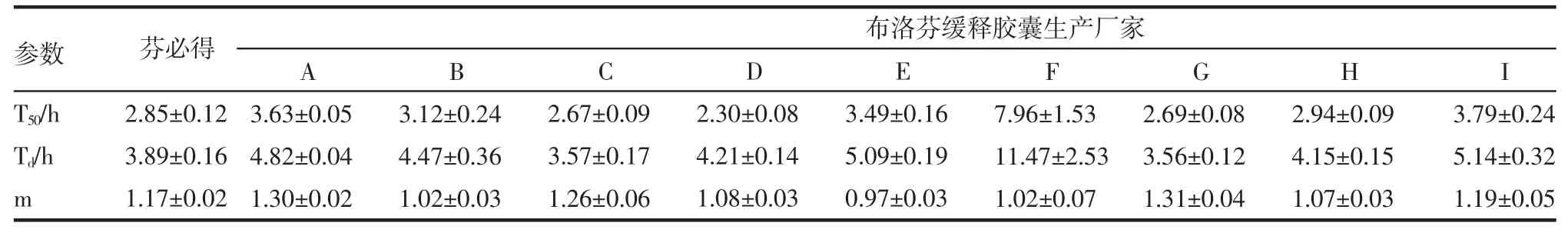
表3 芬必得及9个厂家布洛芬缓释胶囊的溶出参数(n=6,±s)Tab 3 Dissolutions degrees parameters of fenbid and ibuprofen sustained capsules from nine manufacturers(n=6,±s)
布洛芬缓释胶囊生产厂家B 3.12±0.244.47±0.361.02±0.03 A 3.63±0.054.82±0.041.30±0.02 E 3.49±0.165.09±0.190.97±0.03 D 2.30±0.084.21±0.141.08±0.03 C 2.67±0.093.57±0.171.26±0.06 G 2.69±0.083.56±0.121.31±0.04 F 7.96±1.5311.47±2.531.02±0.07 I 3.79±0.245.14±0.321.19±0.05 H 2.94±0.094.15±0.151.07±0.032.85±0.123.89±0.161.17±0.02 T50/h Td/h m参数 芬必得
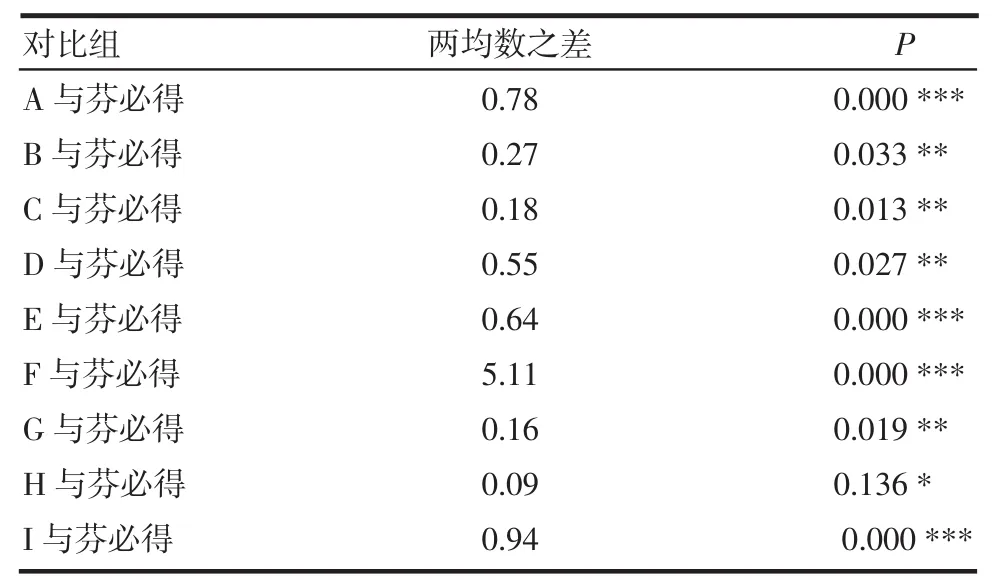
表4 9个厂家的布洛芬缓释胶囊T50与芬必得比较Tab 4 Comparison of T50of ibuprofen sustained capsules from nine manufacturers with fenbid
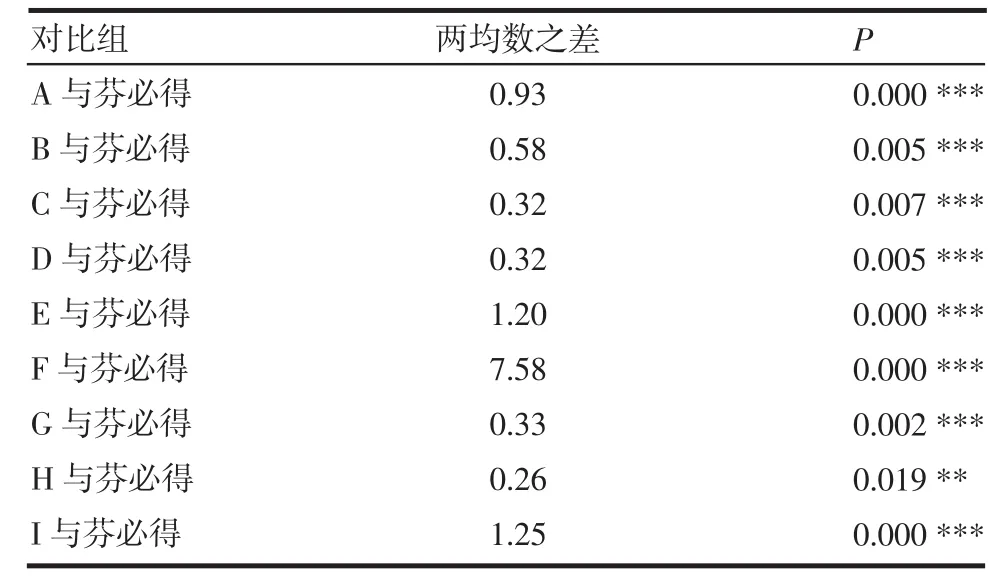
表5 9个厂家的布洛芬缓释胶囊Td与芬必得比较Tab 5 Comparison of Tdof ibuprofen sustained capsules from nine manufacturers with fenbid
从表中可见F厂的产品与芬必得T50、Td差异最大,H厂家的产品与芬必得T50、Td差异最小。
3 讨论
本研究对不同厂家同一批号的样品进行了释放度的考察。厂家B和E在2 h、厂家F在2 h、4 h和7 h以及厂家I在2 h、4 h时产品的释放百分率RSD值大于5%,均一性差,厂家E、F和I产品12 h时释放百分率小于90%,释放不完全,厂家F在2 h、4 h和7 h时产品的释放百分率不符合药典要求。从不同厂家溶出参数的方差分析结果可知,不同厂家产品与芬必得溶出参数T50、Td存在差异。
布洛芬缓释胶囊释放度的差异与布洛芬晶型、生产工艺及辅料种类和用量有关。布洛芬为难溶性药物,不同晶型的制剂可能有不同的溶解度[9],并影响其生物活性[10]。从相关文献查阅发现布洛芬缓释胶囊的制备工艺大致分以下3种:粉末层积法、流化床包衣法以及挤出滚圆法。其中F厂的产品从说明书中给出辅料推测其制备工艺为粉末层积法。粉末层积法要求原辅料混合均匀度好,混合辅料粒度至少小于100目,并且流动性好,否则易造成释放均一性差[11]。挤出滚圆法原辅料要混合均匀,反之亦会引起释放均一性差。而流化床包衣法则无均匀度及粒度问题,因而药物释放均一性好。因此,不同厂家产品质量差异较大,这些差异是否会引起体内生物利用度及临床疗效的不同,有待于进一步研究证实。由于缓释微丸的释放受原辅料及生产工艺中多种因素的影响,从本次实验的9个厂家产品来看,各家产品在释放速度、释放均一性等方面均有一定差异,提示其质量优劣不一。因此临床医生选择药物时,必须从安全、经济、有效综合考虑。
[1]陈彪,王建华,李樱,等.布洛芬缓释制剂的研究概况[J].药学实践杂志,2006,24(2):65
[2]国家药典委员会.中华人民共和国药典.二部[S].北京:化学工业出版社,2010:附录XD
[3]Shah V P,Tsong Y,Sathe P,et al.In vitro dissolution profile comparison-statistics and analysis of the similarity facter,f2[J].Pharmaceut Res,1998,15(6):8891
[4]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308
[5]王志强,吴继禹,张秀华.用Excel软件对溶出数据进行多种曲线拟合和处理[J].海峡药学,2006,18(1):47
[6]张莉,夏运岳.用电子表格Excel计算药物溶出度Weibull分布参数[J].药学进展,2002,26(1):8
[7]刘瑞新,李学林,王青晓.威布尔溶出曲线的4种非线性拟合方法比较[J].中国医院药学杂志,2009,29(15):1315
[8]方积乾.卫生统计学[M].第6版.北京:人民卫生出版社,2008:105-105
[9]侯秀清,戚雪勇,王立军.布洛芬3种晶型的制备及其溶解度测定[J].江苏药学与临床研究,2003,11(6):62
[10]王津,李柱来,陈莉敏.布洛芬缓释微球的释放性能及体内外相关性研究[J].中国药业,2008,17(1):6
[11]崔久峰.布洛芬缓释微丸的研究[D].沈阳:沈阳药科大学,2005,06
