迟钝爱德华氏菌Ⅲ型分泌系统基因的克隆及多重PCR检测方法的建立
2013-07-12王斌赵凤梅李军伟沈皓王惠胡亮
王斌,赵凤梅,李军伟,沈皓,王惠,胡亮
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室农业部北方海水增养殖重点实验室,辽宁大连116023)
迟钝爱德华氏菌Ⅲ型分泌系统基因的克隆及多重PCR检测方法的建立
王斌,赵凤梅,李军伟,沈皓,王惠,胡亮
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室农业部北方海水增养殖重点实验室,辽宁大连116023)
采用PCR法扩增大菱鲆Scophthalmus maximus出血性败血症病原菌迟钝爱德华氏菌Edwardsiella tarda L-49231菌株Ⅲ型分泌系统 (TTSS)的装置蛋白 (esaC)、效应蛋白 (eseB、eseC、eseD)和调节蛋白(esrA、esrB)6种基因,并将其克隆到载体PMD19-T中分别进行测序;通过优化反应条件,建立一次检出效应蛋白eseB、eseC和eseD 3种基因片段的多重PCR方法;采用所建立的多重PCR方法检测迟钝爱德华氏菌不同菌株(L-49231、GhAn080310、GhAn080313和GhAn080314)、沙门氏菌Salmonella enterica、大肠杆菌Escherichia coli和肠杆菌Enterobacter中效应蛋白基因的存在情况。结果表明:L-49231菌株中存在esaC、eseB、eseC、eseD、esrA和esrB 6种基因片段,大小分别为837、184、934、445、464、458 bp,与GenBank中迟钝爱德华氏菌PPD130/91菌株的这6种基因的同源性分别为99%、97%、99%、99%、99%、98%;通过优化反应条件,在退火温度为54℃,基因eseB、eseC和eseD引物浓度 (μmol/L)组合比为5∶10∶2,Mg2+浓度为1.5 mmol/L时,能够得到清晰、稳定且均一的多重PCR产物,并与目的条带分子量一致;采用所建立的多重PCR方法进行检测,迟钝爱德华氏菌L-49231菌株中存在eseB、eseC和eseD 3种基因片段,迟钝爱德华氏菌GhAn080310、GhAn080313、GhAn080314菌株中存在eseB和eseC基因片段,但未检出eseD基因片段;沙门氏菌、大肠杆菌和肠杆菌中均未检出eseB、eseC和eseD基因。表明所建立的多重PCR方法对迟钝爱德华氏菌具有较好的特异性,可检出具有Ⅲ型分泌系统效应蛋白的菌株。
迟钝爱德华氏菌;Ⅲ型分泌系统;克隆;多重PCR
迟钝爱德华氏菌Edwardsiella tarda隶属于肠杆菌科Enterobacteriaceae、爱德华氏菌属Edwardsiella Ewing and Mcwhorter 1965[1],宿主范围和地理分布都十分广泛,能够在淡水和海水中生存。主要感染低等和高等脊椎动物,如鱼类[2]、两栖类[3]、爬行类[4]、鸟类[5]和哺乳类等动物,是爱德华氏菌属中唯一能感染人致腹泻的细菌[6]。该菌能引起多种养殖鱼类败血症,给水产养殖业带来严重经济损失。Ⅲ型分泌系统是迟钝爱德华氏菌重要的致病基因簇之一,该基因簇共分4组,分别为效应分子(ese)、装置分子esa、调节分子esr和伴侣分子esc,其中效应蛋白eseB、eseC、eseD是胞外产物的主要成分,已有研究认为,它们可能表达细菌细胞外的某些结构,在细菌致病过程中起着重要作用[7]。本试验中,作者选择从患病大菱鲆 Scophthalmus maximus体内分离到的1株强致病性迟钝爱德华氏菌(编号L-49231)[8]为试验对象,扩增并克隆其中6种基因片段,建立一次检出3种效应蛋白(ese)基因片段的多重PCR检测方法,以期能够有效检出水产动物携带的致病菌株,为研究该菌的分子致病机理以及今后亚单位疫苗的研发奠定基础。
1 材料与方法
1.1 材料
1)试验菌株。迟钝爱德华氏菌L-49231、沙门氏菌、大肠杆菌及肠杆菌用营养琼脂培养基在37℃ 下培养 24 h备用;迟钝爱德华氏菌GhAn080310、GhAn080313、GhAn080314用脑心浸出液培养基 (BHI)在28℃下培养24 h备用。基因克隆和检测用试验菌株的来源见表1。
2)试验试剂。营养琼脂培养基、BHI、PCR试剂及克隆载体等分别购自宝生物工程 (大连)有限公司和上海生工生物技术服务有限公司; 0.5×TBE缓冲液、LB培养基、SOC液体培养基均为自行配制。

表1 试验菌株Tab.1 The bacterium strains in this study
3)引物序列。迟钝爱德华氏菌Ⅲ型分泌系统(TTSS)装置蛋白 (esaC基因)、效应蛋白 (eseB、 eseC、eseD基因)和调节蛋白 (esrA、esrB基因)的引物分别为esaC-IF/IR,eseB-IF/IR、eseC-IF/ IR、eseD-IF/IR,esrA-IF/IR、esrB-IF/IR[7],由上海生工生物工程技术有限公司合成,引物M13-47和RV-M购自宝生物工程 (大连)有限公司,引物序列见表2。

表2 本试验所用引物序列Tab.2 Oligonucleotide primers used for PCR in the study
1.2 方法
1.2.1 L-49231菌株目的基因的PCR扩增 每个菌株培养24 h得到纯的单菌落后,分别挑取3~4个菌落悬浮于50 μL灭菌超纯水中,99℃下变性10 min,于4℃下保存,用于提取模板DNA。
1)目的基因扩增反应条件。6个目的基因反应体系相同:在50 μL反应体系中加入10×PCR buffer(Mg2+plus)5 μL,dNTP(各2.5 mmol/L) 4 μL,模板DNA 5 μL,引物esaC-IF和esa-IR (10 μmol/L)各2 μL,rTaq(5 U/μL)0.3 μL,加灭菌超纯水31.7 μL补至50 μL。6个目的基因的PCR扩增程序中,除eseB和eseD基因的循环参数——退火温度和时间分别为59℃、40 s和54℃、40 s外,其余反应程序均为94℃下预变性5 min;94℃下变性30 s,52℃下退火30 s,72℃下复性1 min,共进行30个循环;最后在72℃下延伸10 min。
2)PCR产物的检测及回收。配制琼脂糖(Agarose D-1 LE)含量为20 g/L的琼脂糖凝胶,取PCR产物5 μL与1 μL 6×loading buffer混匀后点样,进行琼脂糖凝胶电泳,在100 V下电泳40 min左右,使用凝胶成像仪和照相系统记录试验结果。用DNA回收试剂盒回收DNA,并于-20℃下保存备用。
1.2.2 目的基因的克隆及测序
1)装置蛋白esaC及调节蛋白esrA、esrB基因的克隆。按照pMD19-T载体试剂盒说明书进行操作,白斑菌落用LB培养基划斜面保存,并用PCR法确认阳性克隆。PCR反应体系为30 μL,其中: 10×PCR buffer(Mg2+plus)3 μL,dNTP(各2.5 mmol/L)2.5 μL,模板DNA 3 μL,引物M13-47和RV-M(10 μmol/L)各1 μL,rTaq(5 U/μL) 0.2 μL,加灭菌超纯水19.3 μL补至30 μL。PCR反应条件为:94℃下预变性5 min;94℃下变性30 s,55℃下退火30 s,72℃下复性1 min,共进行25个循环;最后在72℃下延伸10 min。挑选阳性克隆进行增菌、测序。
2)效应蛋白 eseB、eseC、eseD基因的克隆。在3支PCR管中分别加入pMD19-T 1 μL,相应的PCR产物2 μL,灭菌超纯水2 μL,其余同上。
1.2.3 效应蛋白 eseB、eseC、eseD基因的多重PCR条件的建立及优化
1)退火温度的优化。与PCR扩增的反应体系相同,同样的预变性和变性条件,分别于50、52、54、56、58、60℃下退火 40 s,72℃下复性 1 min,共进行30个循环;最后在72℃下延伸10 min,于4℃下保存。将PCR产物用20 g/L凝胶电泳检测,获得最佳退火温度。
2)引物浓度组合比的优化。5种不同引物浓度组合的反应体系:各种浓度组合加入 2 μL, rTaq DNA聚合酶0.3 μL,加灭菌超纯水20.7 μL补至50 μL。将样品混匀后,于94℃下预变性5 min;94℃下变性30 s,根据退火温度试验,选择最佳退火温度54℃下退火40 s,72℃下复性1 min,共进行30个循环;最后在72℃下延伸10 min,于4℃下保存。将PCR产物用20 g/L凝胶电泳检测,分析最佳引物浓度组合比 (表3)。

表3 引物浓度组合比Tab.3 Combination of primer concentrations μmol/L
3)Mg2+浓度的优化。PCR反应体系50 μL,其中:10×PCR buffer(Mg2+free)5 μL,dNTP(各2.5 mmol/L)4 μL,L-49231模板5 μL,加入经过优化的最佳引物浓度组合2(5∶10∶2)2 μL,分别加入25 mmol/L MgCl24.0、3.5、3.0、2.5、2.0、1.5 μL,使终浓度分别为2.0、1.75、1.5、1.25、1.0、0.75 mmol/L,rTaq DNA聚合酶0.3 μL,分别加灭菌超纯水补至50 μL。将样品混匀后,于94℃下预变性5 min;94℃下变性30 s,最佳退火温度54℃下退火40 s,72℃下复性1 min,共进行30个循环;最后在72℃下延伸10 min,于4℃下保存。将PCR产物用20 g/L凝胶电泳检测,分析最佳Mg2+浓度。
1.2.4 多重PCR反应的特异性检测 选用不同来源的3株迟钝爱德华氏菌、1株沙门氏菌、1株大肠杆菌和1株肠杆菌,用上述建立的方法进行PCR扩增,以检验所建立多重PCR方法的特异性及效应蛋白基因在不同细菌或菌株中的存在情况。每个试验重复3次。
2 结果
2.1 目的基因的PCR扩增
esaC基因扩增出一个条带,大小为850 bp左右,无杂带、拖带现象,与文献 [7]报道的该毒力基因相符 (图1);eseC扩增条带大小为900 bp左右,eseD为450 bp左右,eseB大小为200 bp左右 (图2);esrB和esrA扩增条带大小均为450 bp左右 (图3)。
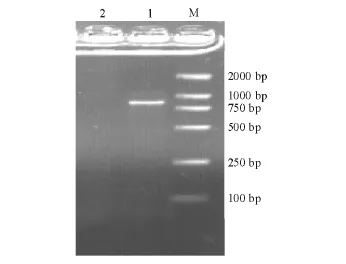
图1 TTSS装置蛋白esaC基因的PCR扩增结果Fig.1 The PCR amplification of the TTSS apparatus esaC
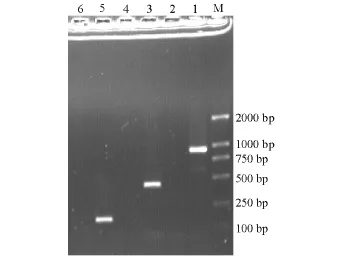
图2 TTSS效应蛋白eseB、eseC和eseD基因的PCR扩增结果Fig.2 The PCR amplification of the TTSS effectors eseB,eseC and eseD

图3 TTSS调节蛋白esrA、esrB基因的PCR扩增结果Fig.3 The PCR amplification of the TTSS regulators esrA and esrB
2.2 目的基因克隆后的PCR检测
6种目的基因均成功克隆到载体中,经PCR检测各条带分子量去除载体部分均与目标基因大小相同。esaC为837 bp,eseB、eseC、eseD基因分别为184、934、445 bp,esrA和 esrB基因为464、458 bp。
2.3 迟钝爱德华氏菌TTSS基因的测序
将 esaC测序结果通过国际互联网 NCBI (www.ncbi.nlm.nih.gov)上的VecScreen去掉其两端的载体序列,与迟钝爱德华氏菌 PPD130/91 TTSS装置蛋白esaC基因 (登录号:AAX6941.1)的同源性为 99%;同法将 eseB、eseC和 eseD与PPD130/91的3个基因 (登录号:AAV76903.1、AAV769404.1、AAV769405.1)比对,同源性分别为 97%、99%、99%;esrA 和 esrB 基 因 与PPD130/91菌株相同基因 (登录号:AAV69423.1和AAX76904.1)的同源性分别为99%和98%。
2.4 多重PCR反应条件的建立及优化
迟钝爱德华氏菌L-49231在最佳退火温度、最佳Mg2+浓度、不同引物浓度组合下PCR的扩增结果如图4所示。通过多重PCR扩增得到3条均一、稳定的条带,3条带大小分别为200、900、450 bp左右,与目的eseB、eseC和eseD基因的大小相符。从图4可看出,在最佳退火温度、最佳Mg2+浓度下,引物浓度组合比为5∶10∶2时,扩增条带最清晰。

图4 不同引物浓度组合下L-49231菌的多重PCR扩增结果Fig.4 The multi-PCR amplification of different primer concentration combination of L-49231
通过对多重PCR反应退火温度的优化,得到最佳退火温度为54℃。在此基础上,对多重PCR反应的引物浓度组合比和Mg2+浓度进行优化,得出eseB、eseC、eseD最佳引物浓度 (μmol/L)组合比为5∶10∶2,最佳Mg2+浓度为1.5 mmol/L。在最佳退火温度、最佳引物浓度组合比、最佳Mg2+浓度下,多重 PCR扩增效果最佳,eseB、eseC、eseD 3条目的条带均较清晰。
2.5 多重PCR反应的特异性检测
2.5.1 迟钝爱德华氏菌及沙门氏菌的检测 迟钝爱德华氏菌及沙门氏菌的多重PCR检测结果如图5所示。从图5可见:迟钝爱德华氏菌GhAn080310、GhAn080313、GhAn080314均扩增出3个DNA条带,大小分别为200、900、2 000 bp左右,其中200 bp及900 bp左右的DNA条带与目的eseB和eseC条带大小相符,可见在迟钝爱德华氏菌GhAn080310、GhAn080313、GhAn080314中也可以检测到与L-49231相同的eseB和eseC基因,而2 000 bp左右的条带与目的eseD大小 (440 bp)不一致,表明在这3株菌种不存在与L-49231相同的eseD基因;在沙门氏菌中,均未检测到 eseB、eseC和eseD基因。

图5 迟钝爱德华氏菌及沙门氏菌的多重PCR检测结果Fig.5 The multi-PCR detection of Edwardsiella tarda and Salmonella enterica
2.5.2 肠杆菌及大肠杆菌的检测 肠杆菌及大肠杆菌的多重PCR检测结果见图6,在肠杆菌及大肠杆菌中均未检测到eseB、eseC和eseD基因。
3 讨论

图6 肠杆菌及大肠杆菌的多重PCR检测结果Fig.6 The multi-PCR detection of Escherichia coli and Enterobacter
本试验中采用PCR扩增大连地区养殖大菱鲆出血性败血症病原菌迟钝爱德华氏菌L-49231的TTSS基因 esaC、eseB、eseC、eseD、esrA和 esrB,将PCR产物回收后克隆到载体PMD19-T中,并对阳性克隆产物进行了测序。结果得到了相应的目的片段,大小分别为 837、184、934、445、464、458 bp,与迟钝爱德华氏菌 PPD130/91的 esaC、eseB、eseC、eseD、esrA、esrB基因的同源性分别为99%、97%、99%、99%、99%、98%,从而在分子水平上证明了迟钝爱德华氏菌L-49231中含有TTSS装置蛋白 (esaC基因)、效应蛋白 (eseB、eseC、eseD基因)和调节蛋白 (esrA、esrB基因)。在迟钝爱德华氏菌中,已经证实调节基因esrA-esrB是以二元复合体的形式存在,它不仅对TTSS基因的表达起调节作用,还调节TTSS基因簇之外的某些基因的表达,如evp基因[9-10],它还可以直接或间接地对黏附基因、侵袭基因起调节作用; eseB、eseC和eseD是该菌胞外产物中的主要成分,与野生菌相比,eseB、eseC、eseD基因的突变株将导致细菌毒力下降为原来的1/10,因此,eseB、eseC、eseD与细菌的毒力具有密切的关系[7]。但是,TTSS的作用机制以及各组分在细菌致病过程中的具体功能尚未明确,这些都有待进一步研究。另外,eseB基因与迟钝爱德华氏菌的自动凝集能力有关。序列分析结果表明,eseB、eseC和eseD与沙门氏菌 S.enterica serovar Typhimurium 中的 sseB、sseC和 sseD的同源性分别为29.5%、24.4%和23.9%,因而有学者认为,eseB、eseC和eseD蛋白在迟钝爱德华氏菌中也同样起着转运的作用[7]。研究还证实了eseB、eseC、eseD蛋白在被分泌之后形成蛋白复合体,这与它们被假定的转运作用相符[11]。因此,以eseB、eseC和eseD基因作为研究对象来探索迟钝爱德华氏菌的多重PCR检测方法具有十分重要的意义。本试验中以L-49231为模板,采用迟钝爱德华氏菌的TTSS效应蛋白基因eseB、eseC和eseD为检验目标,探索一次检出3种基因片段的多重PCR方法。经过反应条件的探索及优化,结果在退火温度为 54℃,基因 eseB、eseC和eseD引物浓度 (μmol/L)组合比为5∶10∶2,Mg2+浓度为1.5 mmol/L时,能够得到清晰、稳定且均一的多重 PCR产物,大小分别为200、900、450 bp左右,与目的条带大小一致。
本研究中对迟钝爱德华氏菌不同菌株及沙门氏菌、大肠杆菌和肠杆菌 (与迟钝爱德华氏菌同属于肠杆菌科)进行了多重PCR检测,结果表明:迟钝爱德华氏菌L-49231中存在与文献 [7]报道的 PPD130/91基本相同的 TTSS效应蛋白基因eseB、eseC和eseD;迟钝爱德华氏菌GhAn080310、GhAn080313、GhAn080314中也具有 eseB和 eseC基因,但是在这3株菌中并未检测到与L-49231菌株和PPD130/91菌株大小一致的eseD基因,除eseB、eseC基因外,扩增到一条分子量近2 000 bp的条带,是否为eseD基因的变异或其他相似的基因尚不能确定。这一结果提示,分离于不同宿主的同种致病菌所携带的效应蛋白基因可能不同,原因可能与致病基因的来源、细菌受环境影响发生突变等因素有关,具体还有待进一步深入研究。有一点可以肯定,迟钝爱德华氏菌的TTSS效应蛋白基因存在一定程度的保守性,但不能排除基因水平的变异以及转录后水平的变化。在沙门氏菌、大肠杆菌和肠杆菌中,eseB、eseC和eseD基因均未检测到。从以上结果推测,TTSS基因在迟钝爱德华氏菌不同的菌株中有可能存在变异或缺失,江云等[12]在利用PCR法对国内3株迟钝爱德华氏菌的6个基因citC、fimA、gadB、mukF、katB和esrB检测时也只出现了citC、fimA、gadB、mukF 4个毒力基因,而katB和esrB两个毒力基因未出现,也有文献报道这几个毒力基因只在国外分离株中发现[13],表明毒力基因在不同菌株中可能存在一定的差异,因此,eseB、eseC、eseD基因在迟钝爱德华氏菌中的存在情况以及片段的差异还需要大量的分离株来进行检验。另外,由于迟钝爱德华氏菌的TTSS基因与沙门氏菌SPI2编码的TTSS具有一定的同源性,且迟钝爱德华氏菌TTSS基因的分类也是根据其与沙门氏菌的TTSS基因及功能的相似性来命名的[7],故本试验中重点对沙门氏菌进行多重PCR检测,然而eseB、eseC和eseD基因的这3对引物并未在沙门氏菌中扩增出相应的条带。表明迟钝爱德华氏菌的TTSS与沙门氏菌的TTSS在基因水平上具有较大的差异,已有文献报道,沙门氏菌毒力岛SPI2的突变导致该菌对小鼠毒力减弱,调节基因 (ssrA)、效应基因 (sseA、sseB、sseC和 spiC)或装置基因 (spiA)的失活都导致沙门氏菌毒力大大降低[14-16],而在迟钝爱德华氏菌中,调节基因(esrA和esrB)的缺失导致迟钝爱德华氏菌毒力的降低程度远大于其效应基因 (eseB、eseC和eseD)和装置基因 (esaC)[7]。尽管在不同的迟钝爱德华氏菌株中检测到的这3条基因片段不尽相同,但均有相应的产物出现,并且两条完全一样,可以认为该方法对迟钝爱德华氏菌具有较好的特异性。
常亚青等[17]研究报道了采用PCR方法检测虾夷马粪海胆致病菌强壮弧菌,张凤萍等[18]和韩一凡等[19]分别报道了采用PCR方法检测水产动物的病原菌,本研究中所建立的多重PCR检测方法可有效检出迟钝爱德华氏菌毒株,可避免检疫过程中非毒株检出带来的干扰。
综上所述,本试验中建立的多重PCR方法,检测结果稳定、条带清晰,操作方便,耗时短,可应用于迟钝爱德华氏菌致病菌株的检测。但由于验证试验选择的菌株数较少,对检测样品的敏感性试验、组织中细菌的检出试验等内容尚未进行,因此,对于该方法的确立和完善还有待于大量的相关研究。
[1]Holt J G,Krieg N R,Sneath P H A,et al.Bergey's Manual of Determinative Bacteriology[M].Baltimore:Williams and Wilkins, 1994:178,204,225.
[2]Sae-Oui D,Muroga K,Nakai T.A case of Edwardsiella tarda infection in cultured colored carp Cyprinus carpio[J].Fish Pathol, 1984,9:197-199.
[3]Kourany M,Vasquez M,Saenz R.Edwardsiellosis in man and animals in Panama:clinical and epidemiological characteristics[J]. Am J Trop Med Hyg,1977,26:1183-1190.
[4]Goldstein E J C,Agyare E O,Vagvolgi A E,et al.Aerobic bacterial oral flora of garter snakes:development of normal flora and pathogenic potential for snakes and humans[J].Clin Microbiol,1981, 13:954-956.
[5]Cook R A,Tappe J P.Chronic enteritis associated with Edwardsiella tarda infection in Rockhopper penguins[J].Am Vet Med Assoc,1985,187:1219-1220.
[6]FarmerⅢJ J,Mcwhorter A C,Genus X.Bergey's Mannual of Systematic Bacteriology[M].Baltimore:The Williams and WilkinsCo,1984:486-491.
[7]Tan Y P,Zheng J,Tung S L,et al.Role of typeⅢsecretion in Edwardsiella tarda virulence[J].Microbiology,2005,151:2301-2313.
[8]王斌,孙岑,范薇,等.养殖大菱鲆出血性败血症病原菌致病性研究及鉴定[J].大连水产学院学报,2006,21(2):100-104.
[9]Hacker J,Blum-Oehler G,Mühldorfer I,et al.Pathogenicity islands of virulent bacteria:structure,function and impact on microbial evolution[J].Mol Microbiol,1997,23:1089-1097.
[10]Zheng J,Tung S L,Leung K Y.Regulation of a typeⅢand a putative secretion system(EVP)in Edwardsiella tarda by esrC is under the control of a two-component system esrA-esrB[J].Infection and Immunity,2005,73:4127-4137.
[11]Zheng J,Li N,Tan Y P,et al.escC is a chaperone for the Edwardsiella tarda typeⅢ secretion system putative translocon components eseB and eseD[J].Microbiology,2007,153:1953-1962.
[12]江云,李寿崧,王寿昆.致病性迟钝爱德华氏菌毒力基因的PCR检测[J].中国食品学报,2008,8(4):123-129.
[13]Putanae S,Srinivasa R,Tit M L,et al.Functional genomics approach to the identification of virulence genes involved in Edwardsiella tarda pathogenesis[J].Infection and Immunity,2003(3): 1343-1351.
[14]Hensel M,Shea J E,Waterman S R,et al.Genes encoding putative effector proteins of the typeⅢ secretion system of Salmonella pathogenicity island 2 are required for bacterial virulence and proliferation in macrophages[J].Mol Microbiol,1998,30(1):163-174.
[15]Ochman H,Soncini F C,Solomon F,et al.Identification of a pathogenicity island required for Salmonella survival in host cells[J]. Proc Natl Acad Sci USA,1996,93:7800-7804.
[16]Uchiya K,Barbieri M A,Funato K,et al.A Salmonella virulence protein that inhibits cellular trafficking[J].EMBO J,1999,18: 3924-3933.
[17]常亚青,封妮莎,王轶南,等.虾夷马粪海胆致病菌强壮弧菌的PCR检测方法[J].大连海洋大学学报,2012,27(4):289-293.
[18]张凤萍,王印庚,李胜忠,等.应用PCR方法检测刺参腐皮综合征病原——灿烂弧菌[J].海洋水产研究,2008,29(5):101-107.
[19]韩一凡,莫照兰,李杰,等.溶藻弧菌的PCR快速检测方法[J].中国海洋大学学报,2009,39(6):1237-1240.
Cloning of typeⅢ secretion system genes and detection of bacterium Edwardsiella tarda by multiplex PCR
WANG Bin,ZHAO Feng-mei,LI Jun-wei,SHEN Hao,WANG Hui,HU Liang
(Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province,Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
Six genes,esaC,eseB,eseC,eseD,esrA and esrB,were amplified in typeⅢsecretion system of bacterium Edwardsiella tarda L-49231 strain isolated from infected turbot Scophthalmus maximus by PCR.Then all PCR products were cloned into vector PMD19-T and the positive clones were chosen to be sequenced.The detection method of three effector protein genes of eseB,eseC and eseD were established via the optimization of reaction conditions by multiplex PCR.The multiplex PCR detection method was then applied to determine effector protein genes of different Edwardsiella tarda strains such as L-49231,GhAn080310,GhAn080313 and GhAn080314,including Salmonella enterica,Escherichia coli and Enterobacter sp.The results showed that esaC,eseB,eseC,eseD,esrA and esrB genes were all detected in L-49231 strain,with 837,184,934,445,464 and 458 bp in length,respectively.The homology with Edwardsiella tarda strain PPD130/91 from GenBank were found up to 99%,97%, 99%,99%,99%and 98%,respectively.The optimum multi-PCR was conducted under the conditions of annealing temperature 54℃,primer concentrations(μmol/L)ratio of eseB∶eseC∶eseD=5∶10∶2 and Mg2+concentration of 1.5 mmol/L.The eseB,eseC and eseD genes were all detected in Edwardsiella tarda strains L-49231, while only eseB and eseC genes were detected in Edwardsiella tarda strains GhAn080310,GhAn080313 and GhAn080314.But eseB,eseC and eseD genes were not detected in Salmonella enterica,Escherichia coli and Enterobacter sp.The findingds indicate that our approach of multi-PCR allows specific detection of strains with the typeⅢsecretion system.
Edwardsiella tarda;typeⅢsecretion system;clone;multi-PCR
S947.9
A
2012-11-08
辽宁省教育厅科学技术研究重点实验室项目 (2009S026)
王斌 (1962-),女,教授。E-mail:wangbin@dlou.edu.cn
2095-1388(2013)03-0217-07
