仿刺参体壁创伤修复消减文库的构建与分析
2013-07-12秦艳杰李霞张慧敏王雪
秦艳杰,李霞,张慧敏,王雪
(大连海洋大学农业部北方海水增养殖重点实验室辽宁省海洋生物资源与生境恢复重点实验室,辽宁大连116023)
仿刺参体壁创伤修复消减文库的构建与分析
秦艳杰,李霞,张慧敏,王雪
(大连海洋大学农业部北方海水增养殖重点实验室辽宁省海洋生物资源与生境恢复重点实验室,辽宁大连116023)
应用抑制性消减杂交技术 (SSH),构建了仿刺参Apostichopus japonicus(体质量为65~90 g)正常体壁及创伤修复 (24、48、72、96、120 h后)体壁的消减cDNA文库,利用PCR和斑点杂交技术对文库进行筛选,随机挑取的768个克隆中发现292个阳性克隆,对其中信号强度较强的224个阳性克隆进行测序,得到208个有效EST序列。经BlastX工具对获得的EST与GenBank数据库进行比对分析,结果有171个EST序列与数据库中的基因同源 (e≤0.001,相似性>40%),其中153个为未知基因,18个为已知功能或已命名基因,包括在创伤及修复的体壁中上调表达的β微管蛋白、微管蛋白α-1链、肌动蛋白、肌动蛋白ike 7B类似物、细胞色素c氧化酶亚基Ⅰ、tRNA假尿苷合成酶A、GTP酶、细胞分裂周期2类似蛋白、有丝分裂原活化蛋白激酶、homeobox蛋白、延伸因子1A、核糖体蛋白L30、核糖体蛋白L17、60S酸性核糖体蛋白P0、26S蛋白酶调节亚基、泛素特异性肽酶24、大肠癌血清抗原3、清道夫受体蛋白12等。本研究结果可为探讨刺参体壁再生过程和分子机理,以及筛选刺参体壁创伤修复过程中相关功能基因的研究提供基础依据。
刺参;体壁;抑制性消减杂交;cDNA文库;创伤和修复
再生作为发育生物学领域重要的研究内容,越来越受到科研工作者的重视。关于刺参体壁再生的研究,最早集中在对刺参再生体壁的形态学描述及常规组织学研究[1-4],近年来逐渐开始进行分子机理的探讨,如陈秋实等[5]通过DDRT-PCR方法发现刺参表皮再生过程中CD151基因大量表达,说明该基因在刺参的组织损伤修复反应过程中扮演着重要角色。但刺参的再生过程涉及复杂的基因网络调控,目前零散的研究报道对于探讨刺参体壁再生的分子机理还远远不够。
抑制性消减杂交技术(Suppression subtractive hybridization,SSH)是一种寻找差异表达基因十分有效的方法[6-7],广泛应用于分离各种生物在不同生理状态下表达出现差异的基因。用该方法克隆表达出现差异的基因,假阳性比率低,同时对低丰度基因具有富集作用,而低丰度基因往往在生命活动中起着重要作用[8-10]。本研究中,作者以仿刺参Apostichopus japonicus为试验对象,首次构建了仿刺参体壁创伤修复的正反消减文库,随机挑取部分阳性克隆进行测序,通过BlastX对这些EST序列进行功能比对分析,旨在为研究刺参体壁创伤和修复的调控机理、作用方式以及分离与再生相关的基因奠定基础。
1 材料与方法
1.1 材料
试验仿刺参为1~2龄个体,体质量为65~90 g,体长 (麻醉状态下)为10~14 cm。于2010年4月取自大连市龙王塘海域,为自然生长的个体。
1.2 方法
1.2.1 试验仿刺参的处理及创伤试验 试验开始前,将随机分组的仿刺参暂养于农业部北方海水增养殖重点实验室,于10℃下恢复7 d,然后逐渐升温,饲养用水为沙滤海水,盐度为30~32,每天定时半量换水,投喂人工配合饲料。
挑选个体适中、生长状况良好的25头仿刺参用于正式试验。将仿刺参于冰上麻醉30 min,用手术刀割取体壁约1 cm2的组织 (50~100 mg),每头仿刺参割取3~4块组织,混合后作为正常对照组样品,放入冻存管中,迅速投入液氮中冷冻备用。手术过的仿刺参分为5组,每组5头,放回水槽中饲养,分别饲养24、48、72、96、120 h后取创伤处的体壁组织 (方法同上),混合后作为创伤修复试验组样品,放入冻存管中,液氮中冷冻备用。
1.2.2 RNA的提取及消减文库的构建 采用优化过的TRIzol一步法进行总RNA的抽提。沉淀溶于适量的DEPC水中,用紫外分光光度计检测RNA的浓度和纯度。
将创伤修复组和正常仿刺参组体壁样品的总RNA通过Super SMARTTMPCR cDNA Synthesis Kit (Clontech公司)反转录成cDNA,具体步骤参照试剂盒说明书进行。消减文库构建的具体步骤参照PCR-Select cDNA Subtraction试剂盒 (Clontech公司)说明书进行。构建消减文库时,正向文库以创伤修复体壁为试验方 (tester),以正常体壁为消减方 (driver);负向文库以正常体壁为试验方,以创伤修复体壁为消减方。其中mRNA逆转录合成双链cDNA,然后用RsaI充分酶切1.5 h后完成。经接头连接后进行抑制性消减杂交。两次差减PCR扩增产物经QIAquick PCR Purification试剂盒纯化后连接pMD-18-T载体,转化至感受态宿主菌 (DH-5α)中,将菌液均匀涂布于含 Apr-IPTG/x-gal的LB固体培养基上,于37℃下过夜。每个文库随机挑取384个白斑克隆,接种于LB液体培养基中,于37℃下过夜。取1 μL菌液,分别利用T载体通用引物 (RV-M、M13-47)和巢式引物 (nested PCR primer 1、nested PCR primer 2R),对所建立的正反向消减文库进行阳性克隆的检测,反应参数与第2次消减PCR相同。扩增产物用20 g/L琼脂糖凝胶电泳检测,有插入者加甘油保种于超低温冰箱 (-80℃)中。
1.2.3 cDNA测序及EST序列分析 随机挑取阳性克隆,使用MegaBACE 1000型自动测序仪测序得到cDNA序列。测序结果在GenBank(http:// www.ncbi.nlm.nih.gov/blast)中进行同源性比对,用BlastX程序对消减文库的EST序列数据进行比对和鉴定分析。
2 结果与分析
2.1 高质量仿刺参体壁总RNA的提取
由于仿刺参体壁组织比较特殊,不易于直接匀浆破碎,因此,要经液氮速冻研磨并匀浆后,再进行RNA的提取。获得的总RNA经紫外分光光度计检测,OD260nm/OD280nm值均在1.9~2.1,说明RNA质量较高,没有DNA、蛋白或酚的污染。琼脂糖凝胶电泳结果表明,28S rRNA和18S rRNA两条谱带清晰,二者亮度比达到(2.0~2.5)∶1以上,条带整齐,说明RNA完整性较好、纯度较高,能够满足反转录及后续试验的需要 (图1)。

图1 仿刺参体壁总RNA的提取结果Fig.1 Total RNA extracted from body walls of the sea cucumber Apostichopus japonicus
2.2 消减杂交及差异片段阳性克隆的PCR检测
经10 g/L琼脂糖凝胶电泳分析,cDNA为大于250 bp的片状条带,酶切后cDNA为100~2 000 bp的条带,说明cDNA酶切较完全 (图2)。对随机挑选的阳性克隆提取质粒后进行PCR检测,结果显示片段为300~1 000 bp(图3),且文库中片段插入率达97%以上。

图2 对照组和创伤修复组体壁cDNA及酶切后电泳结果Fig.2 The electrophoretic analysis of cDNA in body walls of the sea cucumber A.japonicus in control and recovery groups
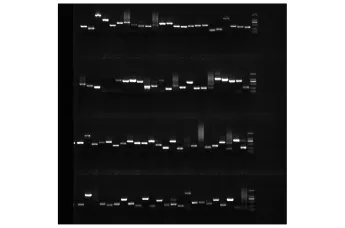
图3 消减文库部分克隆菌落的PCR电泳图Fig.3 Electrophoresis photograph of colony PCR of some clones in subtracted library
2.3 斑点杂交
通过斑点杂交,分别对正向库和反向库的克隆进行鉴定。即分别将正、反向消减cDNA群体作为探针,与通过菌落PCR扩增得到的插入片段杂交,最终去除假阳性克隆 (图4)。与正向消减cDNA探针和反向消减cDNA探针杂交的克隆共计292个阳性克隆 (e≤0.001,相似性>40%),与两个探针杂交信号强弱相近的克隆可视为背景,而与两者均无杂交信号的克隆可能代表了极低丰度的cDNA。

图4 斑点杂交对正、反向库阳性克隆的检测Fig.4 Dot blotting analysis of the forward and reverse clones
2.4 消减文库EST的比对分析
筛选出的292个阳性克隆中,有105个阳性克隆在对照组中上调表达,187个阳性克隆在创伤修复组中上调表达。从中挑选信号强度较强的224个片段进行测序,将得到的EST片段进行Blast同源搜索。共得到208个有效EST序列,其中171个 EST序列与数据库中基因同源 (e≤0.001,相似性>40%),其中153个为未知基因,18个为已知功能或已命名基因 (20个克隆)。
153个未知功能的 EST中,有 107个 (占69.93%)与海葵Nematostella vectensis同源,37个(占24.18%)与果蝇Drosophila willistoni同源,3个 (占1.96%)与文昌鱼Branchiostoma floridae同源,2个 (占1.3%)与猩猩Pongo abelii同源,与家鼠Mus musculus、海胆Strongylocentrotus purpuratus、线虫Caenorhabditis briggsae和人体虱Pediculus humanus corporis同源的EST各1个 (图5)。18个与已知功能同源的基因见表1。

图5 与仿刺参未知功能EST序列相似的物种分布图Fig.5 The organism identity predicted by unknown function EST sequences in sea cucumber A.japonicus
3 讨论
棘皮动物门中的大多数动物具有再生的能力,如海星、海胆等。研究刺参的再生机制和模式,将有助于建立棘皮动物门乃至水生无脊椎动物的再生模型。再生相关基因及因子的获得可以丰富动物的再生理论研究。
寻找与刺参再生相关的系列基因,国外普遍采用建立cDNA文库的方法,经比对发现,9个Hox-型再生基因[11]、血清淀粉样A(SAA)蛋白的同源蛋白[12]以及室管膜相关基因 (EpenHg)[13]在海参Holothuria glaberrima肠再生过程中起作用,推测这些基因可能参与海参肠形态发生、伤口愈合以及肠内神经系统的再生。国内Zheng等[14]在仿刺参肠再生领域也开展了类似的研究工作。而刺参体壁再生的分子机理研究刚刚开展,仅发现CD151基因在刺参体壁再生过程中大量表达[5]。大规模筛选刺参体壁再生相关基因的研究工作尚未开展,徐赛涛等[15]、周遵春等[16]分别构建了仿刺参体壁的cDNA文库,为刺参体壁再生的研究提供了基础依据。

表1 消减文库EST比对分析结果(e≤0.001,相似性>40%)Tab.1 Classification of the EST(e≤0.001,Identity>40%)in SSH
SSH技术在水产动物中的应用逐年增多,如采用此技术在银鲫Carassius auratus中克隆出肌酸激酶等一系列基因[17-19],在鲤 Cyprinus carpio[20-21]、虹鳟Oncorhynchus myiss[22-23]中克隆出与免疫调控相关的基因。在水产无脊椎动物对虾Fenneropenaeus chinensis和皱纹盘鲍Haliotis discus hannai中该技术也得到了应用[24-25]。本研究中将这一技术应用于仿刺参体壁与创伤修复相关的EST筛选。测序后比对发现,刺参肌动蛋白 (actin)、细胞色素c氧化酶亚基Ⅰ部分序列在数据库中已有注册,二者在创伤修复过程中的表达量分别呈现上升和下降的趋势,说明创伤修复过程中由肌动蛋白参与的细胞分裂、迁移等生理活动增强[26],而细胞色素c氧化酶亚基Ⅰ表达量下降可能预示着创伤修复过程中细胞正常生命活动及代谢等受到一定影响[27]。GTP酶、细胞分裂周期2类似蛋白、核糖体蛋白L17和清道夫受体蛋白12四个EST序列与相近物种紫球海胆Strongylocentrotus purpuratus的同源性较高,进一步研究这些基因的克隆及表达分析,对揭示棘皮动物再生的分子机理具有重要意义。与高等哺乳动物同源的基因包括有丝分裂原活化蛋白激酶、泛素特异性肽酶24和大肠癌血清抗原3,三者均在仿刺参创伤修复体壁中上调表达。homeobox蛋白作为重要的转录因子,在海参 Holothuria glaberrima肠道再生中也曾被发现[11],说明其在生物发育、生长等过程中起着重要作用。有研究表明,翻译延伸因子EF1α、核糖体蛋白、假尿嘧啶核苷酸合成酶A、细胞分裂周期蛋白2以及大肠癌血清抗原3与人类肿瘤的发生、发展等密切相关[28-31]。
除homeobox蛋白外,本研究中发现的其他17个同源基因均是在仿刺参中首次发现,其中,细胞分裂周期基因2是细胞分裂周期基因的一种,该基因编码丝氨酸/苏氨酸蛋白激酶,该酶的活化是细胞分裂的增殖信号,具有启动DNA复制和诱发有丝分裂的双重作用,在细胞周期调节中起重要作用[32]。有丝分裂原活化蛋白激酶信号转导通路参与细胞增殖、分化、凋亡等多种细胞行为的调控,核糖体蛋白 (L17、L30)和60S酸性核糖体蛋白P0在蛋白质翻译延伸过程中起着重要作用。已有研究证实,真核生物的酸性核糖体磷酸化蛋白还与细胞凋亡、肿瘤的发生、侵袭以及免疫性疾病有关,它与延伸因子共同作用可参与蛋白合成延伸阶段的调节[33]。26S蛋白酶调节亚基、泛素特异性肽酶24与蛋白质的特异性降解有关[34]。GTP酶属于Rab家族成员,该酶主要调控细胞内囊泡转运、内吞以及分泌过程中不同细胞器之间蛋白质的运输,即调节蛋白质的分泌[35]。大肠癌血清抗原、假尿苷常常被用作哺乳动物肿瘤的标志物。细胞色素c氧化酶是线粒体呼吸链的组成部分之一,在细胞的能量代谢与氧化磷酸化过程中发挥重要作用,在动物体中主要参与维持正常生理功能,并与炎症、细胞有丝分裂和特异性信号传导有关[36]。肌动蛋白和微管蛋白主要构成细胞骨架成分,对细胞分裂、细胞中物质的运输起重要作用。清道夫受体蛋白是位于巨噬细胞表面的一种糖蛋白,其表达量增多可能预示着机体巨噬细胞增多或功能增强,从而与刺参损伤、免疫相关[37]。
综合来看,本研究中所发现的功能基因涉及细胞形态的维持、细胞内物质的运输、细胞迁移、分裂增殖、基因转录、mRNA翻译、分化和凋亡等各种细胞生命活动的调节。这些基因有助于揭示与仿刺参再生相关的基因,也将揭示仿刺参体壁再生过程中代谢、免疫等相关基因的参与情况,为全面研究仿刺参的再生过程和相关分子机理奠定基础。除此之外,由于刺参分类地位的特殊性,还存在大量EST与未知功能蛋白同源,随着水产无脊椎动物生物信息学数据库的逐步丰富,这些数据将为深入挖掘刺参体壁再生的分子机理提供良好的平台,也将为再生理论及人类医学提供重要的参考。
[1]聂竹兰,李霞,辛涛.仿刺参体壁的组织学和组织化学[J].大连水产学院学报,2007,22(3):184-187.
[2]李霞,聂竹兰,魏杰.仿刺参体壁表皮再生组织学和超微结构观察[J].中国水产科学,2007,14(7):1-6.
[3]李霞,周海燕,秦艳杰,等.仿刺参体壁的显微和亚显微结构[J].大连海洋大学学报,2010,25(4):289-292.
[4]李霞,周海燕,秦艳杰,等.仿刺参体壁再生形态学和组织学的研究[J].大连海洋大学学报,2011,26(4):287-290.
[5]陈秋实,李霞,段晶晶,等.利用差异显示法研究刺参表皮再生相关基因[J].生物技术通报,2008(6):124-128.
[6]Diatchenko L,Lau Y F,Campbell A P,et al.Suppression subtractive hybridization:a method for generating differentially regulated or tissue specific cDNA probes and libraries[J].Proc Natl Acad Sci USA,1996,93(12):6025-6030.
[7]Diatchenko L,Lukyanow S,Lau Y F,et al.Suppression subtractive hybrization:a versatile method for identifying differentially expressed genes[J].Methods Enzymol,1999,303:349-380.
[8]Von Stein O D,Thies W G,Hofmann M.A high through put screening for rarely transcribed differentially expressed genes[J]. Nucleic Acids Res,1997,25(13):2598-2602.
[9]Kuang W W,Thompson D A,Hoch R V,et al.Differential screening and suppression subtractive hybridization identified genes differentially expressed in an estrogen receptor-positive breast carcinoma cell line[J].Nucleic Acids Res,1998,26(4):1116-1123.
[10]Gurskaya N G,Diatehenko L,Chenchik A,et al.Equalizing cDNA subtraction based on selective suppression of polymerase chain reaction:cloning of Jurkat cell transcripts induced by phytohemaglutinin and phorbol 12-myristate 13-acetate[J].Anal Biochem, 1996,240:90-97.
[11]Méndez A T,Roig-López J L,Santiago C,et al.Identification of hox gene sequences in the sea cucumber Holothuria glaberrima Selenka(Holothuridea:Echinodermata)[J].Mar Biotechnol, 2000,2(3):231-240.
[12]Santiago P,Roig-Lopez J L,Santiago C,et al.Serum amyloid A protein in an echinoderm:its primary structure and expression during intestinal regeneration in the sea cucumber Holothuria glaberrima[J].J Exp Zool,2000,288(4):335-344.
[13]Suarez-Castillo E C,Medina-Ortiz W E,Roig-Lopez J L,et al. Ependymin,a gene involved in regeneration and neuroplasticity in vertebrates,is overexpressed during regeneration in the echinoderm Holothuria glaberrima[J].Gene,2004,334:133-143.
[14]Zheng F X,Sun X Q,Fang B H,et al.Comparative analysis of genes expressed in regenerating intestine and non-eviscerated intestine of Apostichopus japonicus Selenka(Aspidochirotida:Stichopodidae)and cloning of ependymin gene[J].Hydrobiologia,2006, 571:109-122.
[15]徐赛涛,丛丽娜,朱蓓薇.仿刺参cDNA文库构建及序列分析[J].中国水产科学,2007,14(S1):7-11.
[16]周遵春,赫崇波,杨爱馥,等.仿刺参体壁、肠和呼吸树全长cDNA文库的构建及部分ESTs初步分析[J].水产科学,2009, 28(2):55-58.
[17]石耀华,刘军,夏建红,等.银鲫肌酸激酶M32CK cDNA的克隆及其表达特征[J].动物学报,2003,49(5):637-645.
[18]刘军,石耀华,尹隽,等.雌核发育银鲫原肠期胚胎和尾芽期胚胎差异表达基因的呈现[J].遗传学报,2005,32(3):253-263.
[19]Wen J J,Xie J,Gui J.cDNA cloning and caracterization of a novel SNX gene differentially expressed in previtlogenic oocytes of gibel carp[J].Comp Biochem Physiol,2003,136(3):451-461.
[20]Zhang Y B,Shi Y H,Gui J F.Construction of antiviral subtractive cDNA library of cultured fish cells[J].Acta Hydrobiol Sinica, 2003,27(1):113-118.
[21]Fujiki K,Nakao M,Dixon B.Molecular cloning and characterizatation of a carp Cyprinus carpio cytokine-like cDNA that shares sequence similarity with IL26 subfamily cytokines CNTF,OSM and LIF[J].Dev Comp Immunol,2003,27:127-136.
[22]Songrador V A,Lennington J B,Smith T J.Molecular cloning ofan IL-8.like CXC chemokine and tissue factor in rainbow trout Oncorhynchus mykiss by use of suppression subtractive hybridization[J].Cytokine,2002,17(2):66-70.
[23]Liu L,Fujiki K,Dixon B,et al.Cloning of a novel rainbow trout Oncorhynchus myiss CC chemokine with a fractalkine-like stalk and a TNF decoy receptor using cDNA fragments containing Auich elements[J].Cytokine,2002,17(2):71-81.
[24]刘晶,张文兵,麦康森,等.皱纹盘鲍外套膜耐维生素E缺乏消减cDNA文库的构建[J].中国水产科学,2007,14(3):383-389.
[25]王兵,桂朗,李富花,等.抑制性消减杂交技术结合cDNA MICROARRAY技术在中国明对虾WSSV感染后差异表达基因研究上的应用[J].海洋与湖沼,2008,39(5):455-461.
[26]朱筱娟,曾宪录,宋朝霞,等.细胞核内肌动蛋白及其功能研究进展[J].科学通报,2004,49(11):1031-1035.
[27]李连之,黄仲贤.细胞色素c氧化酶研究新进展[J].无机化学学报,2001(6):761-774.
[28]符雪松,白文元.假尿嘧啶核苷与恶性肿瘤[J].世界华人消化杂志,2003,11(1):72-73.
[29]陈长恒.Cdc2基因与细胞周期调控[J].中国实用医药杂志, 2007(13):105-107.
[30]周冰,曹诚,刘传暄.翻译延伸因子1A的研究进展[J].生物技术通讯,2007,18(2):281-286.
[31]田媛,张俊平.核糖体蛋白质的新功能及其与相关疾病的关系[J].生命的化学,2011,31(4):16-19.
[32]Nozoe T,Baba H,Baba H,et al.Relationship between intracellular localization of p34cdc2 protein and differentiation of esophageal squamous cell carcinoma[J].J Cancer Res Clin Oncol,2005,131: 179-183.
[33]吴海燕,唐圣松.酸性核糖体磷酸化蛋白P(0-2)的研究进展[J].南华大学学报:医学版,2006,34(5):634-637.
[34]Ferrell K,Wilkinson G R M,Dubiel W,et al.Regulatory subunit interactions of the 26 Sproteasome,a complex problem[J].Trends in Biochemical Science,2000,25:83-89.
[35]石佰丽,吕梦燕,赵秋雁.小GTPase蛋白家族的研究进展[J].安徽农业科学,2012,40(5):2566-2569,2573.
[36]谢燕,江海洪,龚茜芬,等.微波对大鼠脑线粒体细胞色素c氧化酶亚基转录水平的影响[J].第三军医大学学报,2003,25 (11):987-989.
[37]Krieger M,Herz J.Structures and functions of multiligand lipoprotein receptor:macrophage scavenger receptors and LDL receptor 2 related protein(LRP)[J].Annu Rev Biochem,1994,63:601-637.
Construction and analysis of subtractive cDNA library of recovery body wall in sea cucumber Apostichopus japonicus
QIN Yan-jie,LI Xia,ZHANG Hui-min,WANG Xue
(Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province,Dalian Ocean University,Dalian 116023,China)
A subtracted cDNA library of sea cucumber Apostichopus japonicus(body weight 65-90 g)was constructed by suppression subtractive hybridization technology(SSH)to screen EST associated with recovery body wall. The cDNA library of the test group has been constructed by the mRNA of the body walls 24,48,72,96 and 120 h after the operation,and those with no operation as the control group.Differential EST from the subtracted cDNA library have been identified by both PCR technology and dot blot hybridization.Two hundred and ninety-two positive clones were observed from total 768 clones,and 224 positive ones were sequenced.Two hundred and eight EST were found and analyzed by BlastX tool in GenBank database,in which 171 EST were homologous with sequences in the database,and 18 were high homologous with known function genes including:beta-tubulin,tubulin alpha-1 chain,actin,tRNA pseudouridine synthase A,GTPase,cell division cycle 2-like,Mitogen-activated protein kinase,homeobox protein,elongation factor 1A,ribosomal protein L30 and L17,60S acidic ribosomal protein P0,26S protease regulatory subunit,ubiquitin specific peptidase 24,serologically defined colon cancer antigen 3 and scavenger receptor cysteine-rich protein type 12 which upregulated in wounded and recovery body walls of the sea cucumber.In this study,the subtracted cDNA library was successfully constructed by SSH and a number of EST related to recovery body wall were identified,which laid a foundation for the molecular basis and the process of regeneration of body wall in the sea cucumber.
Apostichopus japonicus;body wall;suppression subtractive hybridization;cDNA library;wound and recovery
Q785;S917
A
2012-09-01
辽宁省教育厅创新团队项目 (2007T015);辽宁省教育厅实验室专项 (2008S064)
秦艳杰 (1977-),女,副教授。E-mail:qinyanjie@dlou.edu.cn
李霞 (1961-),女,教授。E-mail:lx@dlou.edu.cn
2095-1388(2013)03-0224-06
