伏立康唑治疗侵袭性真菌感染有效性及安全性的Meta 分析
2013-07-11李方方徐燕丽张秀群张学忠
李方方,徐燕丽 ,张秀群,张学忠
侵袭性真菌感染是免疫缺陷、抵抗力较差的患者的主要致死、致病原因。念珠菌属和曲霉菌属是两种主要致病菌。虽然氟康唑已经广泛应用于白色念珠菌感染患者,两性霉素B 一直是念珠菌感染、曲霉菌感染的主要治疗方案。然而,近年来,随着随机对照试验相继显示广谱唑类药物(伊曲康唑、伏立康唑、泊沙康唑)、棘白菌素类药物(阿尼芬净、卡泊芬净、米卡芬净)与两性霉素B、氟康唑具有相似的疗效,这些药物开始广泛用于侵袭性真菌感染患者[1-6]。为进一步客观评价伏立康唑在治疗侵袭性真菌感染中的有效性及安全性,本研究采用系统评价方法评价伏立康唑治疗侵袭性真菌感染的随机对照研究,并结合临床,对其利弊进行全面评价,以期为临床应用提供可靠依据。
1 资料与方法
1.1 纳入标准 ①研究类型:随机对照试验,无论是否采用盲法。②研究对象:确诊或拟诊侵袭性真菌感染患者,无肝肾功能不全等。③干预措施:伏立康唑vs. 两性霉素B;伏立康唑vs. 伊曲康唑;伏立康唑vs. 米卡芬净。④结局指标:完全及部分反应百分率;各种不良反应发生百分率。
1.2 检索策略 以“伏立康唑、真菌感染、真菌血症、念珠菌病、念珠菌感染、曲霉菌病、曲菌病、曲霉病、曲霉菌感染”检索中国期刊全文数据库(CNKI,1994-2011.12)、中国生物医学文献数据库(CBM,1978-2011.12)、中文科技期刊数据库(VIP,1989-2011.12)。以“voriconazole、fungemia、aspergillosis、candidiasis”等检索PubMed(1966-2011.12)、Cochrane Library (-2011.12)、Embase(1974-2011.12)。随机对照试验检索采用Cochrane 系统评价手册检索策略,其他检索采用主题词与自由词相结合的方式,所有检索策略通过多次预检索后确定,并用Google Scholar、读秀学术搜索等搜索引擎在互联网上查找相关文献,追查已纳入文献的参考文献。
1.3 资料提取和质量评价 由2 位研究者分别阅读所获文献题目和摘要,对可能符合纳入标准的试验阅读全文,以确定是否符合纳入标准。两位研究者交叉核对纳入试验的结果,对有分歧而难以确定的试验通过讨论或由第3 位研究者决定是否纳入。缺乏的资料通过电话或信件与作者联系予以补充。按照预先制定的资料提取表提取以下内容:①一般资料:包括题目、作者姓名、发表日期和文献来源;②研究特征:包括研究对象的一般情况、干预措施等;③测量指标等。
根据Cochrane 系统评价手册推荐的方法进行方法学质量评价[7]:①采用何种随机分配方法,方法是否正确;②是否进行分配隐藏,方法是否正确;③是否采用盲法,对哪些人实施了盲法;④有无数据缺失,若有失访或退出时,是否采用意向性(ITT)分析法;⑤是否存在选择性报告研究结果;⑥是否存在其他方面偏倚。如果6 条质量评价标准均完全满足,则该研究存在偏倚的可能性最小;如果其中任何一条或多条质量评价标准仅为部分满足或不清楚,则该研究存在中等度偏倚的可能性;如果其中任何一条或多条质量评价标准完全不满足,则该研究存在高度偏倚的可能性。质量评价由两位研究者独立进行并交叉核对,如遇分歧通过讨论或请第3 位研究者协助解决。
1.4 统计分析 应用RevMan 5.0 软件。计数资料采用相对危险度(RR)为疗效分析统计量,计量资料采用均数差(MD)为疗效分析统计量,各效应量均以95% CI 表示。各纳入研究结果间的异质性采用χ2检验。若纳入研究具有足够的一致性(P >0.05,I2<50%)时,采用固定效应模型进行分析;若纳入研究存在异质性时,分析其异质性来源,对可能导致异质性的因素进行亚组分析。若各研究间存在统计学异质性而无临床异质性或差异无临床意义时,采用随机效应模型。如各组间异质性过大,则采用描述性分析。必要时采用敏感性分析检验结果的稳定性。
2 结果
2.1 文献检索结果 初检到相关文献4 498 篇。根据纳入标准,阅读文题和摘要,排除非随机对照试验、重复发表、非临床研究文献,初筛得到28 篇文献,进一步阅读全文排除不符合纳入标准的文献,最终纳入7 项研究[8-14],共676 例患者。
2.2 纳入研究的一般情况和方法学质量评价见表1、表2。

表1 纳入研究的一般情况(例)
2.3 Meta 分析结果 3 项研究[8,10,14]比较了伏立康唑与两性霉素B 的疗效,在治疗成功率方面存在统计学异质性(P =0.000 8,I2=86%)。考虑3项研究分别为两性霉素B 脂制剂、两性霉素B 胆酸盐制剂、传统两性霉素B,可能导致研究间存在差异。将三项研究分亚组进行分析,研究表明,伏立康唑组治疗成功率高于两性霉素B 胆酸盐制剂,OR=2.42,95% CI[1.48,3.96],P =0.000 4;伏立康唑治疗成功率略低于两性霉素B 脂制剂,但差异无统计学意义,OR=0.87,95% CI[0.64,1.17],P=0.35;伏立康唑治疗成功率略高于两性霉素B 组,但差异无统计学意义,OR =1.41,95%CI[0.27,7.28],P=0.68。见图1。Walsh 等[8]对两组的不良反应—输液相关不良反应、肝肾毒性、视觉异常进行了比较,表明伏立康唑组各不良反应发生率均低于两性霉素B 脂质体组(P <0.05)。Herbrecht 等[10]研究表明,伏立康唑组肾毒性低于两性霉素B 去氧胆酸盐制剂(P <0.01),而两组肝毒性、消化道反应发生率比较,差异无统计学意义(P =0.54、0.37)。贾宗岭等[14]研究显示,伏立康唑组未见明显不良反应,而两性霉素B 组的不良反应均可耐受(未提供相关数据)。
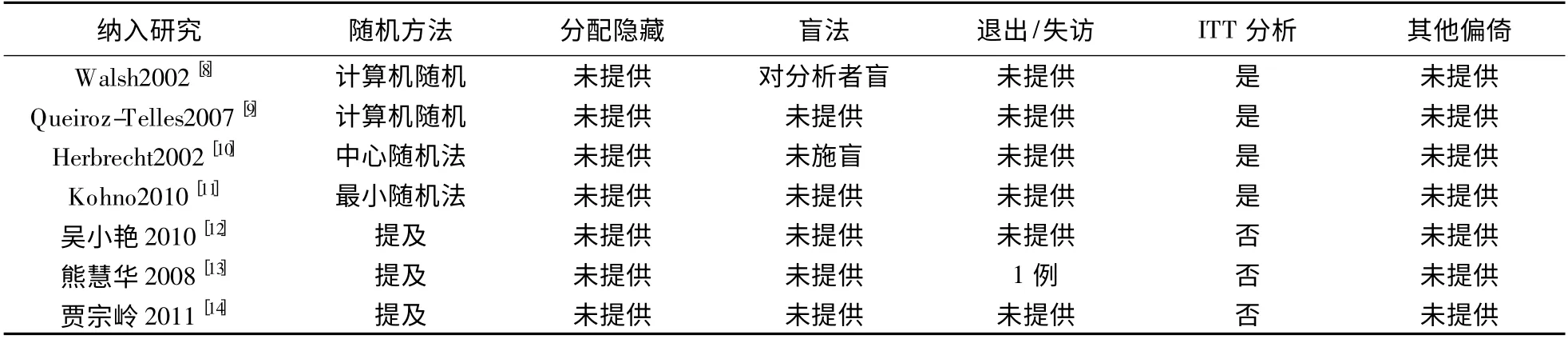
表2 纳入研究的方法学质量评价

图1 伏立康唑与各对照组治疗有效性(治疗成功率)比较
2 项研究[9,13]比较了伏立康唑与伊曲康唑的疗效,在治疗成功率方面无统计学异质性(P =0.53,I2=0%),采用固定效应模式行Meta 分析,研究表明,两组治疗成功率比较,差异无统计学意义,OR=0.81,95% CI[0.25,2.63],P =0.73(见图1)。在不良反应方面无统计学异质性(P =0.88,I2=0%),采用固定效应模式行Meta 分析。伏立康唑与伊曲康唑的不良反应发生率比较,差异无统计学意义,OR=1.5,95% CI[0.48,4.68],P=0.49(见图2)。熊慧华等[13]的研究中还将两组的成本-效果比进行了比较,表明伏立康唑组的成本-效果比低于伊曲康唑组(119.8 vs .190.7)。
2 项研究[11-12]比较了伏立康唑与米卡芬净的疗效,在治疗成功率方面无统计学异质性(P =0.22,I2=33%),采用固定随机模式行Meta 分析,伏立康唑治疗成功率略高于米卡芬净组,但差异无统计学意义,OR =1.74,95% CI[0.89,3.41],P=0.11(见图1)。在不良反应发生率方面无统计学异质性(P =0.33,I2=0%),采用固定效应模式行Meta 分析,伏立康唑组的不良反应发生率高于米卡芬净组,差异有统计学意义,OR =3.74,95% CI[1.76,7.96],P=0.000 6(见图2)。吴小艳等[12]对两组进行了经济学比较,表明伏立康唑组的成本效应高于米卡芬净组(240.8 vs.149.06)。

图2 伏立康唑与各对照组治疗安全性(不良反应发生率)比较
3 讨论
本系统评价共纳入7 项研究[8-14],其中伏立康唑与两性霉素B 比较3 项[8,10,14]、与伊曲康唑比较2 项[9,13]、与米卡芬净比较2 项[11-12](主要指标均为治疗成功率);其中4 项[8-11]为多中心RCT,3项[12-14]为单中心RCT;11 项研究中,只有1 项[14]未提供不良反应相关数据;对结局指标进行了明确定义,各研究间相同指标的定义不尽相同,因此,研究结果不排除有偏倚可能。
伏立康唑于2002 年被美国食品和药物管理局(FDA)批准上市[15]。目前剂型有口服和注射剂,口服生物利用度高,主要对念珠菌属(包括光滑念珠菌及克柔念珠菌)、新生隐球菌、曲霉属、镰刀霉属和荚膜组织胞浆菌等致病真菌均有较好抗菌活性,对曲霉菌疗效可达到两性霉素B 水平,是各国指南中治疗肺曲霉菌病的首选药物。对接合菌类(如毛霉菌等)亦无抗菌活性。不良反应为肝功能损害和视觉改变(约占1/3)。两性霉素B 为传统的广谱抗真菌药物,具有很强的抗菌效果,但其严重的肝肾毒性等不良反应率高,故其盐类、脂质体等复合制剂应运而生[16-17],以减轻其不良临床事件。其中,两性霉素B 盐类制剂治疗严重的深部真菌感染时,因不能迅速奏效而受到限制;加之不良反应较多,临床上很难与两性霉素B 脂质体制剂匹敌。但两性霉素B 的肝肾等不良反应事件依然限制了其临床应用。Wingard 等[18]对277例接受伏立康唑或传统两性霉素B 治疗的侵袭性曲霉菌感染的临床指标进行了研究分析,表明伏立康唑与两性霉素B 比较,治疗费用相同,但死亡率较低,且医院存活率较高。伊曲康唑[19]的抗菌谱也较广,与伏立康唑同属于唑类抗真菌药,但其口服吸收少、生物利用度低,静脉用药则对溶媒有独特的要求,易与其他药物间产生药物相互作用。米卡芬净[20]属于棘白菌素类抗真菌药,相对于其他抗真菌药有较高的安全性,然其口服利用度较小,且价格较高,很大程度限制了其临床应用。
综上所述,伏立康唑以其较强的广谱抗菌疗效及相对较好的临床安全性,在临床应用愈加广泛,其临床应用价值尚有待进一步检验。
[1] Chen SC,Slavin MA,Sorrell TC. Echinocandin antifungal drugs in fungal infections:a comparison[J]. Drugs,2011,71(1):11-41.
[2] Cross SA,Scott LJ. Micafungin:a review of its use in adults for the treatment of invasive and oesophageal candidiasis,and as prophylaxis against Candida infections[J].Drugs,2008,68(15):2225-2255.
[3] Pappas PG,Kauffman CA,Andes D,et al. Clinical practice guidelines for the management of candidiasis:2009 update by the Infectious Diseases Society of America[J]. Clin Infect Dis,2009,48(5):503-535.
[4] Cadena J,Levine DJ,Angel LF,et al. Antifungal prophylaxis with voriconazole or itraconazole in lung transplant recipients:hepatotoxicity and effectiveness[J].Am J Transplant,2009,9(9):2085-2091.
[5] Walsh TJ,Anaissie EJ,Denning DW,et al.Treatment of aspergillosis:clinical practice guidelines of the Infectious Diseases Society of America[J]. Clin Infect Dis,2008,46(3):327-360.
[6] 卜祥芳,耿荣,钱素云,等.儿童重症监护室深部真菌感染死亡危险因素分析[J]. 中国小儿急救医学,2013,20(1):34-37.
[7] The Cochrane Collaboration. Cochrane Handbook for Systematic Reviews of Interventions Version 5. 0. 1[EB/OL].[2009-3-10].http://www.cochrane-handbook.org/.
[8] Walsh TJ,Pappas P,Winston DJ,et al.Voriconazole compared with liposomal amphotericin B for empirical antifungal therapy in patients with neutropenia and persistent fever[J]. N Engl J Med,2002,346(4):225-234.
[9] Queiroz-Telles F,Goldani LZ,Schlamm HT,et al.An open-label comparative pilot study of oral voriconazole and itraconazole for long-term treatment of paracoccidioidomycosis[J].Clin Infect Dis,2007,45(11):1462-1469.
[10] Herbrecht R,Denning DW,Patterson TF,et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis[J].N Engl J Med,2002,347(6):408-415.
[11] Kohno S,Izumikawa K,Ogawa K,et al.Intravenous micafungin versus voriconazole for chronic pulmonary aspergillosis:a multicenter trial in Japan[J].J Infect,2010,61(5):410-418.
[12] 吴小艳,金润铭,肖燕,等.伏立康唑与米卡芬净在儿童恶性血液病深部真菌感染中的应用[J]. 中国医院药学杂志,2010,30(16):1383-1385.
[13] 熊慧华,余忠贞,石磊,等.伏立康唑治疗恶性肿瘤合并侵袭性真菌感染的临床观察[J].临床内科杂志,2008,25(10):669-671.
[14] 贾宗岭,张秫捷,陈娜,等. 两性霉素B 雾化加灌洗联合治疗侵袭性肺部曲霉菌病的探讨[J]. 河南大学学报(医学版),2011,30(3):190-191.
[15] Epaulard O,Leccia MT,Blanche S,et al. Phototoxicity and photocarcinogenesis associated with voriconazole[J]. Med Mal Infect,2011,41(12):639-645.
[16] Kagan L,Gershkovich P,Wasan KM,et al. Physiologically based pharmacokinetic model of amphotericin B disposition in rats following administration of deoxycholate formulation(Fungizone(r)):pooled analysis of published data[J].AAPS J,2011,13(2):255-264.
[17] Moen MD,Lyseng-Williamson KA,Scott LJ. Liposomal amphotericin B:a review of its use as empirical therapy in febrile neutropenia and in the treatment of invasive fungal infections[J].Drugs,2009,69(3):361-392.
[18] Wingard JR,Herbrecht R,Mauskopf J,et al.Resource use and cost of treatment with voriconazole or conventional amphotericin B for invasive aspergillosis[J].Transpl Infect Dis,2007,9(3):182-188.
[19] Marks DI,Pagliuca A,Kibbler CC,et al.Voriconazole versus itraconazole for antifungal prophylaxis following allogeneic haematopoietic stem-cell transplantation[J]. Br J Haematol,2011,155(3):318-327.
[20] Yamaguchi M,Kurokawa T,Ishiyama K,et al. Efficacy and safety of micafungin as an empirical therapy for invasive fungal infections in patients with hematologic disorders:a multicenter,prospective study[J]. Ann Hematol,2011,90(10):1209-1217.
