莫西沙星治疗成人支原体肺炎的临床疗效分析
2013-07-11封辰叶康大海王晓慧王秋月
侯 刚,封辰叶,尹 燕,康大海,王晓慧,韩 宇,韩 丹,王秋月 ,康 健
社区获得性肺炎(Community acquired pneumonia,CAP)是呼吸系统最常见的感染性疾病之一,严重威胁人们的健康。肺炎链球菌是CAP 的常见病原体[1],但非典型病原体,尤其是支原体在CAP 致病原中的比例逐渐升高,有些地区高达25%[2]。鉴于非典型病原体比例的增加,目前国内外多项指南推荐CAP 初始治疗覆盖非典型病原体。指南推荐初始治疗方案为单用氟喹诺酮类药物或β 内酰胺类药物联合大环内酯类药物[3-4]。就支原体肺炎而言,上述两种方案的疗效优劣存在一定的争议。因此,笔者收集我院2009 年10 月至2011 年9 月CAP 患者中明确诊断为支原体肺炎的患者,将初始治疗采用莫西沙星和头孢呋辛/阿奇霉素的患者分成2 组,比较二者的临床失败率、72 h 退热率、获得临床稳定的时间等指标,以评价莫西沙星治疗成人支原体肺炎的临床疗效。
1 资料与方法
1.1 一般资料 2009 年10 月至2011 年12 月我科收治的确诊为CAP(支原体肺炎)的患者86 例,选取初始治疗采用莫西沙星单药治疗(28 例,莫西沙星组)或头孢呋辛/阿奇霉素联合治疗(22 例,联合治疗组)的患者共50 例。所有病例均符合我国社区获得性肺炎诊治指南的诊断标准。所有患者的支原体肺炎诊断采用被动凝集法检测血清肺炎支原体抗体(SERODIA-MYCO II,FUJIREBIO INC. JAPAN),血清支原体抗体IgM 滴度呈4 倍增高或降低而确定。
1.2 方法 回顾性分析患者的年龄、性别、肺炎严重指数(Pneumonia scoring index,PSI)、CURB65、最高体温等基础指标。比较两组患者的治疗失败率,平均热退时间、72 h 退热率、获得临床稳定的时间、静脉抗生素使用天数、抗生素总疗程,住院时间等指标,评价莫西沙星在治疗成人支原体肺炎的临床疗效,探讨支原体肺炎抗生素使用疗程的相关因素。
1.3 观察指标 ①PSI 计算方法,具体参见文献[5]。②CURB65[6]计算方法:有下列情况之一计1 分,满分 5 分,包括:意识不清,尿素氮>7.0 mmol/L,呼吸频率≥30 次/min,收缩压<90 mmHg或舒张压≤60 mmHg,年龄>65 岁。③临床稳定:体温≤37.8 ℃,心率≤100 次/min,呼吸频率≤24 次/min,收缩压≥90 mmHg,动脉氧饱和度≥90%或PO2≥60 mmHg(吸室内空气),能经口进食,神志正常[7]。④治疗失败的判定标准:晚发治疗失败是指持续/新出现的发热和症状或者血流动力学不稳定,发展为呼吸衰竭,影像学进展或在抗生素治疗72 h 后出现新的感染灶。早发治疗失败是指初始治疗72 h 内临床恶化,包括下列指标的一条或以上:血流动力学不稳定,新出现呼吸衰竭或原有呼吸衰竭恶化,需要机械通气,影像学进展,或出现新感染灶[8]。
1.4 统计分析 采用SPSS 17.0 软件。计量资料以±s 表示,数据比较采用t 检验;计数资料率的比较采用卡方检验;两变量的相关性检验采用Pearson 相关。P <0.05 为差异有统计学意义。
2 结果
2.1 两组患者基本情况比较 本研究中纳入的SAP(支原体肺炎)患者50 例,男20 例,女30 例。两组患者一般资料比较差异无统计学意义(P >0.05)。见表1。
2.2 两组患者临床表现及严重程度比较 两组患者的最高体温、PSI 评分、CURB65 评分比较差异无统计学意义。两组均无重症患者。见表1。
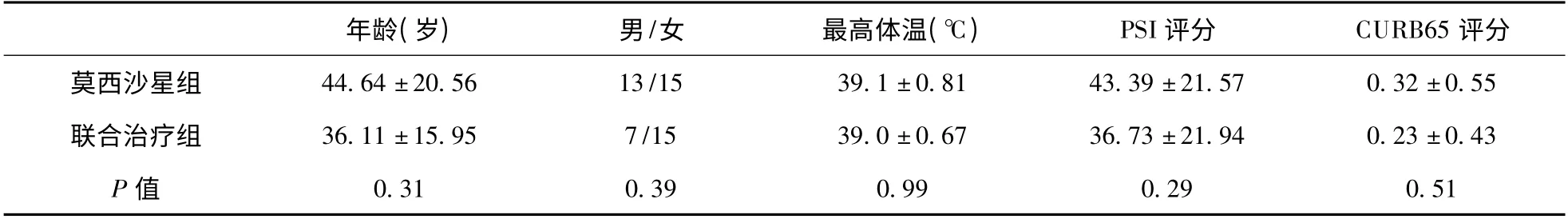
表1 两组患者的一般情况及肺炎严重程度比较
2.3 两组临床疗效比较 两组均未出现临床失败病例。两组平均退热时间比较,莫西沙星组短于联合治疗组,且其72 h 退热率高于联合治疗组。莫西沙星治疗组可较快实现72 h 内体温回落至正常范围。莫西沙星组获得临床稳定所需的治疗时间短于联合治疗组。莫西沙星组静脉抗生素的疗程短于联合治疗组,但两组抗生素的总疗程和住院天数差异无统计学意义。见表2。
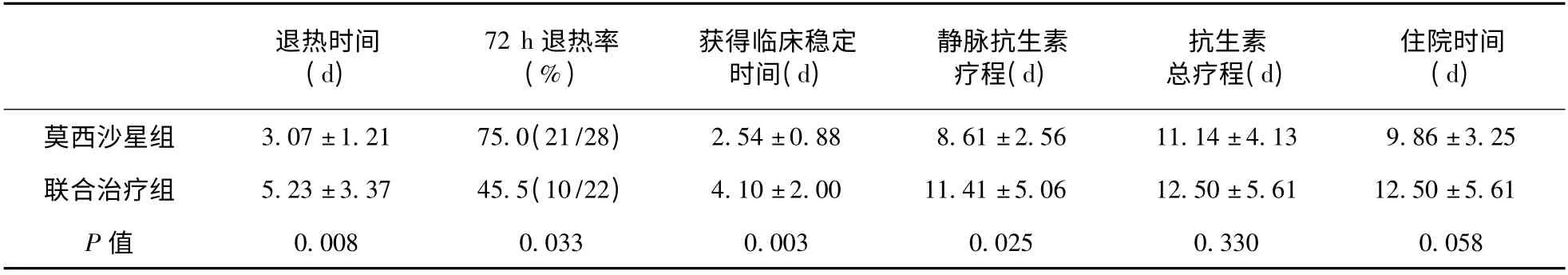
表2 两组患者的临床疗效比较
3 讨论
非典型病原体肺炎,尤其是支原体肺炎已成为CAP 中越来越被关注的热点,它在CAP 病原学中的比例高,是45 岁以下成人所患CAP 中最常见病原体[3],因此,许多国家和学会的CAP 指南均推荐初始治疗覆盖非典型病原体[3-4]。然而,由于其分离培养技术的限制,在国内大多数医院仍依靠血清学检测支原体抗体IgM 作为诊断的主要手段,检测手段的局限性带来了诊断的滞后性。另外,指南推荐覆盖非典型病原体,但并非所有的医生对指南的执行具有良好的依从性。英国的一项研究显示,很多医生在处理CAP 时并未按指南进行肺炎严重程度评估,且不恰当地使用三代头孢菌素[9]。CAP 初始治疗覆盖非典型病原体这一治疗原则的执行力有限。不覆盖非典型病原体和不遵从指南推荐的治疗原则,其弊端显而易见。有报道,与覆盖典型病原体比较,不覆盖非典型病原体将导致病死率增加,获得临床稳定所需时间延长,住院时间延长[2]。而不遵从指南的治疗原则,死亡率增加[10]。由此可见,初始治疗覆盖非典型病原体应该贯彻,但选择哪种药物更有效或更具经济性存在一定的争议。研究显示,莫西沙星治疗CAP 可获得更快的临床稳定时间和较短的疗程,单药治疗较联合治疗具有更好的便利性和依从性[11-12]。
本研究无治疗失败的病例,可能与所选择的判定标准有关,如果参照将“初始治疗72 h 后体温不降”作为治疗失败条件之一的标准来衡量,则两组均存在治疗失败病例。另外,可能还与患者均为轻中度患者有关。本研究结果显示,在治疗支原体肺炎中,莫西沙星的退热时间及72 h 退热率明显优于头孢呋辛/阿奇霉素的联合治疗,其原因可能与喹诺酮药物进入细胞内的速度和在溶酶体中释放的速度比大环内酯类药物快有关[13]。另外,由于其退热快,对轻中度CAP 患者可较快实现临床稳定,而有研究显示,静脉抗生素的应用疗程与临床稳定时间呈正相关[14],这也支持本研究莫西沙星组静脉抗生素疗程短的结果。但莫西沙星组和联合治疗组的抗生素总疗程和住院时间差异无统计学意义,其原因可能是受样本量小的影响,以及临床医生倾向于抗感染疗程(支原体肺炎)为10 ~14 d 所致。随着CAP 临床路径管理的推行,轻中度CAP 患者的停药时机和出院时间主要依据临床稳定达3 d 以上作为标准时,可能减少抗生素治疗的总疗程。目前,支原体肺炎耐大环内酯类支原体检出率增加的问题不容忽视[15-16]。曹彬等[17]研究显示,喹诺酮类药物对耐大环内酯类支原体具有非常好的活性,因此,喹诺酮类是治疗支原体肺炎的可靠药物。本研究的局限性主要在于样本量较少,轻症患者居多。
综上所述,莫西沙星治疗支原体肺炎疗效可靠,可迅速改善发热症状,是支原体肺炎治疗的首选药物之一。
[1] Cillóniz C,Ewig S,Polverino E,et al. Microbial aetiology of community-acquired pneumonia and its relation to severity[J].Thorax,2011,66(4):340-346.
[2] Arnold FW,Summersgill JT,Lajoie AS,et al,A Worldwide Perspective of Atypical Pathogens in Community-acquired Pneumonia[J].AJRCCM,2007,175(10):1086-1093.
[3] Mandell LA,Wunderink RG,Anzueto A,et al.Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the Management of Community Acquired Pneumonia in Adults[J].Clinical Infectious Diseases,2007,44(suppl 2):S27-S72.
[4] 中华医学会呼吸病学分会. 社区获得性肺炎诊断和治疗指南[J].中华结核和呼吸杂志,2006,29:651-655.
[5] Eerden MM,Graaff CS,Bronsveld W,et al.Prospective evaluation of pneumonia severity index in hospitalised patients with community-acquired pneumonia[J]. Respir Med,2004,98(9):872-878.
[6] Gavin B,Dilip N,Peter D. The CURB65 pneumonia severity score outperforms generic sepsis and early warning scores in predicting mortality incommunity-acquired pneumonia[J].Thorax,2007,62(3):253-259.
[7] Ramirez JA,Srinath L,Ahkee S,et al.Early switch from intravenous to oral cephalosporins in the treatment of hospitalized patients with community-acquired pneumonia[J]. Arch Intern Med,1995,155(12):1273-1276.
[8] Menéndez R,Torres A,Zalacaín R,et al.Risk factors of treatment failure in community acquired pneumonia:implications for disease outcome[J].Thorax,2004,59(11):960-965.
[9] Collini P,Beadsworth M,Anson J,et al. Community-acquired pneumonia:doctors do not follow national guidelines[J].Postgrad Med J,2007,83(982):552-555.
[10] Arnold FW,LaJoie AS,Brock GN,et al.Improving outcomes in elderly patients with community-acquired pneumonia by adhering to national guidelines:Community-Acquired Pneumonia Organization International cohort study results[J]. Arch Intern Med,2009,169(16):1515-1524.
[11] Hoeffken G,Talan D,Larsen LS,et al.Efficacy and safety of sequential moxifloxacin for treatment of community-acquired pneumonia associated with atypical pathogens[J]. Eur J Clin Microbiol Infect Dis,2004,23(10):772-775.
[12] Ewig S,Hecker H,Suttorp N,et al.Moxifloxacin monotherapy versus β-lactam mono-or combination therapy in hospitalized patients with community-acquired pneumonia[J]. J Infect,2011,62(3):218-225.
[13] Tulkens PM.Intracellular distribution and activity of antibiotics[J]. Eur J Clin Microbiol Infect Dis,1991,10(2):100-106.
[14] Aliberti S,Blasi F,Zanaboni AM,et al.Duration of antibiotic therapy in hospitalised patients with community-acquired pneumonia[J].ER J,2010,36(1):128-134.
[15] Morozumi M,Takahashi T,Ubukata K. Macrolide-resistant Mycoplasma pneumoniae:characteristics of isolates and clinical aspects of community-acquired pneumonia[J].Infect Chemother,2010,16(2):78-86.
[16] Peuchant O,Ménard A,Renaudin H,et al.Increased macrolide resistance of Mycoplasma pneumoniae in France directly detected in clinical specimens by real-time PCR and melting curve analysis[J].J Antimicrob Chemother,2009,64(1):52-58.
[17] Cao B,Zhao CJ,Yin YD,et al.High prevalence of macrolide resistance in mycoplasma pneumonia isolates from adult and adolescent patients with respiratory tract infection in China[J].Clinical Infectious Diseases,2010,51(2):189-194.
