不同倍性泥鳅鳍细胞培养及染色体标本制备方法的研究
2013-07-07刘博李雅娟李霞隋燚高养春王玉生马辰
刘博,李雅娟,李霞,隋燚,高养春,王玉生,马辰
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
不同倍性泥鳅鳍细胞培养及染色体标本制备方法的研究
刘博,李雅娟,李霞,隋燚,高养春,王玉生,马辰
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
以天然二倍体、杂交三倍体(4n♀×2n♂)和天然四倍体泥鳅Misgurnus anguillicaudatus的鳍组织为材料,对短期培养的消毒方法、秋水仙素的浓度(1.0、1.5、2.0 μg/mL)与处理时间(2、3、4 h)和低渗处理时间(30、40、50 min)等细胞培养技术,及染色体标本制备方法进行了研究。结果表明:选择100 g/L的碘伏溶液杀菌效果良好,对于细胞生长影响较小,尤以处理15 min时的效果最明显,细胞迁出迅速;在终止培养前3 h加入秋水仙素至终浓度为1.5 μg/mL,天然二倍体、杂交三倍体和天然四倍体泥鳅鳍细胞中期分裂相染色体众数最高,分别为93.33%、90.00%、70.00%;25℃下低渗处理40 min时,可以获得大量图像清晰、长度适中、分散良好、染色体数目完整的染色体中期分裂相。本研究中初步建立了以鳍组织培养法作为材料来源快速制备不同倍性泥鳅染色体标本的方法。
泥鳅;天然四倍体;杂交三倍体;二倍体;鳍组织;染色体
染色体标本的制备技术,对于研究鱼类的遗传变异、分类与系统进化、性别决定、杂交育种和环境污染检测等具有重要意义[1]。由于鱼类染色体较小,染色体数目较多,常规的固定切片和压片方法很难制备高质量的染色体标本。低渗处理、空气干燥和细胞培养技术的应用大大提高了对鱼类染色体研究的水平[2]。目前,染色体标本制备最常用的是活体注射PHA-秋水仙素法[3-4],该方法在操作上虽然简单易行,但材料来源必须通过解剖鱼体获得,而且可获得的试验材料数量有限,不利于材料鱼的保护及进一步研究的开展。
泥鳅Misgurnus anguillicaudatus存在多倍体现象,据报道,日本产的泥鳅除二倍体(2n=50)外,在北海道北部有较高的三倍体(3n=75)泥鳅分布,但没有发现天然四倍体泥鳅[5-10]。中国产的泥鳅存在二倍体、三倍体和四倍体[11-14]。近年来,作者对中国产的泥鳅在天然多倍体的分布[15]、体细胞染色体核型分析[16]、染色体带型与 FISH研究[17]、减数分裂染色体行为[18]、人工诱导雌核发育[19]和生殖特性[20]等方面进行了系统研究。首次证实了中国产天然四倍体泥鳅是含有四套染色体组的遗传四倍体(4n=100),也是同源四倍体,能产生正常的2n配子(雌或雄)。同时利用天然四倍体泥鳅与二倍体泥鳅杂交制备了一种新型的杂交三倍体泥鳅,并对其早期的染色体数目、DNA含量等进行了研究[21]。但由于试验材料稀少,常常使后续研究无法进行,因此,活体制备染色体标本十分必要。本研究中以天然二倍体、杂交三倍体(4n♀×2n♂)和天然四倍体泥鳅鳍组织为材料,对短期培养的消毒方法、秋水仙素的浓度与处理时间和低渗处理时间等细胞培养技术,及染色体标本制备方法进行了研究,旨在为开展多倍体泥鳅遗传育种研究提供技术参考。
1 材料与方法
1.1 材料
天然二倍体泥鳅选自大连市农贸市场,体质量为7.14~9.24 g,体长为10.30~11.00 cm;杂交三倍体泥鳅(4n♀×2n♂)由大连海洋大学细胞遗传与工程实验室繁育并暂养于实验室水族箱中,体质量为13.25~15.10 g,体长为10.85~14.90 cm;天然四倍体泥鳅取自湖北省武汉市,体质量为15.48~21.89 g,体长为14.90~15.60 cm。本试验中用到的泥鳅倍性均经血红细胞核测量、流式细胞仪检测确定,3种倍性的泥鳅各使用5条。
1.2 方法
1.2.1 原代培养 原代培养参照郭莹等[22]的方法,并根据泥鳅的实际情况略作改进。
将泥鳅置于含双抗消毒淡水(1 000 IU/mL青霉素、1 000 μg/mL链霉素)中暂养16~24 h,以不添加和添加适量食盐分别进行消毒浸泡。浸泡10 h左右时换水1/2,加适量双抗继续消毒。将泥鳅麻醉后置于湿润纱布上,在超净工作台上将鳍平展,用体积分数为75%的酒精沿鳍条擦拭消毒。剪下鱼鳍,分别用10、50、100、150 g/L的碘伏溶液消毒10、15、20 min,双抗浸泡30 min,期间换液1~2次并不断吹打,吸掉双抗,用PBS和5%FBS-DMEM/F12培养基各漂洗一次。参考樊廷俊等[23]的方法,用0.5%的透明质酸酶和0.2%的Ⅱ型胶原酶联合消化30 min,最后用5%FBSDMEM/F12培养基充分吹打成细胞悬液后,种植于瓶底面积为25 cm2的培养瓶中。16~24 h时补加培养基至3 mL/瓶。
将组织块置于含CO2(体积分数为5%,下同)的培养箱(25℃)中培养,每隔5 d在Olympus倒置显微镜下观察并拍照。
1.2.2 细胞的传代培养 待泥鳅鳍细胞长成单层,并铺满整个培养瓶瓶底时,吸出培养基,加入1 mL左右0.25%的胰酶作用2 min,待细胞变圆后弃掉胰酶,加入含血清的培养基,用弯头吸管吹打成细胞悬液,然后平均分装于两个培养瓶内,置于含CO2(5%)的培养箱(25℃)中培养。
1.2.3 染色体标本的制备 细胞传代培养至2代以后,选择进入对数生长期的细胞为材料进行染色体标本的制备。
1)秋水仙素浓度及处理时间。于终止细胞传代培养前,添加秋水仙素溶液至终浓度分别为1.0、1.5、2.0 μg/mL,每组分别在含CO2(5%)的培养箱(25℃)中培养2、3、4 h。秋水仙素终止作用后,用胰酶(0.25%)消化法收集细胞于锥形离心管中,离心,弃上清,取沉淀,低渗处理40 min,固定,制片,镜检。
2)低渗处理时间。于细胞传代培养结束前3 h,加秋水仙素至终浓度为1.5 μg/mL,用0.8%的柠檬酸钠于25℃恒温箱中分别低渗30、40、50 min,制片,镜检。每组随机抽取40个分裂相,按照无交叉(交叉0次)、分散好(交叉1~3次)、分散较好(交叉4~6次)、分散差(交叉7次以上) 进行统计比较[24]。
1.3 数据处理
根据单一因素分析法,对泥鳅鳍组织的初步消毒方法和影响染色体标本制备的因素逐一筛选,每组设3个平行,将通过显微镜观察到的普遍情况作为结论。
2 结果与分析
2.1 食盐和碘伏对组织块灭菌效果的比较
通过多次试验发现,添加少量食盐对于去除泥鳅体表黏液有一定作用。
在组织灭菌消毒处理中,使用碘伏溶液浸泡效果明显。用10 g/L的碘伏溶液浸泡时,对组织块的灭菌效果最差,细胞全部染菌;用50 g/L的碘伏溶液处理时,虽然有少量组织贴壁生长,在少数几个组织边缘可以观察到迁出的细胞,但是由于数量极少,生长缓慢,不可取;用150 g/L的碘伏溶液浸泡,虽然杀菌效果显著,但是大多数组织块呈棉絮状,基本没有迁出细胞,说明对组织块的损伤大;用100 g/L的碘伏溶液浸泡,杀菌效果良好,对于细胞生长影响较小,细胞迁出迅速,且长势良好,效果最明显(图1)。
用100 g/L的碘伏溶液浸泡组织块的过程中,设定10、15、20 min 3个处理时间进行比较。结果表明,处理10 min和20 min时,各组织的贴壁率和迁出率均低于15 min时,而处理20 min时组织的迁出率明显低于处理10 min时(图1)。
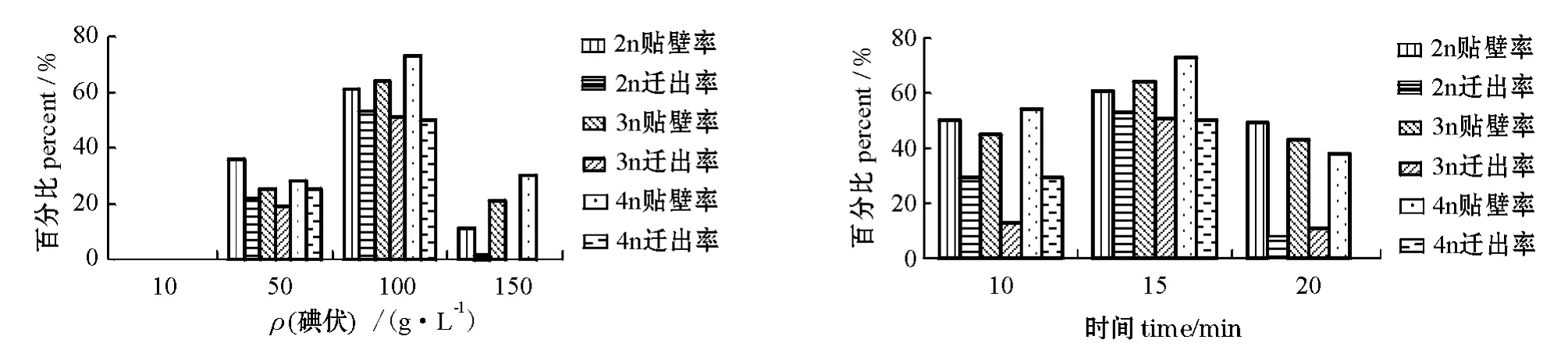
图1 碘伏浓度和处理时间对不同倍性泥鳅鳍组织贴壁率和迁出率的影响Fig.1 The effect of povidone-iodine concentrations and processing time on attachment rate and cell emigration of fin tissue in different ploid loach
选择适当浓度的碘伏溶液和适当浸泡时间是影响组织块杀菌消毒效果的关键因素。本研究结果表明,选择100 g/L的碘伏溶液浸泡15 min时,可以取得理想的杀菌效果,且不影响组织贴壁和细胞迁出(图2)。

图2 泥鳅鳍组织原代细胞Fig.2 Fin cells in first passage from loach
2.2 染色体标本制备的条件
利用鳍组织培养获得的3种不同倍性的鳍细胞进行染色体标本制备时,秋水仙素浓度对染色体形态影响显著。其中,秋水仙素终浓度为2.0 μg/mL时,天然二倍体、杂交三倍体和天然四倍体泥鳅鳍细胞在秋水仙素作用3 h时形态一致,均呈现收缩过度,既短且粗的状态(图3-A、D、G);秋水仙素终浓度为1.0 μg/mL时,3种倍性的泥鳅鳍细胞在秋水仙素作用3 h时形态也基本一致,共同表现为细线状(图3-B、E、H),只在4 h的处理时间中观察到少数几个中期分裂相;秋水仙素终浓度为1.5 μg/mL时,3种倍性的泥鳅鳍细胞染色体形态较为正常(图3-C、F、I)。

图3 不同倍性泥鳅鳍细胞染色体的中期分裂相Fig.3 Metaphase of fin cells in different ploid loach
秋水仙素的作用时间对染色体形态也有明显的影响。在秋水仙素终浓度为1.5 μg/mL时,作用2、3、4 h时分别统计30个细胞的分裂相,并观察形态较好的染色体所占的百分比。结果表明:秋水仙素作用时间为3 h时,3个倍性的泥鳅鳍细胞分裂相正常的百分比均最高,天然四倍体长短臂臂比正常、轮廓清晰的众数为70.00%,杂交三倍体的众数为90.00%,而二倍体的众数则高达93.33%(表1);作用时间为2 h和4 h时,正常染色体所占百分比虽然也是较高的,但普遍低于处理时间为3 h时的众数。

表1 秋水仙素作用不同时间下染色体形态的比较Tab.1 The chromosomal morphology in different colchicine processing time
本研究中发现,低渗时间对染色体分散程度有显著的影响。在25℃的恒温培育箱中,低渗处理30 min时,天然四倍体、杂交三倍体和天然二倍体的染色体交叉数≤3的细胞数分别占 42.5%、77.5%和82.5%;低渗处理40 min时,天然四倍体、杂交三倍体和天然二倍体的染色体交叉数≤3的细胞数分别占77.5%、77.5%和85.0%;低渗处理50 min时,天然四倍体、杂交三倍体和天然二倍体的染色体交叉数≤3的细胞数分别占92.5%、77.5%和95.0%(表2)。
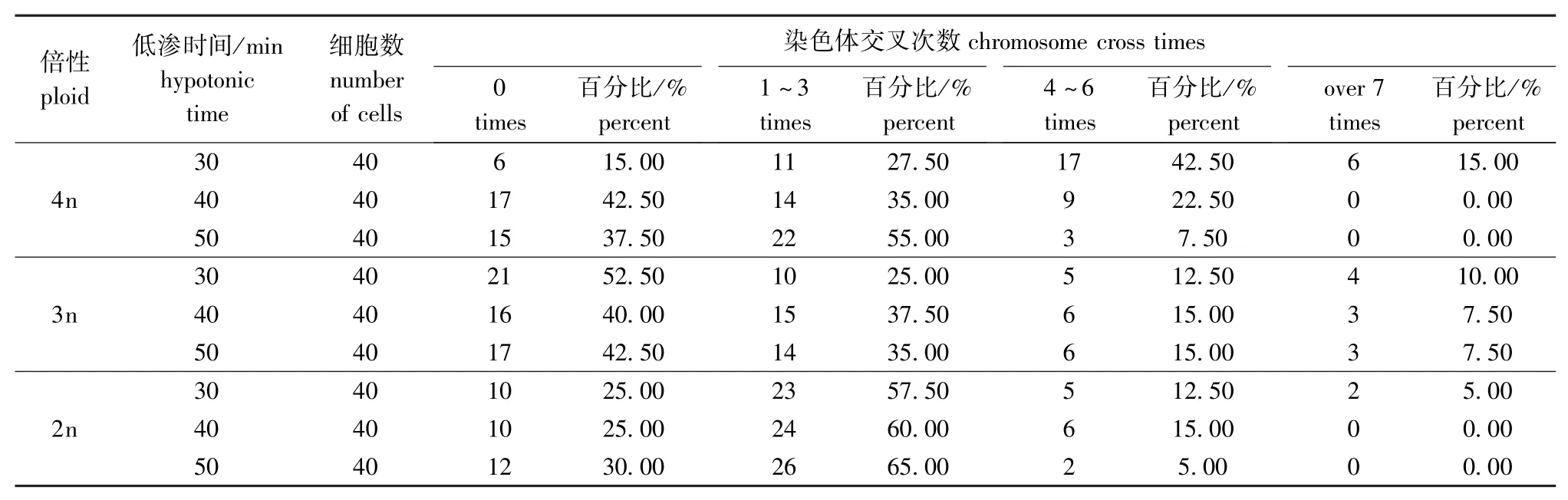
表2 不同低渗时间下染色体分散程度的比较Tab.2 Comparison of chromosome dispersion during different hypotonic time
3 讨论
3.1 食盐和碘伏对泥鳅鳍组织的杀菌作用
添加食盐在泥鳅养殖过程中是一种较为常用的杀菌、消毒和杀虫方式,稀释后直接泼洒在水中就可以起到杀菌的效果,对鱼体本身的伤害也较小。食盐可防治鱼类细菌性疾病、水霉病和寄生虫病等。本试验中观察发现,在泥鳅浸泡过程中,溶解适量食盐可以祛除泥鳅体表的黏液,起到一定的杀菌效果。本试验中尝试采用广谱性的杀菌剂聚维酮碘溶液作为浸泡组织块的消毒剂,结果发现,聚维酮碘溶液消毒易于掌控时间,对细胞生长影响较小,效果较好。泥鳅体表黏液丰富,喜欢生活在湖泊、池塘、沟渠和水田底部富有植物碎屑等细菌富集的淤泥表层,因此,采用泥鳅鳍培养技术的关键是组织块的消毒杀菌问题,本试验中采用100 g/L的碘伏浸泡15 min已达到初步杀菌的作用。高晓华等[25]研究证实,聚维酮碘低毒,可用于异育银鲫的养殖过程。另外,培养基的选择和添加适量的生长因子也是原代培养启动的关键。本试验中原代培养72 h内迁出的是上皮样细胞,随后迁出的是成纤维状细胞,上皮样细胞逐渐死亡并漂浮后被成纤维样细胞取代且连接成单层细胞。Bejar等[26]研究认为,上皮样细胞的死亡可能与细胞寿命有关,也可能与培养基缺少相关生长因子有关。
3.2 泥鳅鳍组织制备染色体条件的探究
3.2.1 秋水仙素对染色体制备的影响 染色体数目具有物种特异性,可以作为准确的细胞种属鉴定指标。染色体核型分析需要分散良好并且显色清晰的染色体中期相,通常是利用秋水仙素终止纺锤丝生成,使染色体停留在有丝分裂中期。在鱼类染色体的制备中,秋水仙素浓度和处理时间对不同鱼种而言差异性较大。李雅娟等[2]在鱼类外周血淋巴细胞短期培养及染色体制备技术的研究中指出,秋水仙素处理的参考范围为0.2~1.0 μg/mL,作用时间为2~6 h;樊廷俊等[27]利用20 μg/mL的秋水仙素在24℃下培养10 h,获得了大菱鲆鳍细胞的中期分裂相;曾令兵等[28]用1 μg/mL的秋水仙素在28℃下作用13~15 h,获得了斑点叉尾鮰肾脏细胞的中期分裂相;任国诚等[29]利用0.5 μg/mL的秋水仙素在24℃下作用4 h,获得了漠斑牙鲆囊胚期胚胎细胞染色体中期分裂相;李运东等[30]在革胡子鲶全血细胞终止培养前6 h,加入终浓度为0.1 μg/mL的秋水仙素,获得较多的分裂相且染色体形态清晰;朱香萍等[4]在牙鲆外周血淋巴细胞结束培养前4 h,加入终浓度为1.5 μg/mL的秋水仙素,获得的中期分裂相效果最好。本试验结果显示:秋水仙素终浓度为1.0 μg/mL时,作用时间为2、3 h,甚至4 h,细胞分裂较少,且染色体形态呈细线状,说明没有到达有丝分裂中期;秋水仙素终浓度为2.0 μg/mL时,镜下观察染色体过度收缩,变短变粗,且时间不易于控制;在细胞培养结束前3 h加秋水仙素至终浓度为1.5 μg/mL时,获得了较多的中期分裂相,且染色体形态良好。在此浓度下设计3个作用时间梯度,作用3 h时3个倍性的泥鳅鳍细胞正常染色体的众数均为最高,一方面说明该浓度最适合泥鳅鳍细胞染色体制备的需要,另一方面,作用3 h时的正常染色体众数高于或等于其他两个时间点,也可成为采用3 h作为最优条件的依据。另外,天然四倍体泥鳅鳍细胞在秋水仙素作用2 h和3 h时,正常染色体的众数相等,均为70.00%,可能是由于每个处理组处于对数生长期的细胞存在较小的误差造成的。
3.2.2 低渗时间对染色体的影响 低渗处理时间对染色体制备也有影响。如果低渗过度,易使细胞核膨大过度,容易过早被打破,造成染色体数目丢失;反之,细胞核膨胀不足或不膨胀,核中的染色体不容易散开,不易获得效果良好的染色体分裂相。本试验结果表明,泥鳅鳍细胞染色体制备时低渗时间以40 min为宜。虽然50 min低渗处理组染色体交叉数≤3的众数普遍大于30 min和40 min处理组,但是染色体过于分散,数目丢失,因此不可取。杂交三倍体泥鳅鳍细胞的3个处理组染色体交叉数≤3的众数相等,也可能是由于每个处理组处于对数生长期的细胞存在较小的误差造成的。从染色体形态来看,30 min低渗处理组染色体相对集中,临近染色体区分不易;50 min低渗处理组染色体相对分散,但个别有丢失现象,故低渗时间仍然以40 min为宜。据报道,鱼类染色体制备的低渗时间一般在30 min左右,不同鱼种的低渗时间相差不大,鲤为35 min[31],罗非鱼和花鲈均为30 min[3,32]。
除了上述讨论的几个因素以外,细胞生长周期的选择也是影响染色体制备的因素。一般选择处于生长对数期的细胞作为制备染色体的材料,这是由于该时期的细胞生长活力好、分裂旺盛,有利于秋水仙素以及低渗液的作用。另外,采用预固定的方式也有助于获得良好的中期分裂相。一般做法是在低渗结束前5~10 min加入10滴固定液,有助于分散细胞,不易结团。如果固定的时间不够,过早打散或吹打过于激烈都可能造成染色体丢失[4]。此外,滴片的高度也会影响染色体分散效果,一般以30 cm为宜。
[1]楼允东.中国鱼类染色体组型研究的进展[J].水产学报, 1997,21(增刊):83-96.
[2]李雅娟,蔡明夷,仇雪梅,等.水产动物遗传育种学实验指导[M].北京:中国农业科学技术出版社,2012:38-42.
[3]曹丽萍,丁炜东.半微量全血培养法制备罗非鱼染色体标本的条件探索[J].上海水产大学学报,2005,14(4):457-459.
[4]朱香萍,林明敏,李桢,等.牙鲆外周血淋巴细胞的培养及染色体制备条件的探讨[J].青岛农业大学学报:自然科学版, 2007,24(4):253-256.
[5]Arai K,Matsubara K,Suzuki R.Karyotyoe and erythrocyte size of spontaneous tetraploidy in the loach,Misgurnus anguillicaudatus [J].Nippon Suisan Gakkaishi,1991,57:2167-2172.
[6]Zhang Q,Arai K,Yamashita M.Cytogenetic mechanisms for triploid and haploid egg formation in the triploid loach Misgurnus anguillicaudatus[J].Exp Zool,1998,281:608-619.
[7]Morishima K,Horie S,Yamaha E,et al.A cryptic clonal line of the loach(Teleostei:Cobitidae)evidenced by induced gynogenesis, interspecific hybridization,microsatellite genotyping and multilocus DNA fingerpringting[J].Zool Sci,2002,19:565-575.
[8]Morishima K,Nakamura Y,Etsuko Bando S,et al.Cryptic clonal lineages and genetic diversity in the loach Misgurnus anguillicaudatus(Teleostei:Cobitidae)inferred from nuclear and mitochondrial DNA analyses[J].Genetica,2008,132:159-171.
[9]Itono M,Morishima K,Fujimoto T,et al.Premeiotic endomitosis produces diploid eggs in the natural clone loach,Misgurnus anguillicaudatus(Teleostei:Cobitidae)[J].Exp Zool,2006,305A:513-523.
[10]Itono M,Okabayashi N,Morishima K,et al.Cytological mechanisms of gynogenesis and sperm incorporation in unreduced diploid eggs of the clonal loach,Misgurnus anguillicaudatus(Teleostei:Cobitidae)[J].J Exp Zool,2007,307A:35-50.
[11]李康,李渝成,周暾.两种泥鳅染色体组型的比较研究[J].动物学研究,1983,4(1):75-80.
[12]李渝成,李康.马口鱼和泥鳅的核型研究兼论鱼类染色体数目多态与分类的关系[J].武汉大学学报,1987(1):107-112.
[13]印杰,赵振山,陈小奇,等.二倍体和四倍体泥鳅染色体组型比较[J].水生生物学报,2005,29(4):469-472.
[14]李雅娟,钱聪,印杰,等.不同倍性泥鳅杂交后代染色体数目组成的研究[J].大连海洋大学学报,2012,27(4):326-332.
[15]李雅娟,印杰,王嘉博,等.中国29の地点ドジヨウにおける倍数体の分布に関する研究[J].日本水産学会誌,2008,74(2):177-182.
[16]李雅娟,田萍萍,李莹,等.中国洪湖不同倍性泥鳅的染色体组成及形态特征比较分析[J].大连水产学院学报,2009,24(3):236-241.
[17]Li Y J,Tian Y,Zhang M Z,et al.Chromosome banding and FISH with an rDNA probe in the diploid and tetraploid loach Misgurnus anguillicaudatus[J].Ichthyological Research,2010,57(4): 358-366.
[18]Li Y J,Yu Z,Zhang M Z,et al.The origin of natural tetraploid loach Misgurnus anguillicaudatus(Teleostei:Cobitidae)inferred from meiotic chromosome configurations[J].Genetica,2011, 139:805-811.
[19]Li Y J,Yu Z,Zhang M Z,et al.Induction of viable gynogenetic progeny using eggs and UV-irradiated sperm from the Chinese tetraploid loach,Misgurnus anguillicaudatus[J].Aquaculture International,2013,21:759-768.
[20]Li Y J,Zhang M Z,Qian C,et al.Fertility and ploidy of gametes of diploid,triploid and tetraploid loaches,Misgurnus anguillicaudatus,in China[J].Journal of Applied Ichthyology,2012,28: 900-905.
[21]李雅娟,庞义猛,于卓,等.利用天然四倍体泥鳅生产全三倍体泥鳅的初步研究[J].东北农业大学学报,2010,41(11): 92-95.
[22]郭莹,李霞,秦艳杰.大泷六线鱼鳍、吻端和肾脏组织原代培养的研究[J].大连海洋大学学报,2012,27(5):387-391.
[23]樊廷俊,魏云波,徐晓辉,等.褐点石斑鱼三种组织细胞系的建立[J].中国海洋大学学报:自然科学版,2009,39(5):961-964.
[24]张清健,郑立新,田佩玲,等.人外周血淋巴细胞高分辨染色体制备技术的研究[J].技术与方法,2013,25(1):52-55.
[25]高晓华,曹海鹏,侯三玲,等.水产用聚维酮碘对异育银鲫养殖的安全性评价[J].动物学杂志,2013,48(2):261-268.
[26]Bejar J,Borrego J,Alvarez C M.A continuous cell line from the cultured marine fish gilthead seabream(Sparus aurata L.)[J]. Aquaculture,1997,150(1/2):143-153.
[27]樊廷俊,耿晓芬,丛日山,等.大菱鲆鳍细胞系的建立[J].中国海洋大学学报,2007,37(5):759-766.
[28]曾令兵,李晓莉,张林,等.斑点叉尾鮰肾脏组织细胞系的建立及其生物学特性[J].中国水产科学,2009,16(1):75-81.
[29]任国诚,陈松林,沙珍霞.漠斑牙鲆胚胎细胞系的建立与鉴定[J].中国水产科学,2007,14(4):579-583.
[30]李运东,张桂贤,安晶,等.革胡子鲶全血培养制备染色体条件探索[J].安徽农业科学,2012,40(4):2054-2055.
[31]耿波,梁利群,孙效文.鲤鱼血淋巴细胞培养及染色体制备条件探索[J].水产学杂志,2003,16(2):32-34.
[32]沙珍霞,陈松林,叶寒青,等.适合花鲈的几种染色体制备方法的比较[J].中国水产科学,2003,10(6):469-471.
The cell culture of fin tissue and preparation of chromosomes in different ploid loach Misgurnus anguillicaudatus
LIU Bo,LI Ya-juan,LI Xia,SUI Yi,GAO Yang-chun,WANG Yu-sheng,MA Chen
(Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
The effects of disinfection methods,concentrations(1.0,1.5,and 2.0 μg/mL)of colchicine,processing time(2,3,and 4 h)of colchicine and hypotonic treatment(30,40,and 50 min)on short-term cell culture of fins and the condition for chromosome preparation were studied in natural diploid,hybrid triploid(4n♀×2n♂) and natural tetraploid loach Misgurnus anguillicaudatus.Results showed that the best disinfection was observed at 100 g/L lodophor with little influence on cell growth,especially rapid cell movement at processing time of 15 min. The maximal chromosome mode was frequencies of normal metaphase spread of natural diploid(93.33%),hybrid triploid(90.00%)and natural tetraploid(70.00%)when the colchicine was added 3 h before the termination of cell culture until to final concentration of 1.5 μg/mL.The clear metaphase spreads with moderate length,excellent dispersion and complete number was observed under condition of hypotonic treatment at below 25℃ for 40 min.In summary,the chromosome preparation method was preliminarily established using cell culture of fins in loach.
Misgurnus anguillicaudatus;natural tetraploid;hybrid triploid;diploid;fin tissue;chromosome
S966.4
A
2013-08-13
国家自然科学基金资助项目(31272650);辽宁省科学技术基金资助项目(201102019);大连海洋大学博士启动基金资助项目(017208)
刘博(1988-),女,硕士研究生。E-mail:xiaowen8901@126.cn
李雅娟(1961-),女,教授。E-mail:liyajuan@dlou.edu.cn
2095-1388(2013)06-0557-06
