纳米银的制备及其抑菌机理
2013-07-06董耀华郭娜刘涛
董耀华,郭娜,刘涛
(上海海事大学a.海洋材料科学与工程研究院;b.商船学院,上海 201306)
0 引言
因为纳米银对微生物有强烈的抑制和杀灭作用,而且不会产生耐药性,越来越受到研究者的关注.但目前,国内外关于纳米银的抑菌机理仍存在很大争议.PHILLIPS 对阳离子聚合物包覆的纳米银颗粒进行研究,实验结果表明阳离子纳米颗粒更易与革兰氏阴性菌(如大肠埃希氏菌)表面带负电的脂多糖层接近,因此对革兰氏阴性菌的作用更明显[1];CAI 等[2]证明单独的介孔氧化硅颗粒对微生物生长无抑制作用,从一个侧面证明纳米银的抑菌性;LIONG 等[3]发现纳米银与微生物之间的作用与表面性质和细胞毒性有关;MIGNOT 等[4]研究表明,革兰氏阳性菌表面肽聚糖层有带负电的磷壁酸,它产生一种蛋白质状结晶S-层,从而环绕在细胞周围,影响细菌与纳米颗粒的交互反应;MORONES等[5]认为纳米银在溶液中之所以具有比银离子更高的抑菌性,是因为银颗粒自身的毒性、纳米尺寸效应及银离子的可调释放性.
为了进一步探讨纳米银的抑菌机理,分别利用纳米银、载银介孔氧化硅、纳米银和纳米铁的混合物等3 种粉体开展抑菌实验研究.
1 试样的制备
1.1 试样制备
将20 g 硝酸银加入850 mL 二甲苯中,加入油胺100 mL,在氮气保护下不断搅拌,并缓慢升温到140 ℃,待溶液颜色逐渐变深并出现蓝色漂浮物后,继续维持140 ℃达12 h,然后加入500 mL 乙醇稀释,以3 500 r/min 速率离心10 min,滤掉上层清液.沉淀物用乙醇再洗涤3 次,干燥后得到12 g 呈亮蓝色的纳米银.
取2 g 纳米银与纳米铁粉1∶1均匀混合;基于纳米银不溶于水、乙醇和丙酮等溶剂,但能溶解于二甲苯、氯仿等溶剂的特点,将5 g 纳米银溶解于氯仿中,并与热的氢氧化钠溶液混合,之后加入造孔剂,利用超声使之均匀混合,蒸发掉氯仿后,经过高速离心去除沉淀与杂质,把上清液配成水溶液加热,并加入硅源混合搅拌,然后依次离心分离,乙醇清洗,最后利用有机溶剂去除活性剂,打开孔道,得到39 g载银介孔氧化硅颗粒.
1.2 培养基制备
实验采用需纳弧菌(Vibrio natriegens)为实验菌种.将15 g 琼脂、5 g 蛋白胨、10 mg FePO4和1 mL酵母汁溶解在1 L 天然海水中,用1 mol/L NaOH 溶液调节至pH 值为7.2~7.4,然后装入三角瓶中封口,并在120 ℃高压灭菌20 min,冷却后待用.
2 实验方法
为有效区分纳米银与银离子的抑菌效果,添加纳米铁粉以阻止纳米银过早被氧化成银离子;而利用多孔氧化硅包覆纳米银的目的是测试纳米银的释放速率与抑菌效果的关系.实验中,纳米银粉体和载银介孔氧化硅粉体的微观形貌和电子能谱采用JSM7500F 型扫描电镜观察和分析.载银介孔氧化硅粉体中纳米银的存在形式通过JEM2100F 型透射电镜分析.抑菌实验中,通过对需纳弧菌的抑菌圈实验和生长曲线的测定研究讨论纳米银的抑菌机理.
在抑菌实验中,为减少因纳米颗粒本身带的电荷、溶液的表面张力、颗粒与滤纸间的相互作用等因素对纳米颗粒在滤纸上吸附量的影响,先将滤纸剪成4 张直径为20 mm 的圆片,经紫外照射灭菌后待用,并将0.05 mg/L 纳米银溶液(S2)、0.39 mg/L 载银介孔氧化硅溶液(S3)和0.1 mg/L 纳米铁和纳米银混合溶液(S4)分别同时采用超声30 min,使溶液颗粒分散均匀,然后使用移液枪分别取等量(0.1 mL)的上述3 种溶液,缓慢滴入3 张滤纸圆片上,并在无菌操作台上静置干燥,最后一张作为空白样(S1),一起开紫外灯照射15 min 灭菌.待培养基冷却至50 ℃左右倒入4个无菌培养皿中适量,水平放置待凝固.然后用灭菌后的移液管吸取0.1 mL浓度为5%的菌液滴加到培养基平板中,用无菌三角涂棒涂抹均匀.再用无菌镊子将上述已灭菌的4 种样品轻轻贴在有菌培养基中心,最后将上述培养皿放置于30 ℃恒温培养箱中,72 h 后取出,观察其抑菌圈情况并测量抑菌圈的尺寸.
在生长曲线测定中,按10%体积比接种富集培养需纳弧菌,以无菌玻璃棒搅拌均匀后放置于30 ℃恒温培养箱中,48 h 后取出,按200 mL/瓶分装在3个灭菌后的三角瓶中.一瓶不作处理,一瓶放入5 μg纳米银,一瓶放入39 μg 载银介孔氧化硅,摇匀后再次放置于30 ℃恒温培养箱中,并开始不定时采用比浊法检测3个瓶中菌的生长情况.
3 实验结果和讨论
3.1 微观形貌
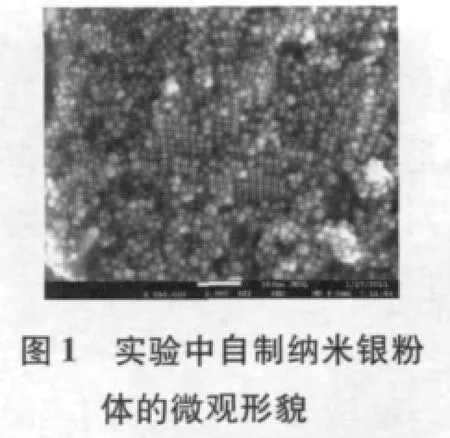
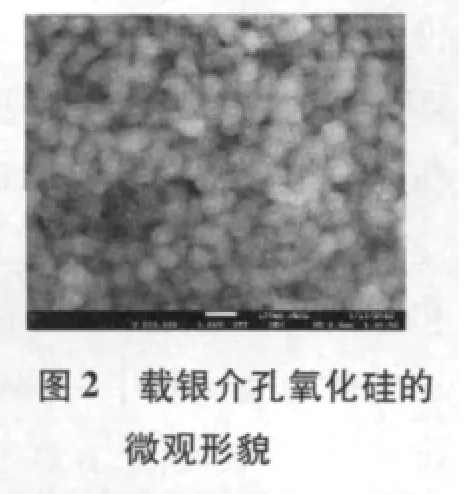
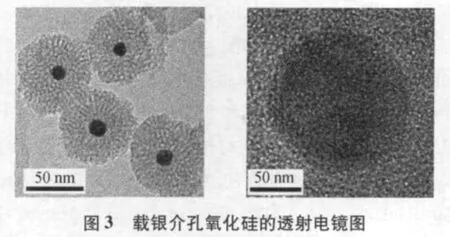
如图1 所示,从样品扫描照片可以看出,根据上述方案制备的纳米银粒径大小在12~20 nm 之间.图2为载银介孔氧化硅粉体的微观形貌,介孔氧化硅中心负载有纳米银颗粒,而且分布非常均匀,通过透射电镜图(图3)可以得到氧化硅和纳米银的直径分别为50 nm和10 nm 左右.根据该样品的电子能谱也能证明纳米颗粒中硅、银、氧的存在,如图4 所示,根据多次电子能谱结果可以同时计算出实验所制备的载银介孔氧化硅中纳米银的含量约为12.77%.

3.2 抑菌实验分析
图5为空白样品、纳米银样品、载银介孔氧化硅样品、纳米银和纳米铁粉混合样品的抑菌实验结果.从实验结果可以看出,空白样几乎没有抑菌圈(图5(a)),纳米银样品的抑菌圈(图5(b))最大,清晰可见,约为4.3 cm,而载银介孔氧化硅样品的抑菌圈(图5(c))最小,为2.3 cm,且明显小于纳米银与纳米铁粉混合粉体样品的抑菌圈(2.6 cm,图5(d)).可见,在纳米铁粉或介孔氧化硅的作用下,纳米银的抑菌效果受到限制.事实上,暴露在空气或液体环境中的金属银单质容易被逐步氧化,原来的Ag0逐步被转变成Ag+[6],根据文献[7]和[8]的相关研究,Ag+可与细菌体内生物酶中有关的巯基结合,破坏细菌控制呼吸的基因链,使之不能产生活性氧(ROS).结合上述理论分析,在本实验中纳米银样品的抑菌圈最大,这是因为随着在液体环境中浸泡时间的延长,纳米银开始以Ag+的形式快速持续释放到周围环境中,从而产生明显的抑菌效果,但在纳米铁粉或介孔氧化硅的作用下,纳米银受到保护和包裹作用,使得纳米银颗粒的被氧化速率受到抑制,其抑菌效果被限制并减弱.因此可以判断,纳米银氧化速度的快慢直接影响其抑菌效果.
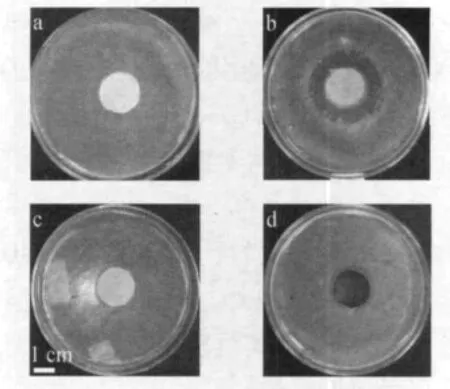
图5 抑菌圈实验
3.3 生长曲线分析
比浊法[9]是指由于微生物的生长引起培养物混浊度的增高,通过紫外分光光度计测定一定波长下的吸光值,就可以判断微生物的生长状况.一般选择在波长550 nm 处用比色管定时测定发酵液的吸光光度值OD550,可以监控菌类的生长数量以绘制生长曲线[10].添加不同样品后的培养基中需纳弧菌生长曲线见图6.可见,0~2 d 内,空白样中的需纳弧菌快速生长,添加纳米银样品的培养基中的需纳弧菌因受到抑制而迅速减少,减少速率明显快于添加载银介孔氧化硅样品的细菌变化速率,这可能因为实验开始时,纳米银被液相中的溶解氧氧化,迅速释放,使得抑菌效果明显.载银介孔氧化硅因为受到二氧化硅的包覆,与周围环境的接触面积明显减少,使得纳米银的氧化和释放效率变低,并在实验开始的2 h 内,需纳弧菌有增多趋势.实验的第3 天,空白样中的需纳弧菌生长达到平衡,之后因为培养基慢慢被消耗,细菌开始减少.添加纳米银样品的培养基则在第5 天明显出现需纳弧菌的繁殖,这说明纳米银已经完全释放而失效,抑菌能力丧失,细菌数量增长使得OD550 数值再度上升.而在添加载银介孔氧化硅样品的培养基中,由于纳米银的释放速度较慢,随着纳米银被氧化成银离子,其抑菌效果逐渐显现,从第3 天开始就始终维持较为稳定的OD550 数值,说明此时瓶中的需纳弧菌持续受到纳米银的抑制和杀灭作用,始终难以正常繁殖和生长.由此可见,纳米银的释放速度和氧化效率也是纳米银抑菌的关键因素,在一定浓度内,释放速度或氧化速度越快,抑菌效果越早显现,但从长期抑菌效果看,纳米银的过快氧化不利于其防污效果的持久性.
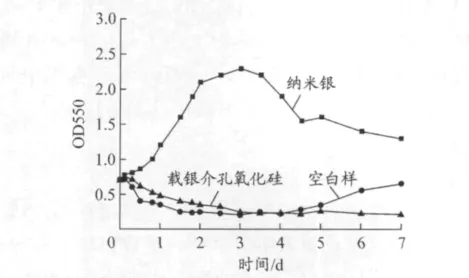
图6 生长曲线
4 结束语
通过抑菌实验和生长曲线测定结果,纳米银抑菌机理在于其银离子的释放,大量银离子来自于零价纳米银颗粒被氧化,在一定时间内,氧化速度与抑菌效果成正比.当纳米银溶液中掺杂纳米铁粉后,由于零价铁比零价银更活泼,所以银的氧化反应受到抑制,其抑菌圈直径小于单纯纳米银;同样,当纳米银被多孔二氧化硅包覆时,由于二氧化硅阻碍银与液相中溶解氧的接触,其氧化速度也大大降低,但其抑菌长效性会在实验后期逐渐显现.
[1]SAHA S,LEUNG K C F,NGUYEN T D,et al.Nanovalves[J].Adv Funct Mater 2007,17(5):685-693.
[2]CAI Qiang,LUO Zhongsheng,PANG Wenqin,et al.Dilute solution routes to various controllable morphologies of MCM-41 Silica with a basic medium[J].Chem Mater,2001,13(2):258-263.
[3]LIONG M,LU J,KOVOCHICH M,et al.Multifunctional inorganic nanoparticles for imaging,targeting,and drug delivery[J].ACS Nano,2008,2(5):889-896.
[4]MIGNOT T,DENIS B,COUTURE-TOSI E,et al.Distribution of S-layers on the surface of Bacillus cereus strains:phylogenetic origin and ecological pressure[J].Environ Microbiol,2001,3(8):493-501.
[5]MORONES J R,ELECHIGUERRA J L,CAMACHO A,et al.The bactericidal effect of silver nanoparticles[J].Nanotechnology,2005,16(10):2346-2353.
[6]DONG Baiyan,MANOLACHE S,SOMERS E B,et al.Generation of antifouling layers on stainless steel surfaces by plasma-enhanced crosslinking of polyethylene glycol[J].Appl Polym Sci,2005,97(2):485-497.
[7]MATSUMURA Y,YOSHIKATA K,KUNISAKI S,et al.Mode of bactericidal action of silver zeolite and its comparison with that of silver nitrate[J].Appl Environ Microbiol,2003,69(7):4278.
[8]ASHARANI P V,MUN G L K,HANDE M P.Cytotoxicity and genotoxicity of silver nanoparticles in human cells[J].ACS Nano,2009,3(2):279-290.
[9]LI W W,ZHOU W Z,ZHANG Y Z,et al.Flocculation behavior and mechanism of an exopolysaccharide from the deep sea psychrophilic bacterium Pseudoalteromonas sp[J].Bioresource Technol,2008,99(15):6893-6899.
[10]COYER J A,CABELLO-PASINI A,SWIFT H,et al.N2fixation in marine heterotrophic bacteria:dynamics of environmental and molecular regulation[J].Proc Natl Acad Sci,1996,93(8):3575-3580.
