三氯乙酸沉淀蛋白法辅助提取牛奶中环腺苷酸工艺
2013-07-06刘永峰高俊岭冉仁森
刘永峰, 高俊岭, 徐 阳, 冉仁森
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
环腺苷酸(cyclic adenosine-3′,5′-monophosphospate,cAMP),溶于水,具有环状结构,性质稳定,对酸、碱、热都相当稳定,存在于多数生物体内,调节着生物体内的物质代谢,对细胞代谢及多种生理效应具有关键作用[1-2].医学研究已经也证明至少有40多种重大疾病与cAMP的代谢有关,人体内缺乏cAMP会导致恶性肿瘤、癌症、失眠健忘、贫血、心血管疾病等众多疾病的发生[3].目前,对于食品及食品原料中cAMP的研究,仅在枣中取得了一定的进展.张明娟等[4]用 HPLC法测定了8种枣果中cAMP的含量,其最高含量为375.61μg/g,最低为46.01μg/g;张岩等[5]用 HPLC测定浓缩枣汁中cAMP含量为4.556 mg/L.马志科等[6]报道了从鲜羊奶中提取cAMP的方法,并利用放射免疫方法测定了cAMP含量,但有关牛奶中的cAMP研究尚未见有相关报道.
牛奶中的蛋白质主要由酪蛋白和乳清蛋白组成,蛋白质含量为3.0% ~3.7%,其中约80%为酪蛋白(酪蛋白至少由10种不同蛋白质组成,是几种含磷蛋白质的复合体),乳清蛋白为18% ~20%,乳中主要的乳清蛋白有β-乳球蛋白、α-乳球蛋白、血清白蛋白、免疫球蛋白和眎、胨;剩余的为一些含氮化合物,属于非蛋白氮(如氨、游离氨基酸、尿素、尿酸、肌酸、嘌呤碱等及少量含氮维生素中的维生素态氮)[7].通过标准罗兰分离法测定,牛乳中氮分布为76%的酪蛋白、18%乳清蛋白和5%左右的非蛋白氮[8].在生物化学、食品科学及其他研究领域中,人们经常用到蛋白或多肽的沉淀剂,其中三氯乙酸(trichloroacetic acid,TCA)应用最为广泛[9].TCA对蛋白的沉淀主要归功于3个氯原子的独特作用[10],TCA作为蛋白质变性剂,使蛋白质构象发生改变,暴露出较多的疏水基团,使之聚集沉淀[11].因此,本实验借鉴前人在枣、羊奶上的提取和测定方法,首次采用TCA沉淀蛋白法对牛奶中的cAMP进行分离提取,通过HPLC测定牛奶中cAMP含量,建立一种牛奶中cAMP分离提取方法.
1 材料与方法
1.1 材料与仪器
1.1.1 原料与试剂
新鲜牛乳,购于陕西省西安市郊农户家中,于4℃条件下冷藏保存,至实验使用.
cAMP标准品,色谱纯,德国Sigma公司;甲醇,色谱纯,加拿大Promptar公司;三氯乙酸、磺基水杨酸、乙醇、磷酸二氢钾均为分析纯.
1.1.2 仪器
高效液相色谱仪,美国Waters公司;色谱柱,HC-C18(5μm,4.6 mm×250 mm),美国Agilent公司;TU-2000型紫外可见分光光度计,日本日立公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;D5-RZ型离心机型,湖南湘仪集团.
1.2 实验方法
1.2.1 样品去乳脂
将300 mL鲜乳使用医用纱布过滤,分装至20个离心管,预热至35~40℃,然后5 000 r/min,离心10 min,取下层去脂后的牛奶,混合.
1.2.2 样品去乳蛋白
将去脂后的牛奶,装在27个15 mL离心管中,每管10 mL.分别用质量分数为10%,15%,20%的TCA溶液处理,每个离心管中分别加不同质量分数TCA 4,6,8 mL,35℃沉淀10 min后,1 000 r/min,离心10 min,取上清液1滴,放入黑色比色板孔中,加1滴质量分数为20%磺基水杨酸检测,如出现白色沉淀,证明还有蛋白质存在,继续沉淀、离心,直到无白色沉淀为止,过滤,取无色上清液分别至27个离心管中.
1.2.3 样品去乳糖
将27个离心管中去蛋白后的滤液的分别置于旋转蒸发仪中,75℃浓缩,将提取液浓缩到占初滤液体积1/10~1/15时,冷却浓缩液至20℃,保持数小时,然后放入4℃的冰箱过夜,形成乳糖结晶于容器底部.取上清液于1.5 mL的离心管中,离心5 min,取上层液体,即为 cAMP溶液,并称重液体质量.
1.2.4 cAMP的HPLC测定
取cAMP标准品溶液,对其进行紫外全波长扫描,根据最大吸收率,确定其检测波长为259 nm.本研究流动相的选择参考张倩等[12]采用的方法,对cAMP进行定性.HPLC测定牛奶中cAMP含量的色谱条件为流动相采用V(甲醇)∶V(双蒸水)=10∶90,其中双蒸水中磷酸二氢钾的浓度为0.05 moL/L.检测波长为259 nm,色谱柱为HC-C18柱,流速1.0 mL/min,检测温度为室温,进样量为20μL;采用保留时间法定性[13],出峰时间为3.4 min.
1.2.5 样品中cAMP含量的测定及统计分析
实验共设置3个TCA质量分数水平和3个TCA用量水平,共9个处理,每个处理3次重复.每个样品溶液分别过0.45μm滤膜,进样进行HPLC测定.
根据式(1),计算出每个样品中cAMP的质量浓度.

式(1)中v为制备样品溶液浓缩后的体积,mL;c为HPLC测定样品溶液中cAMP质量浓度,μg/mL;v1为制备样品溶液所用牛奶的体积mL.
每个样品中cAMP质量浓度在不同处理下分别计算,所有数据采用SPSS18.0软件进行单因素9水平方差分析,并进行多重比较.
2 结果与分析
2.1 样品中cAMP的色谱图
样品cAMP的色谱图与标准品色谱图分别为图1和图2.图1表明,样品中 cAMP保留时间为3.374 min,而图2中标准品的保留时间为3.389 min,所有样品中cAMP保留时间均与cAMP标准品的保留时间一致,并且样品中的目标峰与其他峰分离效果都较好.推测其他峰有可能是环鸟苷酸、明胶等物质.
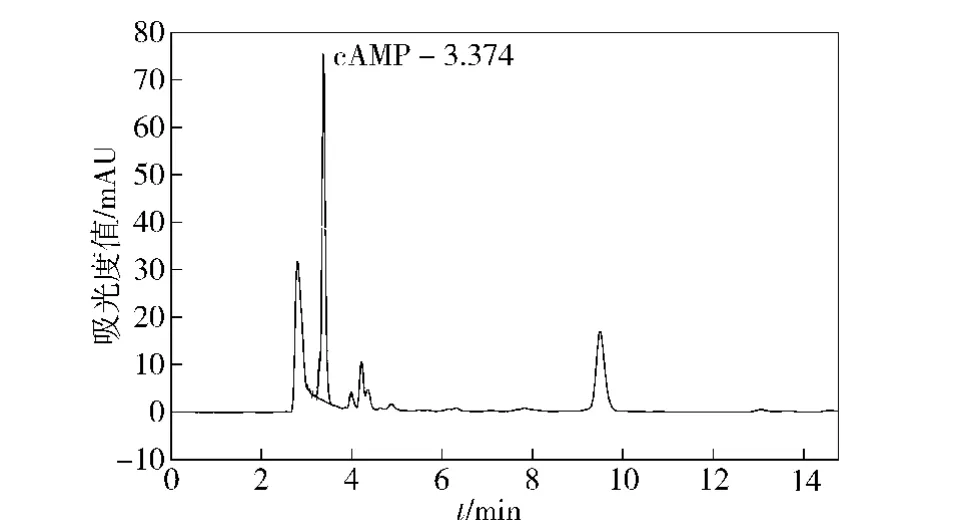
图1 样品溶液中cAMP的色谱图Fig.1 Chromatogram of cAMP in sample solution
2.2 样品中cAMP质量浓度的测定
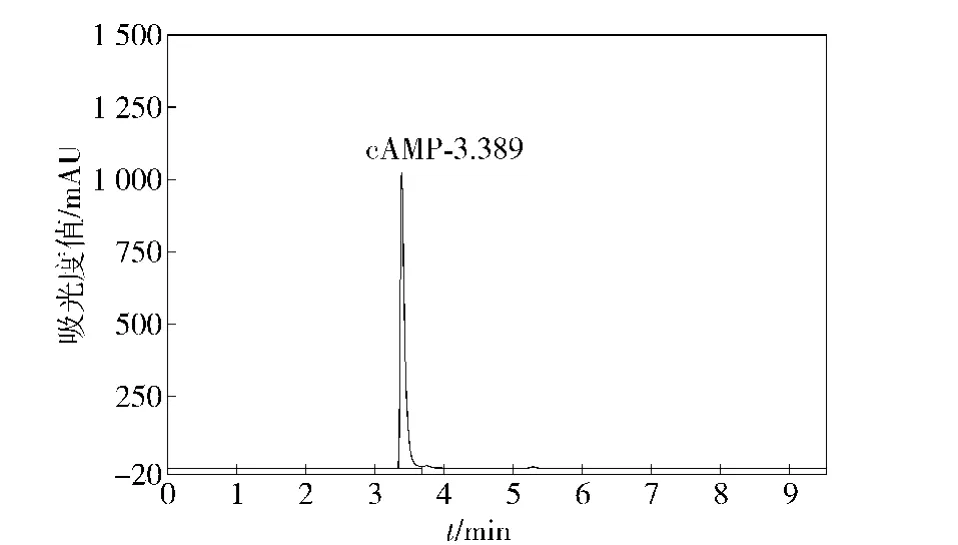
图2 cAMP标准品溶液的色谱图Fig.2 Chromatogram of cAMP in standard solution
TCA处理牛奶样品溶液中cAMP质量浓度的测定结果见表1和图3.可知,不同质量分数TCA处理组之间比较,质量分数为10%TCA处理组cAMP质量浓度显著高于其他2个组(P<0.05).不同用量相同质量分数TCA处理组之间比较,8 mL TCA处理组cAMP质量浓度较其他两组显著降低(P<0.05),而4 mL和6 mL处理组之间的cAMP质量浓度差异不显著(P>0.05).不同质量分数且不同用量的TCA处理组之间比较,发现4 mL和6 mL 10%质量分数TCA处理样品时,cAMP质量浓度为最高(P<0.05),如图4;其次是4 mL和6 mL 20%质量分数TCA处理样品时cAMP质量浓度;8 mL 15%质量分数TCA处理样品时cAMP质量浓度最低(P<0.05).因此,牛奶中 cAMP分离提取时,若选用TCA沉淀乳蛋白方法,最佳TCA处理质量分数为10%,选择用量为4~6 mL,尽量避免选用8 mL的TCA用量.选用10%质量分数TCA溶液处理优于15%和20%质量分数,可能是因为浓度过高会破坏cAMP的生物学结构,造成cAMP含量减少.因此,综合考虑,应选择4 mL 10%的三氯乙酸处理.
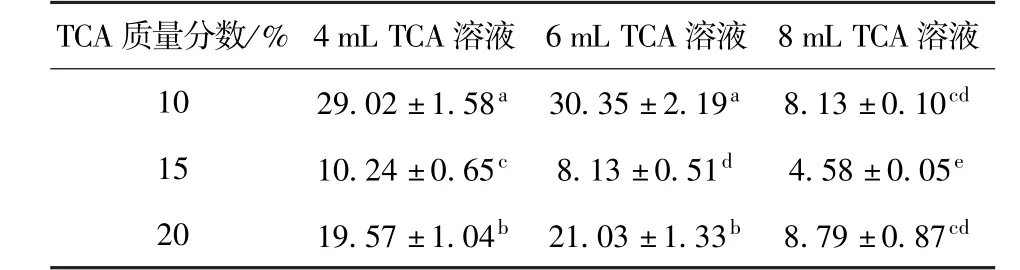
表1 牛奶样品中cAMP质量浓度的测定结果Tab.1 Determination results of cAMPcontents in milk samples-μg/mL

图3 牛奶样品中cAMP质量浓度测定结果Fig.3 Determination results of cAMPcontents in milk samples
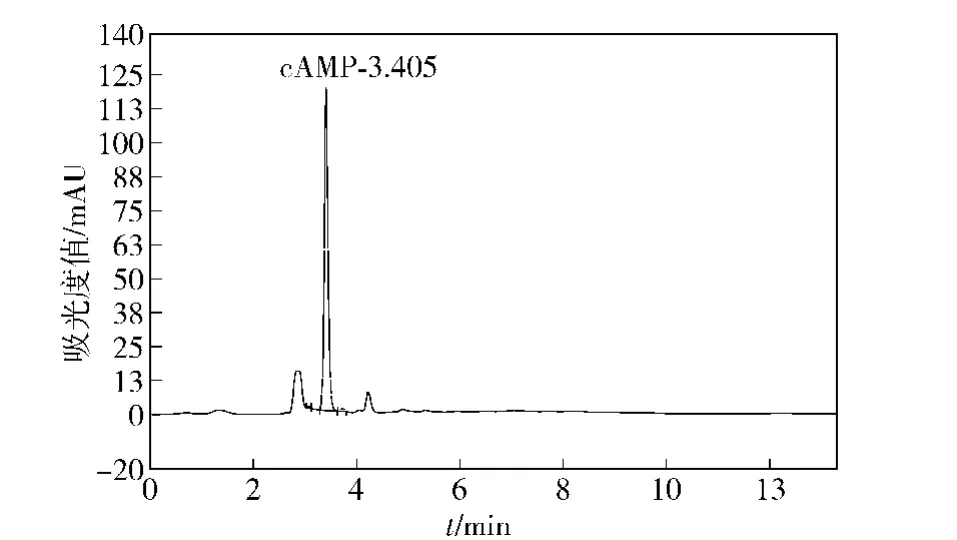
图4 最佳TCA处理组合的样品溶液色谱图之一Fig.4 One chromatogram of sample solution obtained from processing combination of TCA
3 讨论与结论
本研究通过离心去除乳中脂肪,采用不同质量分数不同用量TCA沉淀乳中蛋白质,再浓缩乳糖,分离提取cAMP,选用HPLC测定了牛奶中cAMP质量浓度.不同质量分数TCA处理组之间比较,10%TCA处理组cAMP质量浓度显著高于其他2个组(P<0.05);不同用量相同质量分数TCA处理组之间比较,8 mL TCA处理组cAMP质量浓度较其他两组显著降低(P<0.05);不同质量分数且不同用量的TCA处理组之间比较,4 mL和6 mL 10%质量分数TCA处理样品时,cAMP质量浓度为最高(P<0.05).选用TCA沉淀乳蛋白方法提取牛奶中cAMP时,4 mL 10%质量分数的TCA最佳处理工艺测定cAMP质量浓度为(29.02±1.58)μg/mL.
本研究工艺同样适用于乳清、乳酪副产物、不合格原料牛奶.乳清是在制造奶酪时,从牛奶中分离出来的液体部分,最主要成分就是乳蛋白.目前生产1 t干奶酪排放9 t乳清,每年世界上有上亿t的乳清等待利用和处理,数量相当大.而cAMP的获得,一般采用人工合成方法,国内仅有的几家公司采用核糖核酸为原料生产cAMP,成本在12万元/kg以上,国外厂家如Sigma公司cAMP生产成本高达178.5万元/kg.本实验通过研究牛奶中cAMP的分离提取工艺,最终将建立一套cAMP提取工艺;该工艺的建立,为从乳清、乳酪副产物、不合格牛奶中提取cAMP提供了理论基础,从而将大大降低cAMP生产成本,变废为宝,增加产品的附加值.
[1] 刘永峰,昝林森,田万强.外源性环核苷酸调控哈白兔血脂、血糖及血蛋白的动态变化研究[J].中国农学通报,2012,28(14):84-88.
[2] 高建林,李青南.第二信使cAMP、cGMP信号通路调节骨形成的研究进展[J].中国药理学通报,2010,26(12):1545-1549.
[3] 王立霞.和田玉枣cAMP口服液的研制[J].农产品加工·综合刊,2010,36(4):76-78.
[4] 张明娟,李薇,庞晓明.枣果中环磷酸腺苷(cAMP)的提取工艺及含量测定[J].食品与发酵工业,2012,38(5):228-231.
[5] 张岩,吕品,王红,等.高效液相色谱法同时测定浓缩枣汁中环磷酸腺苷和环磷酸鸟苷的含量[J].食品科学,2009,30(18):321-322.
[6] 马志科,昝林森,王倩,等.乳中环核苷酸提取方法研究[J].西北农业大学学报,1997,5(5):36-39.
[7] 肖莲荣,任国谱,张素文.双缩脲比色法分析三氯乙酸沉淀乳蛋白效果探讨[J].食品工业科技,2011,32(5):415-417.
[8] 仇凯,钟其顶,武金钟,等.食品中牛乳蛋白质和大豆蛋白质结构对比研究[J].中国乳品工业,2008,36(12):47-49,52.
[9] 韩道财,杨萍,洪鹏志.三氯乙酸沉淀罗非鱼肉蛋白酶解液的液相色谱分析[J].食品工业科技,2012,33(9):92-94,99.
[10] Sivaraman T,Kumar T K,Jayaraman G,et al.The mechanism of 2,2,2-trichloroacetic acid-induced protein precipitation[J].Journal of Protein Chemistry,1997,16(4):291-297.
[11] 牛巍,侯彩云,祝晓芳,等.三氯乙酸沉淀法与硫酸铜沉淀法在液态奶蛋白质检测中适用性研究[J].中国乳品工业,2008,36(9):59-61.
[12] 张倩,樊君,罗云书.HPLC测定陕北大枣和新疆大枣中环磷酸腺苷含量的研究[J].药物分析杂志,2008,28(6):895-897.
[13] 史景江,熙中.色谱分析法[M].重庆:重庆大学出版社,1995.
