云南半细毛羊成纤维细胞系建立及其生物学特性分析
2013-07-02吴帅帅李东江吕春荣权国波郭成裕洪琼花
吴帅帅 ,李东江 ,吕春荣 ,权国波 ,郭成裕 ,洪琼花
(1.云南省畜牧兽医科学院,昆明 650224;2.云南农业大学)
云南半细毛羊是以云南省昭通市饲养的山谷藏羊(昭通绵羊)和细毛杂交羊为基础,引入罗姆尼公羊、林肯公羊,经过育成杂交、横交固定、自群繁育而培育成,2000年7月经国家正式命名为“云南半细毛羊”。云南半细毛羊的育成填补了我国无粗档半细毛羊品种的空白。然而,近年来由于市场导向的变化,云南半细毛羊数量出现逐步下降的趋势[1],因此非常有必要开展云南半细毛羊种质资源保存的研究。相对于传统的活体保存而言,体细胞保存具有明显优势,如占用场地小、投资小、不受群体和个体生理利用年限制约可以长期保存种质资源等。此外,建立云南半细毛羊体细胞系对于开展其相关生物技术研究,如体细胞克隆和转基因动物制作具有非常重要的意义。
目前,尚未见到云南半细毛羊皮肤成纤维细胞系的相关报道。本实验采用组织块培养法和冷冻保存技术首次建立了云南半细毛羊成纤维细胞系,并对其培养条件和细胞生物学特性进行了系统研究,以期为云南半细毛羊种质资源保存和相关生物技术的开展提供必要的资源和技术支持。
1 材料与方法
1.1 材料
1.1.1 实验动物 云南半细毛羊来自种羊场。
1.1.2 主要试剂、仪器
1)本研究中所用的化学试剂除特别说明外,均为Sigma公司生产,培养用DMEM、胎牛血清(FBS)由Gibco公司生产。一次性塑料培养皿为Nunclon公司生产。
2)主要仪器设备:倒置显微镜(Olympus,Nikon);CO2培养箱(Thermo);实体显微镜(Olympus);细胞计数仪等。
1.2 方法
1.2.1 耳源组织块的收集 云南半细毛羊耳尖消毒去毛后剪取0.5 cm2大小的皮块,置于4℃保存液中,2 h内带回实验室培养。保存液为DMEM+10%FBS+200 u/mL青霉素+200 u/mL链霉素。
1.2.2 原代细胞培养 无菌组织块用生理盐水液反复洗涤3次,然后用眼科剪剪成碎块,置于直径为50 mm培养皿中,每皿10块进行培养。所用培养液为DMEM添加10%FBS,在5%CO2、饱和湿度和37.0℃培养箱中培养,细胞长出后开始换液,之后每3天换液1次。
1.2.3 细胞传代及成纤维细胞的纯化 待培养皿基本铺满单层细胞,去除培养液添加胰蛋白酶-EDTA(0.15%胰蛋白酶,0.02%乙二胺四乙酸)(TE)消化液控时控温消化。倒置显微镜观察,在成纤维细胞离壁前立即添加含有血清的培养液终止消化,制成细胞悬液,再移至离心管中,经1 600 r/min离心5 min后弃上清,按照传代前与传代后1∶2的细胞数目比例对细胞进行传代培养,每隔24 h进行换液。等细胞汇合度达80%~90%时,进行下一次传代。原皿中贴壁较紧的细胞,可换液继续培养[2]。
1.2.4 细胞冻存与解冻 对数生长期细胞,经TE消化制成细胞悬液,1 600 r/min,离心5 min浓缩后,用冻存液调整细胞浓度为 1×106~1×107个/mL,充分混匀,分装冻存管,放入冻存盒中于-70°C过夜,而后投入液氮中保存[3]。细胞冻存液为DMEM+10%FBS+10%DMSO。解冻在42℃水浴锅中进行,用DMEM+10%FBS液逐渐稀释冻存液,离心洗涤细胞3次,用培养液调整细胞悬液的浓度至1×105个/mL左右接种于24孔板,培养箱中培养。随机选取3个孔,以解冻后24 h细胞贴壁率为指标,计算细胞贴壁率,评价冻存效果。
1.2.5 细胞生物学分析实验 以云南半细毛羊第7代细胞作为对照,分别对第7、12、17代细胞进行以下分析。
1.2.5.1 细胞活率测定 采用PI染法,对冻存前后的第7、12、17代细胞染色,统计计算细胞存活率。
1.2.5.2 生长曲线绘制 将第7、12、17代的细胞浓度调整到3×104个/mL,接种于24孔板内。从接种时间起,每隔24 h计数3孔内细胞数,取3个孔细胞数目的平均值,连续计数,绘制细胞生长曲线。
1.2.6 染色体制备 在对数生长期细胞中加入终浓度为0.25 μg/mL秋水仙素培养2.5 h。胰酶消化细胞制成细胞悬液,经1 600 r/min离心5 min,弃上清。加入0.075 mol/L的氯化钾于室温下放置40 min,离心弃上清。第一次固定时,加入5 mL甲醇与冰乙酸的混合液体(积比为3∶1)(现用现配)固定30 min。离心弃上清。再经第二、三次固定,方法同第一次。弃上清,留0.5~1.0 mL制成细胞悬液,用100 μL移液器吸取细胞悬液,滴在冰冷洁净的载玻片上。于75℃烤箱中干燥3 h,Giemsa染色20 min。
1.2.7 核型分析 挑选形态清晰、分散度良好、收缩适中的染色体中期分裂相,在油镜下拍照,并统计染色体数目。利用ADOBEPHOTOSHOP 7.0软件进行染色体剪贴,对同源染色体进行配对、测量、排队,并按Levan等的标准确定着丝粒类型[3]。
1.2.8 数据统计 细胞活率计数中的数据,经3次测量取平均值获得。生长曲线中各组数据,均通过6次计数取平均值获得。染色体相对长度经过3次测量,取平均值所得,并进行标准差计算。
2 结果
2.1 细胞培养
组织块在添加10%FBS的DMEM培养液中培养5 d后,成纤维细胞开始沿组织块向周围溢出,随后有致密的上皮细胞贴壁延展生长。成纤维细胞与上皮细胞之间有明显界限,前者为梭形,迁移能力强,细胞间隙大,后者为不规则的圆形或椭圆形,细胞之间没有空隙。详见图1。
图1 云南半细毛羊耳缘组织细胞培养
2.2 冻存对皮肤成纤维细胞形态及生物学特性的影响
以DMEM+10%FBS+10%DMSO作为冷冻保护液对云南半细毛羊成纤维细胞进行冷冻保存(图2-A、B,表1)。结果显示:第7、12、17代细胞在冻存前细胞活率并无明显差别,解冻后细胞活率分别为89.3%、88.9%和87.9%,去除细胞冻存液培养24 h后贴壁率分别为88.9%、88.4%和87.1%。细胞经体外培养4~5代,细胞形态保持初始状态(图2-C)。
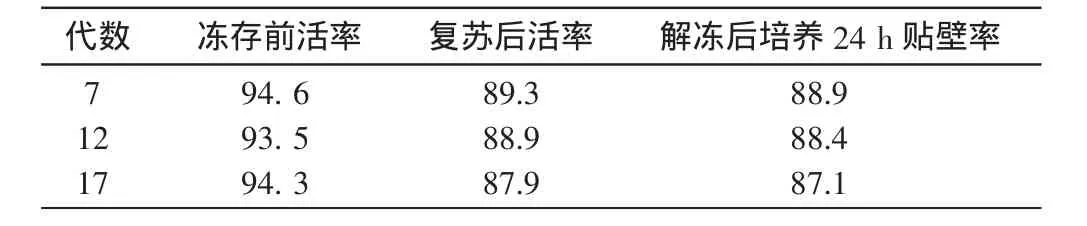
表1 成纤维细胞冻存后培养%

图2 云南半细毛羊成纤维细胞解冻后培养
2.3 细胞生长曲线
对云南半细毛羊第7、12、17代细胞进行连续7 d计数,然后绘制细胞生长曲线(图3)。不同代次的细胞生长曲线均为“S”型,细胞倍增时间分别为26、42、47 h。
2.4 细胞染色体数目分析
参照舒琥等[4]已发表计数方法,分别进行第 7、12、17代细胞的核型分析(图4-D、E、F)。每代取100个分裂相进行统计。结果发现,云南半细毛羊染色体中正常二倍体染色体(2n=54)所占比例分别为93%、86%和81%,伴随着代次增加,染色体数目变异呈逐步增加的趋势(表2)。
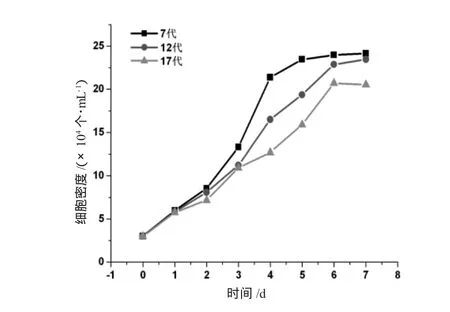
图3 云南半细毛羊成纤维细胞生长曲线

图4 不同代数云南半细毛羊细胞中期染色体(1 000×)
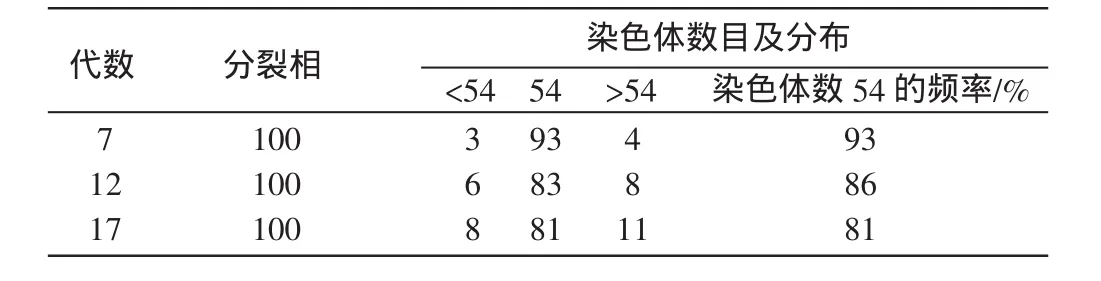
表2 云南半细毛羊养细胞的染色体倍性分析
2.5 核型分析
测量结果表明,染色体组总相对长度197.86,平均相对长度3.66。参照Levan等[3]的命名法,以着丝点位置为判断依据,对云南半细毛羊的染色体进行了分类,常染色体中有3对为中着丝点染色体,23对为端着丝点染色体,X染色体为最大的近端着丝点染色体,Y染色体为最小的亚中着丝点染色体。
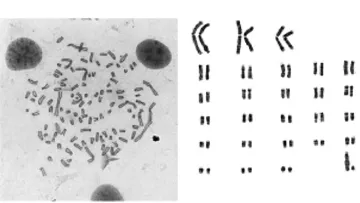
图5 云南半细毛羊核型图(1 000×)
3 讨论
组织块培养原代细胞所需的时间较长,操作比较复杂,但生长的细胞比较整齐,不会由于酶的长时间作用而造成细胞的损伤或遗传特性的改变。本实验表明,组织块培养5 d后,周围开始溢出成纤维样和上皮样细胞,这与Guan等[5]的报道相一致。
在细胞保存过程中,需要尽可能降低细胞内冰晶的形成,从而保持解冻后细胞活性、黏附能力及代谢活性[6]。本实验表明,以DMSO为冻存保护剂可以满足冷冻保存云南半细毛羊皮肤成纤维细胞的要求。
云南半细毛羊成纤维细胞体外培养的生长速度,会随着细胞培养代数的增加而延长,细胞的适应期也变长。此外,在细胞的传代培养过程中,随着代数的增加,细胞的二倍染色体数目异常的比例呈逐步上升趋势,细胞遗传稳定性有所改变。该现象的产生可能是由于细胞本身端粒酶长度的缩短[7]或者体外培养环境对细胞的DNA造成的损伤[8-9]。
在进行核型制备时,不同浓度秋水仙胺、低渗液、处理时间以及滴片时温差等均可对染色体的相对长度和臂比值等产生影响[10]。此外固定和滴片也是核型分散成功的保证[11],适当的滴片高度也是染色体分散良好的重要条件[12]。实验最终确定了制备云南半细毛羊细胞核型的最优条件,即用0.25 μg/mL终浓度的秋水仙胺处理培养细胞2.5 h,低渗40 min,1.5 m滴片,可得到数量多、分散度好的细胞中期染色体。在云南半细毛羊染色体长度的测定计算中,实验对多个中期染色体分裂相进行了观察、分析、比对,以克服实验条件和方法不同对染色体产生的影响。结果表明,云南半细毛羊绵羊的染色体2n=54,与其他绵羊的染色体相似[13-14]。
本研究初步建立了云南半细毛羊皮肤成纤维细胞系,并对其体外培养、生物学特性以及染色体核型分型进行了探讨。该细胞系的建立对云南半细毛羊种质资源的保存及相关繁殖生物技术研究如体细胞克隆和转基因动物制作具有重要意义,同时对于开展其他动物成纤维细胞系的建立也有一定的理论和技术指导意义。
[1]赵远崇,杨宏远,周达云,等.云南半细毛羊遗传资源调查与分析[J].中国畜禽种业,2009(6):56-57.
[2]曹俊新,宋学雄,孙旺吾,等.昆明小鼠胚胎成纤维细胞体外培养条件初步研究[J].中国畜牧兽医,2011,38(10):39-44.
[3]Levan A,Fredga K,Sandberg A A.Nomenclature for centromeric posi tion on chromosomes[J].Heredity,1964,52(2):201-220.
[4]舒琥,蔡晓阅,刘锋,等.鲀形目3种鱼的染色体组型分析[J].动物学杂志,2010,45(2):101-106.
[5]Guan W J,Liu C Q,Li C Y,et al.Establishment and cryopreservation of afibroblast cell line derived from Bengal tiger(Panthera tigris tigris)[J].Cryo Letters,2010,31(2):130-138.
[6]Li G C,Liu Y F,Liang J.Isolation and protective effect in UW solution of human hepatocytes during cold storage[J].Int Congr Ser,2003,1255:217-218.
[7]Rodriguez P,Barquinero J F,Duran A,et al.Cells bearing chromosome aberrations lacking one telomere are selectively blocked at the G2/M checkpoint[J].Mutation Research,2009,670(1/2):53-58.
[8]ChenQ,FischerA,ReaganJD,etal.Oxidative DNA damage and senescence of human diploid fibroblast cells[J].Proc Natl Acad Sci,1995,92(10):4337-4341.
[9]Mackenzie C G,Mackenzie J B,Beck P.The effect of pH on growth,protein synthesis and lipid-rich particles of cultured mammalian cells[J].Journal of Biophysical and Biochemical Cytology,1961,9(1):141-156.
[10]Moynihan E P,Mahon G A T.Quantitative karyotype analysis in the mussel Mytilus edulis L[J].Aquaculture,1983,33:301-309.
[11]黄燕,赵小平,余红,等.动物骨髓细胞染色体标本制备失败的原因分析[J].生物学通报,2006,41(1):52-53.
[12]李瑜,蔺海明,程卫东.红芪染色体数目及核型分析[J].科技导报,2010,28(1):40-43.
[13]Evans H J,Buckland R A,Sumner A T.Chromosome homology and heterochromatin in goat,sheep and ox studied by banding techniques[J].Chromosoma,1973,42(4):383-402.
[14]雷初朝,李瑞彪,陈宏,等.山羊与绵羊的染色体核型比较[J].西北农业学报,2001,10(3):12-15.
