柔嫩艾美耳球虫Sir2基因的注释、克隆与原核表达
2013-06-29鄢远会戚南山廖申权吴彩艳吕敏娜孙铭飞杨亮宇
鄢远会,戚南山,廖申权,李 娟,吴彩艳,吕敏娜,孙铭飞*,杨亮宇
(1.云南农业大学动物科学技术学院,云南 昆明 650201;2.广东省农业科学院动物卫生研究所,广东 广州 510640)
鸡球虫病是一种全球流行且严重危害养鸡业生产的重要寄生虫病,目前仍主要依赖各种抗球虫药物进行防治,但由于广泛产生的球虫抗药性问题,急需新的抗球虫药物出现[1]。
沉默信息调节因子2(Sir2)是广泛存在于从古细菌到人类的多种生物细胞中,具有依赖NAD+的去乙酰化酶活性和ADP-核糖转移酶活性的一类组蛋白去乙酰化酶(histone deacetylases,HDACs)[2]。研究表明,Sir2参与调节染色质结构,影响细胞的衰老,在染色质沉默、姐妹染色单体调聚、基因调控、代谢调节和抑制细胞凋亡等一系列细胞生物活动过程中起重要作用[3-6]。O-acetyl-ADP-ribose(OAADPr)是Sir2调节去乙酰化反应的产物之一,OAADPr被证实能阻止或延迟海星胚胎的细胞分裂,研究证实通过刺激Sir2p/Sir3p/Sir4p复合物的形成可导致酵母重要功能基因沉默[3]。近年来,在恶性疟原虫(Plasmodium falciparum)、克氏锥虫(Trypanosoma cruzi)、刚地弓形虫(Toxoplasma gondii)、犬新孢子虫(Neospora caninum)和利什曼原虫(Leishmaniaspp)等寄生虫中也相继发现Sir2蛋白,并发现其在寄生虫抗原变异、端粒沉默和DNA修复等生理过程中发挥重要作用[3,7-8]。鉴于低等生物与其宿主在 Sir2基因序列和蛋白结构上的差异,近年来被作为抗病原微生物药物靶标成为了研究的热点,并以此为靶标,已筛选获得了一系列具有抗P.falciparum活性的先导化合物[9-12]。
但目前尚未见艾美耳球虫沉默信息调节因子2蛋白(EtSir2)功能、编码基因研究的报道。鉴于此,本研究拟以对鸡危害最为严重的柔嫩艾美耳球虫(E.tenella)为研究对象,通过电子克隆策略注释其基因序列,并进行克隆以及重组表达,为进一步研究EtSir2的功能,以及以其为靶标筛选新型抗球虫药物奠定基础。
1 材料与方法
1.1 材料
1.1.1 虫株 E.tenella(Houghton株)第2代裂殖子cDNA文库由广东省农业科学院兽医研究所寄生生物学研究室制备并保存。
1.1.2 菌株和载体 E.coli DH5α、E.coli JM109以及E.coli Rosetta菌株均由广东省农业科学院兽医研究所寄生生物学研究室保存;pMD18-T Vector和pET43a载体购于宝生物工程(大连)有限公司。
1.1.3 试剂 乙二胺四乙酸(EDTA)、三羟甲基氨基甲烷(Tris)、氨苄青霉素(Amp)、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、十二烷基硫酸钠(SDS)、溴化乙锭(EB)、溴酚兰为上海生工生物工程技术服务有限公司产品;DNA Marker DL 2000(MD114)为天根生化科技(北京)有限公司产品;琼脂糖和RTPCR试剂盒为宝生物工程(大连)有限公司产品;E.Z.N.A.质粒小量制备试剂盒和DNA胶回收试剂盒为奥美德诺(北京)基因科技有限公司产品;2×Taq PCR MasterMix为天根生化科技(北京)有限公司产品;TaKaRa LA TaqTM为TaKaRa公司产品。T4DNA连接酶、限制性内切酶为上海生工生物工程技术服务有限公司产品。750mL/L乙醇溶液,用无核酶水依试验中所需的量现配制;磷酸盐缓冲液(PBS),TAE核酸电泳缓冲液:参照《分子克隆实验指南》配制。
1.1.4 培养基 LB液体培养基,LB琼脂培养基,SOC液体培养基,参照《分子克隆实验指南》配制。
1.1.5 引物
1.1.5.1 克隆Sir2基因所需引物 根据注释的E.tenella Sir2基因序列,采用Premier Primer 6.0软件设计需要合成的引物,由invitrogen公司合成:
上游引物Sir2F:5′-ATGTGCACGCCGCACACAATC-3′
下游引物Sir2R:5′-TCATTCATTTTCCCCTGGGGGT-3′
1.1.5.2 表达系统的构建所需引物 上游引物:Sir2eF: 5′-GGCGAATTCATGGGCCAGTGGTTAACATACATGCG-3′,下游引物:Sir2eR:5′-GGCGTCGACTCATTCATTTTCCCCTGGGGGT TC-3′。
1.2 方法
1.2.1 Et Sir2基因注释 在NCBI和相关生物学网站(http://www.toxodb.org ,http://plasmodb.org/)搜索与E.tenella进化关系较近物种P.falciparum和T.gondii Sir2的基因序列,利用在线工具ClustalW 进行多重序列比对分(http://www.ebi.ac.uk/tools/clustalW),找到相对保守的氨基酸序列。利用保守的氨基酸序列作为种子序列,搜索球虫基因数据库 www.sanger.ac.uk/Projects/E tenella/,预测拼接Et Sir2基因序列。
1.2.2 PCR扩增Sir2全长ORF序列 以cDNA文库为模板,Sir2F,Sir2R 为引物,TaKaRa LA TaqTM酶进行PCR扩增,反应条件:94℃5min;94℃30s,60℃80s,72℃1min,循环35次;72℃延伸10min,退火温度设定为每循环降低0.2℃。将PCR产物切胶回收后连接至pMD18-T载体,再将连接产物转化入E.coli JM109克隆菌。挑取单菌落若干个,进行菌落PCR鉴定,阳性菌送华大基因公司测序。
1.2.3 序列分析 利用在线翻译工具对序列进行分析。用在线工 具 SignalP 4.1Server(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽序列分析,利用 TargetP 1.1Server(http://www.cbs.dtu.dk/services/TargetP/)对Sir2进行亚细胞定位预测;利用在线工具TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构域分析;利用在线工具ClustaiW2(http://www.ebi.ac.uk/Tools/msa/clustalw2/)进行多重序列比对分析。ESyPred3DWeb Server 1.0(http://www.fundp.ac.be/sciences/biologie/urbm/bioinfo/esypred/)结合软件SPDBV 4.10,模拟得出3D空间构象。
1.2.4 原核表达载体的构建 以上述测序正确的重组菌为模板,用Sir2eF和Sir2eR引物进行PCR扩增。将PCR回收产物及pET43a质粒分别于37℃恒温下用SalⅠ和EcoRⅠ双酶切3h,酶切产物电泳鉴定。将回收的酶切产物于4℃连接过夜,转化至E.coli DH5α感受态细胞,以Amp平板上的白色菌落为模板,进行PCR鉴定筛选。对PCR阳性克隆进行质粒提取,双酶切鉴定。将鉴定结果正确的菌送华大基因公司测序。
将测序正确的菌提质粒,转化至E.coli Rosseta菌,以Amp平板上的白色菌落为模板,进行PCR筛选。
1.2.5 诱导表达与蛋白纯化 将构建的表达菌于37℃摇振培养,180r/min,当OD600nm值为0.5时,加入IPTG至终浓度为1mmol/L诱导表达,转移至16℃摇床160r/min培养18h。3500r/min离心收集沉淀,加入细胞裂解液重悬后进行细胞超声裂解,9000r/min高速离心并分别收集上清和沉淀,经SDS-PAGE检测目的蛋白的表达水平及可溶性。取上清溶液,借助AKTA purifier蛋白纯化系统与Ni-NAT亲和层析柱使目的蛋白得到分离。
2 结果
2.1 Et Sir2基因注释结果
以比对的保守氨基酸序列为种子探针,对E.tenella基因数据库进行Omin Blast分析,结果显示EIMER-contig-00030494包括编码 Et Sir2的基因序列,以 MacVector11.0为工具进行分析,获得Et Sir2完整编码序列。ORF为1029bp,编码342个氨基酸,其编码的蛋白质分子质量为38ku左右。
2.2 PCR扩增EtSir2全长ORF序列
以EtHoughton第2代裂殖子cDNA文库为模板,用Sir2F和Sir2R引物首次扩增得到EtSir2预测序列,采用10g/L琼脂糖凝胶电泳分析,结果显示扩增获得一条约1200bp的片段(图1)。

图1 EtSir2基因的PCR扩增产物凝胶电泳分析Fig.1 Electrophoresis analysis of PCR products of EtSir2gene
2.3 Sir2序列分析
利用在线工具进行信号肽、细胞亚定位以及跨膜结构域分析,结果显示EtSir2无信号肽序列,没有明确的亚细胞定位,不含有跨膜结构域。
利用在线工具ClustaiW2将EtSir2分别与刚地弓形虫(T.gondii)、恶性疟原虫(P.falciparum)、间日疟原虫(P.vivax)、猴疟原虫(P.cynomolgi)、约氏疟原虫(P.yoelii)、犬新孢子虫(N.caninum)、诺 氏 疟 原 虫 (P.knowlesi)、伯 氏 疟 原 虫 (P.berghei)、夏氏疟原虫(P.chabaudi chabaudi)、原鸡(Gallus gallus)以及人类(Homo sapiens)进行多重序列比对分析,结果显示这些基因所编码的氨基酸序列具有一定的相似性,各物种之间的相似性在24%~58%之间;构建的分子进化树显示,EtSir2与T.gondii和N.caninum处于同一进化支上,进化关系最为接近(图2)。
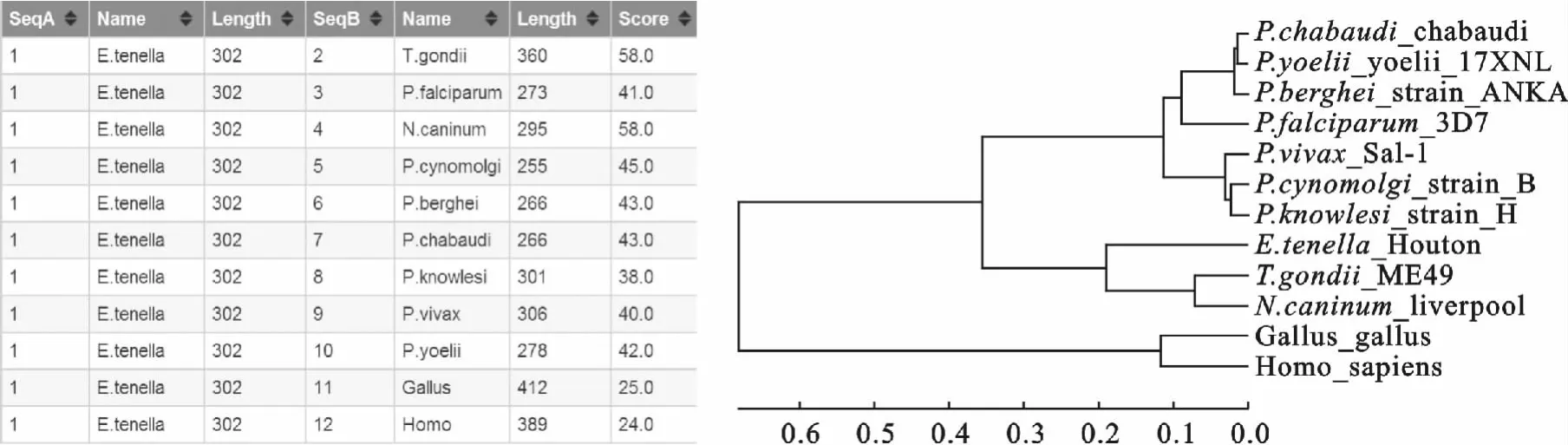
图2 不同物种Sir2种系进化分析Fig.2 Phylogenetic analysis of Sir2sfrom different species
利用ESyPred3DWeb Server 1.0在线软件对EtSir2进行三维结构预测,结合软件SPDBV 4.10,模拟得出3D空间构象。预测EtSir2蛋白分为大小两个亚基,存在NAD+及Zn2+的保守结合位点。α-螺旋(α-helix)所占的比例较高为28.8%,扩展链(Extended strand)的比例为20.2%,无规卷曲(Random coil)的比例为51%,三者交替分布形成EtSir2蛋白的二级结构,如图3。
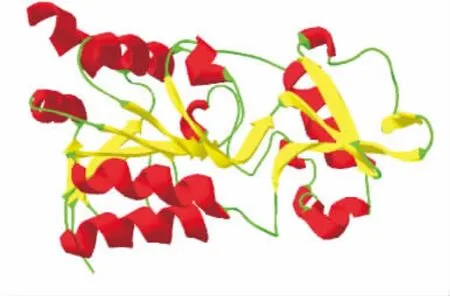
图3 预测的EtSir2三级结构Fig.3 Predicted tertiary structure of EtSir2
2.4 原核表达载体的构建
2.4.1 EtSir2的PCR扩增 以测序正确的克隆菌为模板,用Sir2eF和Sir2eR引物进行PCR扩增,采用10g/L琼脂糖凝胶电泳分析,结果显示扩增获得一条约900bp的片段(图4)。
2.4.2 重组表达质粒的双酶切鉴定 对PCR鉴定的阳性克隆菌进行质粒提取,进一步双酶切鉴定重组质粒(图5)。鉴定结果正确的重组质粒送广东英俊公司进行测序。
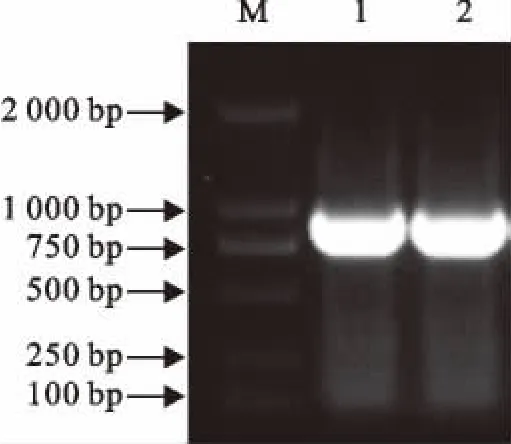
图4 EtSir2基因序列的PCR扩增产物电泳分析Fig.4 Electrophoresis analysis of PCR Products of EtSir2gene
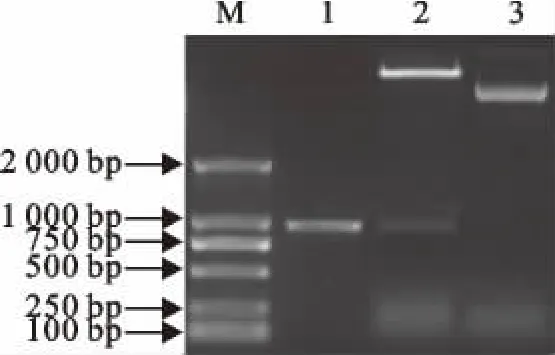
图5 pET43a-EtSir2的酶切鉴定Fig.5 Identification of pET43a-EtSir2by enzyme digestion
2.5 诱导表达与蛋白纯化
将构建好的pET43a-EtSir2转化至E.coli Rosseta(DE3),37℃培养至OD值0.5时加入IPTG至终浓度为1mmol/L诱导表达,转移至16℃摇床160r/min培养18h。将收集菌体重悬于细胞裂解液,在260W功率下超声裂解15min。高速离心分离上清和沉淀,经SDS-PAGE检测目的蛋白的表达水平及可溶性,重组表达的蛋白大小约99ku,与预期一致(图6)。
破碎细胞上清液通过Ni亲和层析方法使目的蛋白得到分离(图7)。

图6 pET43a-EtSir2表达产物SDS-PAGE分析Fig.6 SDS-PAGE analysis of pET43a-EtSir2expressed in E.coli
3 讨论
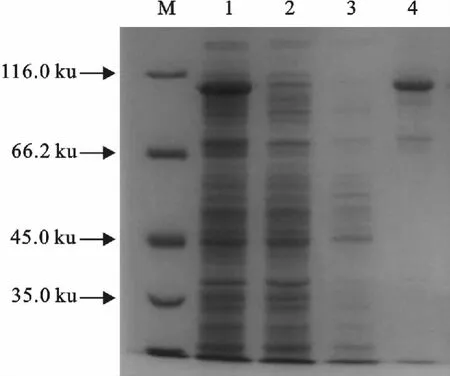
图7 EtSir2蛋白的Ni-NTA纯化Fig.7 Purification of EtSir2with Ni-NTA
组蛋白乙酰基转移酶和组蛋白去乙酰化酶(HDACs)调节组蛋白的乙酰化状态,调控转录、DNA复制和修复的一类蛋白酶,广泛存在于各类生物种[2]。目前依据其生化特性被分为三类,ClassⅠ和ClassⅡ类是依赖于Zn的去乙酰化酶,而ClassⅢ类则是依赖于辅酶NAD+,本文所研究的EtSir2为ClassⅢHDACs,Sir2首先在酵母中被发现,是一种依赖NAD+的去乙酰化酶,广泛存在于古细菌到人类的多种生物细胞中[3,13]。早期,在哺乳动物细胞培养过程中,研究人员发现SIRT2作用于H4K16,H4K16去乙酰化是细胞进入分裂期所必需。此外,North等发现,人SIRT2催化tublin和乙酰CoA合成酶的去乙酰化,提示其参与细胞内物质运输、吞噬和有丝分裂过程[13]。随后研究表明,SIR2参与了肿瘤细胞增殖的调控和细胞转化,可能作为肿瘤抑制因子维持着细胞的正常形态[14]。蜜蜂表达分析研究表明可能参与蜂王表型的调控[15]。近年来,在P.falciparum、T.cruzi和利Leishmania spp等寄生虫中也相继发现Sir2蛋白,并证实是P.falciparum重要的毒力因子[7-8]。由于这类寄生虫的Sir2在蛋白结构上与其宿主具有明显差异,也作为抗寄生虫药物研究的重要靶标成为了研究的热点。
近年来由于抗鸡球虫药物的长期使用,产生了广泛而严重的耐药性,急需新的抗球虫药物出现[16]。鉴于此,本研究对E.tenella基因组数据库进行分析,注释拼接了E.tenella Sir2基因序列,开放阅读框(ORF)为全长909bp,并成功克隆获得EtSir2的全长ORF基因序列。编码氨基酸序列与低等生物具有较高的相似性(42%~58%),说明寄生性原虫拥有保守的Sir2序列,而与高等生物人和鸡的氨基酸序列相似性仅有24%~25%。构建的分子进化树也显示,Et-Sir2与顶复门原虫T.gondii和N.caninum处于同一进化支上,而与高等生物进化关系最远,说明EtSir2在蛋白结构上与其宿主具有明显差异,提示可作为抗寄生虫药物研究的重要靶标。对EtSir2进行在线工具分析,结果显示EtSir2无信号肽序列,没有明确的亚细胞定位,不含有跨膜结构域,结合当前文献有关Sir2蛋白的报道,推测EtSir2为胞浆蛋白,在细胞内发挥作用,可能与柔嫩艾美耳球虫转录调控有关。对EtSir2进行三维结构预测并模拟3D空间构象,结果显示EtSir2蛋白分为大小2个亚基,存在NAD+及Zn2+的保守结合位点,推测EtSir2具有依赖NAD+的去乙酰化酶活性。构建pET43a-EtSir2重组表达载体,进行原核表达并于可溶性上清液分离得到重组蛋白,推测该蛋白具有酶活性,在柔嫩艾美耳球虫基因调控过程中发挥重要作用。
本研究获得了Et Sir2的基因序列,构建了重组质粒pET43a-EtSir2并获得了可溶性重组蛋白,为进一步研究其生物学功能,以及以其作为靶标筛选新型抗球虫药物奠定了基础。
[1]索 勋,李国清.鸡球虫病学[M].北京:中国农业大学出版社,1998.
[2]Imai S,Guarente L.Ten years of NAD-dependent SIR2family deacetylases:implications for metabolic diseases[J].Trends Pharmacol Sci,2010,31(5):212-220.
[3]Chakrabarty S P,Saikumari Y K,Bopanna M P,et al.Biochemical characterization of Plasmodium falciparum Sir2,a NAD+-dependent deacetylase[J].Mol Biochem Parasitol,2008,158(2):139-151.
[4]Wu C S,Chen Y F,Gartenberg M R.Targeted sister chromatid cohesion by Sir2[J].PLoS Genet,2011,7(2):e1002000.
[5]Vendrell A,Martinez-Pastor M,Gonzalez-Novo A,et al.Sir2histone deacetylase prevents programmed cell death caused by sustained activation of the Hog1stress-activated protein kinase[J].EMBO Rep,2011,12(10):1062-1068.
[6]张 霞,巨红妹,李雅杰.沉默信息调节因子2与基因转录调控[J].中国寄生虫学与寄生虫病杂志,2011,29(6):465-468.
[7]Tonkin C J,Carret C K,Duraisingh M T,et al.Sir2paralogues cooperate to regulate virulence genes and antigenic variation in Plasmodium falciparum[J].PLoS Biol,2009,7(4):e84.
[8]Vergnes B,Sereno D,Tavares J,et al.Targeted disruption of cytosolic SIR2deacetylase discloses its essential role in Leishmania survival and proliferation[J].Gene,2005,363:85-96.
[9]Lawson M,Uciechowska U,Schemies J,et al.Inhibitors to understand molecular mechanisms of NAD(+)-dependent deacetylases(sirtuins)[J].Biochim Biophys Acta,2010,1799(10-12):726-739.
[10]Ouaissi M,Ouaissi A.Histone deacetylase enzymes as potential drug targets in cancer and parasitic diseases[J].J Biomed Biotechnol,2006,2006(2):13474.
[11]Sauve A A,Moir R D,Schramm V L,et al.Chemical activation of Sir2-dependent silencing by relief of nicotinamide inhibition[J].Mol Cell,2005,17(4):595-601.
[12]Marks P A,Breslow R.Dimethyl sulfoxide to vorinostat:development of this histone deacetylase inhibitor as an anticancer drug[J].Nat Biotechnol,2007,25(1):84-90.
[13]时小燕,杜丽敏.Sirtuin家族成员及其生物学特性[J].国际药学研究杂志,2011,38(5):349-355.
[14]Chakrabarty S P,Balaram H.Reversible binding of zinc in Plasmodium falciparumSir2:structure and activity of the apoenzyme[J].Biochim Biophys Acta,2010,1804(9):1743-1750.
[15]管 翠,潘其忠,曾志将.sir2、hdac1和ash2基因在西方蜜蜂蜂王蛹与工蜂蛹表达分析[J].中国蜂业,2012,63(Z2):4-7.
[16]李佩国,李蕴玉,贾青辉,等.抗鸡球虫病药物及其耐药性现状[J].河北科技师范学院学报,2011,25(4):34-39.
