小鼠海马发育过程中丝切蛋白及其磷酸化调节基因表达差异分析
2013-06-17胡新德刘笙腩李玲玲宋玲珍柴学军陈树林赵善廷
胡新德,张 伟,刘笙腩,李玲玲,宋玲珍,柴学军,陈树林,赵善廷*
(1.西北农林科技大学动物医学院,陕西杨凌712100;2.德国弗莱堡大学医学院解剖研究所,弗莱堡79104)
丝切蛋白(cofilin)是一种存在于真核细胞生物中的小分子(19ku)肌动蛋白分子结合蛋白,它通过对肌动蛋白的解聚作用使G-actin能被循环使用,从而保证F-actin能快速解聚和聚合,引起细胞肌动蛋白骨架重组,促进细胞运动和迁移[1-4]。在F-actin尾端切割卸载G-actin的能力和活性受丝切蛋白N末端第3位点丝氨酸(serine 3,Ser3)磷酸化状态的调控。当Ser3处于非磷酸化状态时,丝切蛋白具有切割F-actin的活性,而当Ser3被磷酸化时,丝切蛋白则失去切割F-actin的能力,因此,丝切蛋白Ser3位点的磷酸化/去磷酸化状态在F-actin的解聚和聚合方面起着开关的作用[5-8]。而丝切蛋白的磷酸化状态直接受LIMK(LIM kinase)和TESK(testisspecific protein kinase)家族蛋白激酶的调控,LIMK家族包括LIMK1和LIMK2,是神经系统中丝切蛋白的主要蛋白激酶,通过调节丝切蛋白的活性调节发育过程中actin的活动,而TESK 家族蛋白激酶则主要是在生殖系统中表达[9-11]。而去磷酸化状态主要 受SSH(slingshot)家 族(SSH1、SSH2 和SSH3)和CIN(chronophin)的调控。SSH 广泛分布在哺乳动物的各种组织中,CIN 磷酸酶则主要分布在神经系统中,是神经系统中丝切蛋白的主要去磷酸化酶[12-13]。
目前,研究表明丝切蛋白与神经元的突触可塑性,与学习和记忆,先天无脑回畸形,癫痫以及神经分裂症等密切相关[14-15]。在海马发育过程中,诸多因素通过调节丝切蛋白的Ser3磷酸化状态从而调节神经元的迁移,纤维联系的建立以及突触的形成等过程[16]。然而在海马发育过程中丝切蛋白以及其磷酸化状态调节基因的表达量变化模式目前尚无系统研究。本研究通过提取不同时期小鼠海马组织总RNA,以GAPDH 为内参通过半定量PCR 系统研究了海马发育不同时期丝切蛋白的表达量变化趋势以及丝切蛋白磷酸化和去磷酸化基因的表达量变化趋势,为进一步研究丝切蛋白在神经系统发育过程中的功能及其在神经系统中的活性调节奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 昆系健康小鼠购自西安交通大学实验动物中心,饲养于西北农林科技大学超净鼠房,在3月龄左右交配,交配成功后孕鼠单独饲养至小鼠出生。将小鼠出生时记为P0(postnatal 0 day),并将出生后的小鼠分为5组,每组3只,分别饲养至不同的年龄,即P0,P7,P14,P28,P60。
1.1.2 主要试剂及仪器设备 Trizol及总RNA提取相关试剂购自Invitrogen公司;反转录试剂盒购自Fermentas公司;2×TaqPCR StarMix购自GeneStar;DEPC 原液,Sigma公司产品分装;琼脂糖购自HydraGene 公司;高速冷冻离心机购自Eppendorf公司;Mycycle型PCR 仪购自Bio-Rad公司;超微量分光光度计购自日本岛津公司;ChampChemi型凝胶成像分析系统购自北京赛智公司。
1.2 方法
1.2.1 RT-PCR 引物设计 利用Primer premier 5.0软件,根据NCBI上公布的基因序列跨内含子设计PCR 引物,同时以GAPDH 为内参,引物由上海生工生物工程技术服务有限公司合成,引物序列见表1。

表1 PCR用引物Table 1 The of primers for PCR
1.2.2 海马剥离、总RNA 提取及反转录 将不同时期(P0、P7、P14、P28、P60)的小鼠断颈处死,小心取出脑组织,用解剖刀剥离海马,立即放入液氮中研磨至无可见颗粒为止,将粉末转移至DEPC 处理的新离心管内,按照Invitrogen 公司RNA 提取试剂盒上的说明书操作步骤提取组织样品总RNA,经超微量分光光度计测定RNA 浓度后,保存于-80 ℃冰箱备用。取不同时期的小鼠海马组织总RNA 各2.5μg进行反转录。反转录体系为:总RNA 2.5μg,5×Reaction buffer 4μL,Oligo(dT)2μL,10 mmol/L dNTPs 1μL,RNase Inhibitor 1μL,RT-Enzmye 1μL,用DEPC水补足20μL体系。42 ℃反应1h,70 ℃5min灭活,保存于-20 ℃备用。
1.2.3 半定量PCR 扩增 取1μL 不同时期海马组织反转录产物,稀释后用超微量分光光度计测定cDNA 浓度,以GAPDH为内参,调整cDNA 模 板加入量,将内参基本调节一致后按照调整后的模板加入量扩增不同的基因片段。PCR 体系:2×TaqPCR StarMix 10μL,F-Primer 0.75μL,R-Primer 0.75μL,cDNA xμL,用ddH2O 补足20μL 体系。PCR反应程序参数:95℃5min,95℃30s,Tm(表1)30s,72℃30s,30 个循环。反应结束后,取15μL PCR 产物经15g/L凝胶电泳分析。
1.2.4 图片及数据分析 图片通过Image J软件分析各条带灰度值,将电泳条带亮度转换为数值,通过内参GAPDH 对样品进行标准化,将各基因PCR灰度值/GAPDH 灰度值得到一个相对比值ω。将同一基因在海马发育的不同时期的ω值作图分析,得到不同基因在海马发育的不同时期的表达量变化趋势。
2 结果
2.1 小鼠海马发育不同时期丝切蛋白表达量变化
从图1可以看出,在小鼠海马发育不同时期丝切蛋白表达量整体都很高,在P0 时期丝切蛋白的表达量最高,而且在P0~P7这段时间内其表达基本稳定不变。随着海马的发育成熟丝切蛋白的表达量逐渐降低,但结果显示其表达量在不同发育时期变化并不大,P0时期丝切蛋白的表达量约为P60时期的1.37倍(n=3)。
2.2 小鼠海马发育不同时期丝切蛋白磷酸化基因表达量变化
LIMK 是神经系统中丝切蛋白的主要激酶,能使丝切蛋白磷酸化从而调节其活性。在小鼠海马发育过程中丝切蛋白的表达量变化并不大,但如图2所示,LIMK 表达量变化却极为显著,在P0 时期LIMK1的表达量明显高于P60时期,从P0到P14 LIMK1表达量显著下降,P0时期LIMK1的表达量是P14 时 期 的5.05 倍(n=3),而P14 到P60 LIMK1的表达量仅略微下降,P14时期LIMK1表达量为P60时期LIMK1表达量的1.75倍(n=3)。TESK1在海马中几乎无表达,而LIMK2和TESK2的表达量则基本维持不变。
2.3 小鼠海马发育不同时期丝切蛋白去磷酸化基因表达量变化
从图3中可以看出,在小鼠海马发育的不同时期丝切蛋白去磷酸化基因的表达量变化也很明显,在神经系统中CIN 是丝切蛋白的主要去磷酸化基因,其表达量从P0 到P60 逐渐升高,在P60 时期CIN 的表达量约是P0时期CIN 表达量的2.88倍(n=3)。在神经系统中SSH 蛋白家族对丝切蛋白的去磷酸同样发挥很重要的作用,其中SSH3表达量的变化最为明显,P7 时期SSH3 的表达量约是P0时期的7.4倍(n=3),而到P14时期SSH3的表达量约是P0时期的26.5倍(n=3)。SSH 蛋白家族中的SSH1和SSH2在这个过程中的表达量变化不明显。

图1 小鼠海马不同发育时期丝切蛋白表达量变化Fig.1 The expression changes of cofilin in different development stages of mouse hippocampus
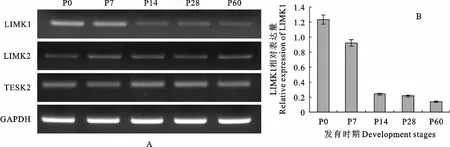
图2 小鼠海马不同发育时期丝切蛋白磷酸化基因表达量变化Fig.2 The expression changes of cofilin phosphorylation genes in different development stages of mouse hippocampus
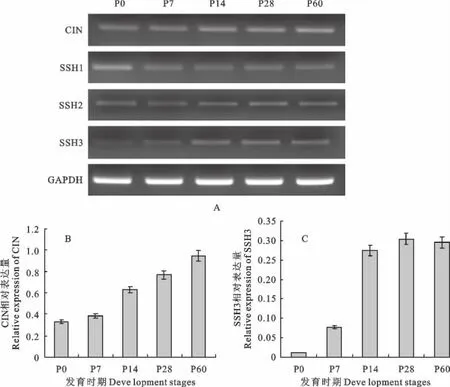
图3 小鼠海马不同发育时期丝切蛋白去磷酸化基因表达量的变化Fig.3 The expression changes of cofilin dephosphorylation genes in different development stages of mouse hippocampus
3 讨论
微丝的动态稳定性调节与小鼠海马发育过程中细胞分裂,神经元迁移,树突和轴突的生长以及突触的形成等过程密切相关。在小鼠海马发育过程中,P0~P7主要发生的是细胞的分裂增殖和神经元迁移;P7~P14细胞开始长出大量的突起,开始建立细胞间的突触联系;P14之后主要是神经元间建立突触联系以及学习记忆功能的完善过程。丝切蛋白是中枢神经系统中最主要的肌动蛋白解聚因子,调节微丝的动态稳定性,参与细胞分裂,神经元迁移,树突和轴突的生长以及突触的形成等生命活动[17]。本研究结果显示在小鼠海马发育整个过程中丝切蛋白一直处于高表达状态,随着海马的发育成熟其表达量只是略微降低,说明丝切蛋白在中枢神经系统发育以及功能维持中有重要的作用。然而,丝切蛋白磷酸化和去磷酸化基因在这个过程中的表达量差异却很大。从P0到P14时期,LIMK1的表达量显著下降,而从P14到P60LIMK1 的表达量仅略微下降,而且LIMK2的表达量变化不明显。这可能是因为LIMK1是海马发育过程中丝切蛋白的主要激酶,机体主要通过调节LIMK1来实现对丝切蛋白局部磷酸化的调节,P0到P14时期是其表达量迅速变化的时期而此时也正是海马快速发育的时期。有研究表明,LIMK2在神经系统的中的表达量明显低于LIMK1,LIMK1 是神经系统中ADF/丝切蛋白的主要激酶[18],本试验结果也从另一个角度证实了这一点。P0到P7时期较高水平的LIMK1和低表达水平的CIN/SSH3 将导致较高水平的p-cofilin,这可能与细胞分裂增殖和神经元迁移过程中保持微丝的动态稳定性有关。在P14到P60时期,丝切蛋白 的表达量略微降低,但CIN/SSH3的表达量很高而LIMK1 的表达量则维持在一个较低的水平。CIN 是中枢神经系统中重要的丝切蛋白磷酸酶,对丝切蛋白的局部活性调节有至关重要的作用[15]。CIN/SSH3表达量的上升以及LIMK 表的量的降低将导致丝切蛋白的活性增高,在这个时期丝切蛋白的总量是降低的,而它的活性的增高可能与海马神经元间纤维联系的建立以及突触的形成等需要精细调控的过程密切相关。
在神经系统发育过程中LIMK 本身也受上游信号分子的调控,经典途径是RhoGTPase/ROCK/LIMK/cofilin/ADF信号通路[19],而CIN/SSH 家族蛋白本身的调控目前尚不清楚。本研究从转录水平研究了海马发育过程中丝切蛋白的表达情况,表明在小鼠海马发育过程中机体不但在翻译后修饰水平对丝切蛋白进行调控,而且在转录水平对丝切蛋白进行调控,但具体机制尚不清楚。同时,本研究还从转录水平研究了丝切蛋白活性调节基因的表达,表明在小鼠海马发育过程中除了经典的RhoGTPase/ROCK/LIMK/cofilin 途径调节微丝的动态稳定性外,还存在某种未知机制通过调节LIMK、CIN、SSH 家族蛋白的表达来调节丝切蛋白的活性,从而实现复杂的生命活动调控。
本文从转录水平研究了海马发育过程中丝切蛋白及其磷酸化与去磷酸化基因的表达水平,从另一个角度阐明了海马发育过程中丝切蛋白对微丝的动态稳定性调节,为阐明丝切蛋白在神经系统发育中的作用及其活性调节提供了一个新的思路。
[1]Nishida E,Maekawa S,Sakai H.Cofilin,aprotein in porcine brain that binds to actin filaments and inhibits their interactions with myosin and tropomyosin[J].Biochemistry,1984,23(22):5307-5313.
[2]Endo M,Ohashi K,Sasaki Y,et al.Control of growth cone motility and morphology by LIM kinase and slingshot via phosphorylation and dephosphorylation of cofilin[J].J Neurosci,2003,23:2527-2537.
[3]Kiuchi T,Ohashi K,Kurita S,et al.Cofilin promotes stimulusinduced lamellipodium formation by generating an abundant supply of actin monomers[J].J Cell Biol,2007,177:465-476.
[4]Bernstein B W,Bamburg J R.ADF/cofilin:a functional node in cell biology[J].Trends Cell Biol,2010,20(4):187-195.
[5]Moriyama K,Iida K,Yahara I.Phosphorylation of Ser-3of cofilin regulates its essential function on actin[J].Genes Cells,1996(1):73-86.
[6]Oleinik N V,Krupenko N I,Krupenko S A.ALDH1L1inhibits cell motility via dephosphorylation of cofilin by PP1and PP2A[J].Oncogene,2010,29(47):6233-6244.
[7]Zhang L,Luo J,Wan P,et al.Regulation of cofilin phosphorylation and asymmetry in collective cell migration during morphogenesis[J].Development,2011,138(3):455-464.
[8]Chai Xuejun,Forster E,Zhao Shanting,et al.Reelin stabilizes the actin cytoskeleton of neuronal processes by Inducing n-cofilin phosphorylation at serine3[J].J Neurosci,2009,29(1):288-299.
[9]汤飞鸽,颜崇淮,沈晓明.LIM 激酶1的研究进展[J].国际病理科学与临床杂志,2005,25(4):339-341.
[10]Toshima J,Ohashi K,Okano I,et al.Identification and characterization of a novel protein kinase,TESK1,specifically expressed in testicular germ cells[J].J Biol Chem,1995,270(52),31331-31337.
[11]R∅sok Ø,Pedeutour F,Ree A H,et al.Identification and characterization of TESK2,a novel member of the LIMK/TESK family of protein kinases,predominantly expressed in testis[J].Genomics,1999,61:44-54.
[12]Gohla A,Birkenfeld J,Bokoch G M.Chronophin,a novelHAD-type serine protein phosphatase,regulates cofilin-dependent actin dynamics[J].Nature Cell Biol,2005,7(1):21-29.
[13]赵 微,苏玉虹,巴彩凤,等.Cofilin 蛋白功能及活性调节[J].中国生物化学与分子生物学报,2007,23(9):706-710.
[14]孙嘉璐,苏玉虹.Cofilin与疾病相关性[J].辽宁医学院学报,2010,31(4):359-362.
[15]魏 风,陈 俭.Cofilin 与学习记忆的研究进展[J].医学综述,2012,18(1):10-13.
[16]Huang T Y,DerMardirossian C,Bokoch G M.Cofilin phos-phatases and regulation of actin dynamics[J].Curr Opi Cell Biol,2006,18:26-31.
[17]徐 阳,原丽平,陈金铃,等.肌动蛋白解聚因子/cofilin功能的研究进展[J].生命科学,2012,24(1):13-18.
[18]Menga Y,Takahashi H,Meng J,et al.Regulation of ADF/cofilin phosphorylation and synaptic function by LIM-kinase[J].Neuropharmacology,2004,47:746-754.
[19]Meberg P J.Signal-regulated ADF/cofilin activity and growth cone motility[J].Mol Neurobioly,2000,21:97-107.
