光学相干断层显像联合血流储备分数在冠状动脉临界病变中的应用
2013-06-23陈少伯赵季红梁国庆姜铁民李玉明
陈少伯,赵季红,梁国庆,姜铁民,李玉明
冠状动脉临界病变在冠心病介入治疗领域一直备受争议,介入治疗的指征也不明确。冠状动脉血流储备分数(fractional flow reserve,FFR)是判断冠状动脉具有功能意义缺血的可靠手段,目前已成为指导介入治疗的金标准。光学相干断层显像(optical coherence tomography,OCT)在临床也逐渐盛行,但是OCT大多用于评价斑块的稳定性和介入治疗后的即刻效果,OCT用于临界病变进而指导介入治疗的参考标准是什么,目前少有研究。本研究以FFR为参照,联合应用OCT于冠状动脉临界病变,其目的主要在于分析二者评判冠状动脉缺血的相关性,探讨指导冠状动脉临界病变介入治疗的适宜标准。
1 对象与方法
1.1 病例选择和分组
2010年6月至2012年6月,收集96例冠状动脉造影直径狭窄率为40%~70%、符合临界病变标准诊断[1]并同意行OCT和FFR检查患者,以FFR数值<0.75为界,分为FFR正常组67例和FFR异常组29例。两组患者临床资料和冠状动脉病变分布具可比性,见表1。
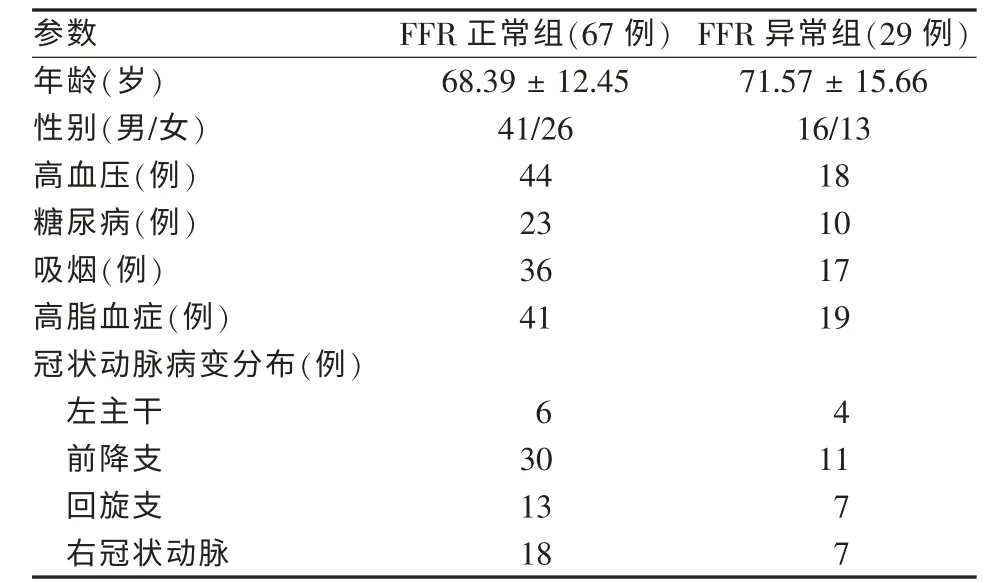
表1 两组患者临床资料
1.2 FFR检查方法
所有患者均从右或左桡动脉进行冠状动脉造影,对冠状动脉造影显示直径狭窄率在40%~70%的患者行FFR检查。选择6 F(1 F≈0.33 mm)指引导管,体外连接Certus多普勒压力导丝和RADIANALYZERX FFR测定仪(S.T Jude Medical,Sweden)。先行主动脉压校零和体外压力导丝调零,然后将压力导丝送至病变远端,校准Pa(冠脉口部或主动脉根部平均压力)和Pd(压力导丝的平均压力)。静脉以140μg·kg-1·min-1剂量微泵泵入腺苷,给药30~60 s待冠状动脉达到最大扩张状态时,记录FFR值,最后回撤压力导丝使压力传感器至导引导管口,验证Pa和Pd无漂移(保证Pa和Pd压差在±5 mmHg以内)。
1.3 OCT检查方法和相关参数定义
具体操作参照姜铁民等[2]介绍的方法。充分排出HelioesTM阻断球囊导管中的空气后,沿导丝将其送入目标血管段,Y型阀边孔与注射泵相连。撤出导丝,沿HelioesTM球囊内腔送0.014英寸(1英寸=2.54 cm)LightLab光纤成像导丝,导丝头端距球囊头端约50 mm,成像导丝尾端通过链接部件(PIU)连于C7-XR OCT成像系统(HelioesTM球囊,成像导丝和OCT成像系统均由美国LightLab公司生产)。开启注射泵,以30 ml/min泵入生理盐水,0.3~0.6 atm加压扩张HelioesTM球囊,阻断血流。PIU以20 mm/s速度自动回拉成像导丝,进行OCT扫描。录存图像脱机分析。
OCT斑块性状分类:①脂质斑块,表现为边界模糊的弱信号;②纤维斑块,表现为均质的强信号区;③钙化斑块,表现为边界清晰的较弱信号区。
测量指标:斑块面积(plaque area,PA),病变部位最小管腔面积(minimal lumen area,MLA),管腔面积狭窄率(percent lumen area stenosis,PLA),脂核面积在斑块面积所占百分比(percentage of lipid core area,PLCA)和最薄纤维帽厚度(fibrous cap diameter,FCD)。
1.4 统计方法
2 结果
2.1 两组OCT参数比较
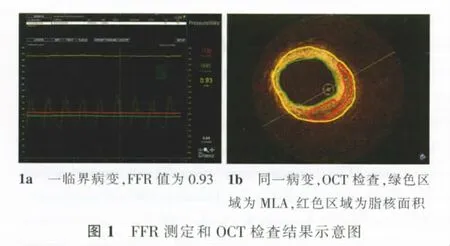
两组OCT检查参数比较,PA和FCD差异无统计学意义(P>0.05),MLA、PLA和PLCA差异有统计学意义(P<0.05或<0.01),表现为FFR异常组MLA小,PLA率更大,PLCA所占比重大(表2)。OCT和FFR检查结果示意图见图1。
表2 两组患者IVUS-VH参数(±s)
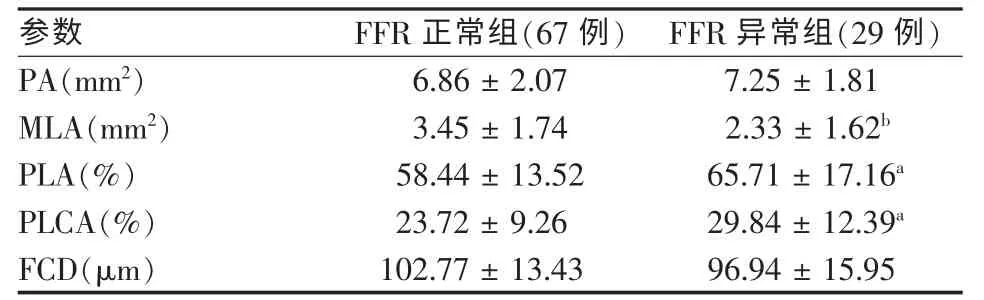
表2 两组患者IVUS-VH参数(±s)
PA=斑块面积,MLA=病变部位最小管腔面积,PLA=管腔面积狭窄率,PLCA=脂核面积在斑块面积所占百分比,FCD=最薄纤维帽厚度,与FFR正常组比,a P<0.05,b P<0.01
?
2.2 OCT参数和FFR的相关性分析
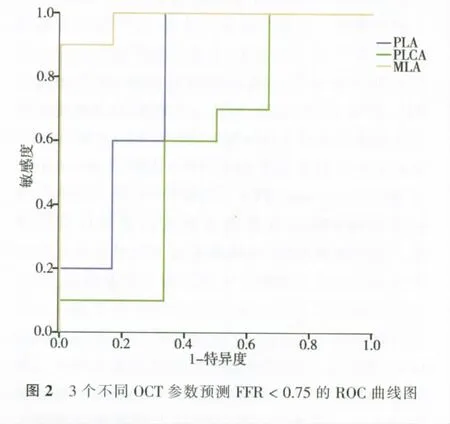
合并分析所有患者的FFR数值和OCT参数,并绘制ROC曲线。发现MLA、PLA和PLCA与FFR有统计学相关(P<0.05或<0.01),其余参数无统计学相关(P>0.05),见表3。以MLA<2.30 mm2预测FFR<0.75的敏感度为92.51%,特异度为78.43%,PLA>70%预测FFR<0.75的敏感度为90.64%,特异度为82.35%,PLCA>25%预测FFR<0.75的敏感度为70.18%,特异度为62.74%,见图2。
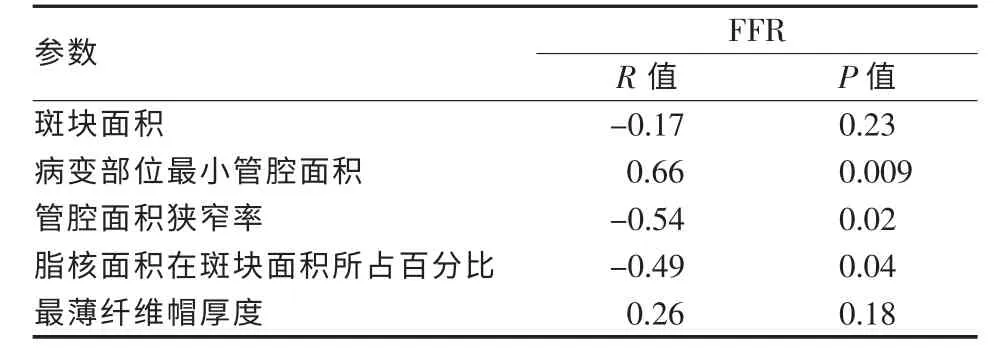
表3 两组OCT参数与FFR的相关系数
3 讨论
冠状动脉临界病变是指冠状动脉造影显示直径狭窄率在40%~70%的病变[1]。对于这类病变,是否需要介入治疗,临床很难决策,现状是国内绝大多数医院用血管内超声(intravenous ultrasound,IVUS)指导治疗,但是以IVUS指导治疗有较高的假阳性率,会导致过度介入治疗[3]。所以,探索新的评价手段是增加介入治疗可靠性的有效手段。1995年Pijls等[4]首次提出FFR的概念,其定义为狭窄冠状动脉支配区域心肌最大血流量与同一支冠状动脉无狭窄处心肌最大血流量的比值。计算公式为:FFR=Pd/Pa,当以FFR<0.75为标准时,预测心肌缺血的敏感度达88%,特异度100%,阳性预测值为100%,准确性为93%[5]。FFR是目前判断心肌缺血、指导介入治疗的新的“金标准”[6]。有鉴于此,目前国内外指南均建议,针对临界病变,应常规进行FFR检查,以指导临床治疗决策。
OCT是近年发展起来的一门新影像技术,在心血管领域逐步用于临床。相比较于IVUS,OCT的主要优势主要体现在以下方面:①极高的分辨率,OCT在体内的分辨率达到10μm×25μm,相比较而言,IVUS的分辨率只有100μm×100μm。正是由于OCT极高的分辨率使其能清楚分析器官组织结构,更有人为此把OCT称为“光活检”。②光导纤维结构简单,价格便宜,成像系统可便携式使用。③OCT系统中没有传感器,只有光导纤维,使OCT导管直径可以做得很小,目前最小的OCT导管直径只有0.014英寸[7-8]。OCT目前在临床主要用于斑块的形态学研究,而忽视了其判断冠状动脉供血状况的功能学价值,已有少数研究表明OCT和FFR有很好相关性[9],但是有关OCT指导临界病变的介入治疗标准少有研究。我们的研究发现,OCT测量的MLA、PLA和PLCA在FFR正常组和FFR异常组间差异有统计学意义(P<0.05或P<0.01),MLA、PLA和PLCA与FFR显著相关(P<0.05或P<0.01),以MLA<2.3 mm2、PLA>70%和PLCA>25%作为标准预测FFR<0.75具有较高的敏感度和特异度。说明斑块性状、结构和组成与冠状动脉血供密不可分,在OCT判断斑块稳定与否的基础上,结合适宜的面积参数作为标准指导临界病变的介入治疗在临床是可行的。以往的几项大型研究提出的IVUS指导介入治疗的截点是冠状动脉大分支(前降支、回旋支和右冠脉)MLA<4.0 mm2[10],但是采用“4.0 mm2标准”,会使20%以上的患者过度介入治疗,所以有学者提出临界病变IVUS介入治疗的截点应该严格到“2.8 mm2标准”,本研究结果以OCT MLA<2.30 mm2作为预测缺血标准,和IVUS“2.8 mm2标准”有相似的敏感度和更高的特异度[11]。3个OCT参数中,MLA和PLA预测FFR<0.75的准确性较高,PLCA相对次之。脂核面积大小与FFR相关可能有多种因素,推测其主要原因包含:①较大的脂核直接影响管腔面积,影响血管重构。②较大的脂核有更重的炎症反应,加剧刺激病变内皮分泌缩血管物质,导致病变部位血管对腺苷反应减弱。③OCT对脂核的分辨精度一般,不排除测量误差。
本研究是在我院进行的单中心研究,样本例数有限,各种数据难免出现偏倚,研究结果能否推广,需要更大样本的多中心研究证实。
[1]Patil CV,Beyar R.Intermediate coronary artery stenosis:evidence-based decisions in interventions to avoid the oculostenotic reflex[J].Int J Cardiovasc Intervent,2000,3:195-206.
[2]姜铁民,陈少伯,梁国庆,等.OCT和IVUS在冠状动脉病变诊断中的对比研究[J].天津医药,2007,35:338-340.
[3]Ben-Dor I,Torguson R,Deksissa T,et al.Intravascular ultrasound lumen area parameters for assessment of physiological ischemia by fractional flow reserve in intermediate coronary artery stenosis[J].Cardiovasc Revasc Med,2012,13:177-182.
[4]Pijls NH,Van Gelder B,Van der Voort P,et al.Fractional flow reserve.A useful index to evaluate the influence of an epicardial coronary stenosis on myocardial blood flow[J].Circulation,1995,92:3183-3193.
[5]Pijls NH,De Bruyne B,Peels K,et al.Measurement of fractional flow reserve to assess the functional severity of coronary-artery stenoses[J].N Engl J Med,1996,334:1703-1708.
[6]Trana C,Muller O,Eeckhout E.Coronary artery disease diagnostic with fractional flow reserve[J].Rev Med Suisse,2011,7:1182-1188.
[7]陈少伯,梁国庆,姜铁民,等.OCT在冠心病介入治疗中应用的研究进展[J].武警医学院学报,2008,17:921-923.
[8]Karanasos A,Ligthart J,Witberg K,et al.Optical coherence tomography:potential clinical applications[J].Curr Cardiovasc Imaging Rep,2012,5:206-220.
[9]Gonzalo N,Gonzalo N,Escaned J,et al.Morphometric assessment of coronary stenosis relevance with optical coherence tomography:a comparison with fractional flow reserve and intravascular ultrasound[J].J Am Coll Cardiol,2012,59:1080-1089.
[10]Briguori C,Anzuini A,Airoldi F,et al.Intravascular ultrasound criteria for the assessment of the functional significance of intermediate coronary artery stenoses and comparison with fractional flow reserve[J].Am J Cardiol,2001,87:136-141.
[11]Ben-Dor I,Torguson R,Gaglia MA Jr,et al.Correlation between fractional flow reserve and intravascular ultrasound lumen area in intermediate coronary artery stenosis[J].Eurointervention,2011,7:225-233.
