球扩式主动脉瓣腔内置换术治疗五例主动脉瓣狭窄经验
2013-06-23陆清声洪毅吴宏王志农李卫萍张勇学李南马宇秦永文景在平
陆清声,洪毅,吴宏,王志农,李卫萍,张勇学,李南,马宇,秦永文,景在平
体外循环下行人工主动脉瓣置换术是目前治疗主动脉瓣狭窄病变最主要的方法,随着麻醉技术、体外循环和人工瓣膜等技术和设备的不断改进,手术方法及治疗技术日趋完善。但是开放手术本身的技术局限决定了手术带来的巨大创伤,炎症应激等诸多危险因素对患者而言仍是不可回避的风险。对一些高龄、体质差或合并其他系统严重疾病、无法耐受开胸手术或存在手术禁忌证的患者而言,只能放弃外科治疗或继续内科保守治疗。
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)的出现是主动脉瓣疾病外科治疗的新突破。这一技术的研究最早始于20世纪90年代[1],于2002年完成第1例人体手术[2]。迄今,比较成熟的产品主要有2大类型:分别是Cribier-Edward生物瓣(球囊扩张支架瓣膜)和CoreValve生物瓣(自膨式支架瓣膜)。手术方式及路径选择可分为经股静脉、经股动脉及经心尖[3-4]。
本文报道应用经股动脉球扩式主动脉瓣腔内置换技术(transfemoral balloon dilated aortic valve replacement,TBDAVR)治疗5例严重主动脉瓣狭窄患者的初步经验。
1 材料与方法
1.1 临床资料
2011年至2012年应用TBDAVR和器具,对5例严重主动脉瓣狭窄患者进行了腔内微创治疗,患者资料见表1,术前通过经胸心脏彩色多普勒超声(TTE)、冠状动脉造影(CAG)、主动脉CTA、肺功能等检查评估患者主动脉瓣病变情况和其他并存病及身体状况等,确定符合TAVR手术指证,并无禁忌证。
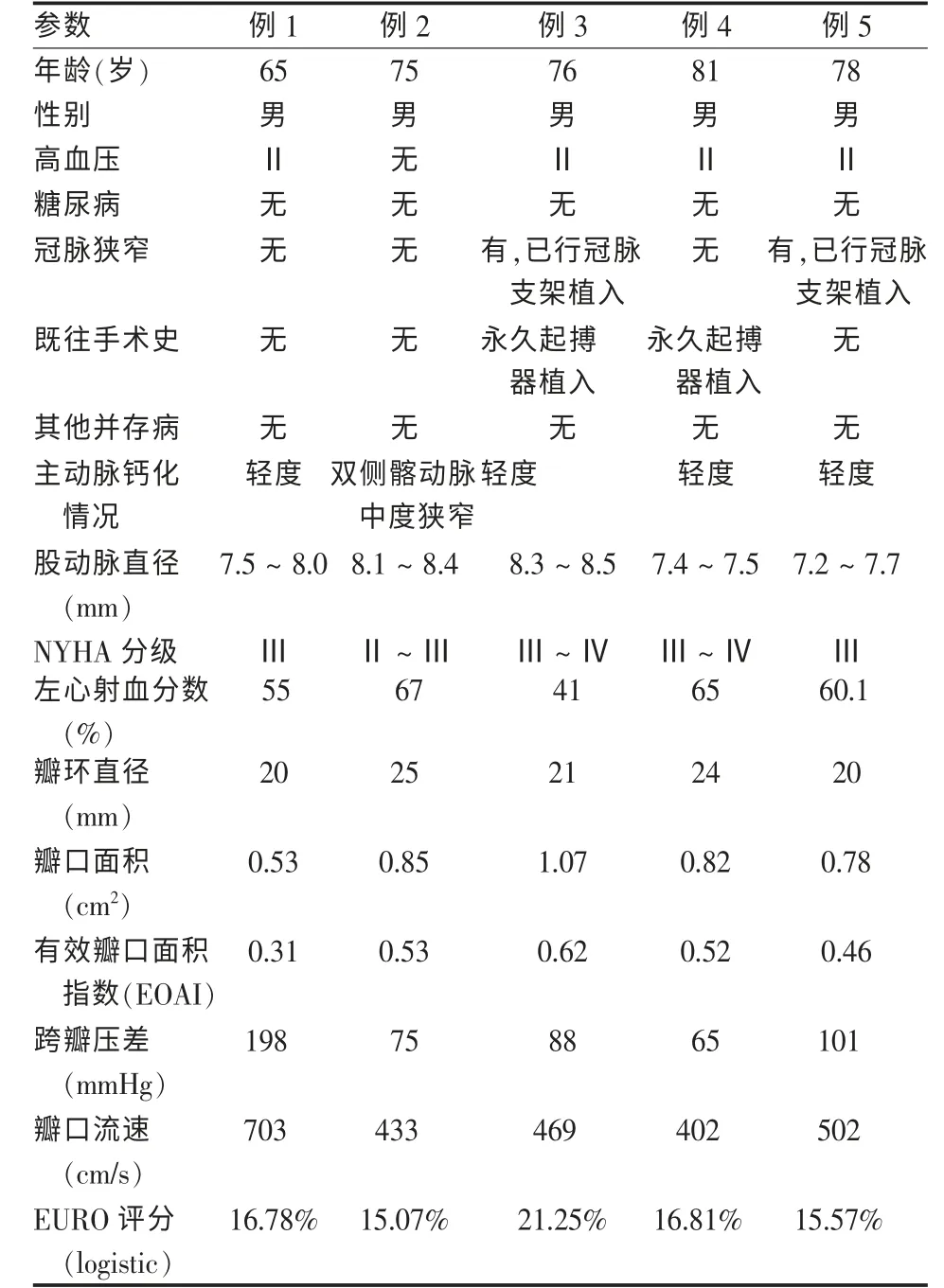
表1 患者资料及术前评估
1.2 手术方法
瓣膜材料采用第3代Edward生物瓣(球扩式支架瓣膜)——Edwards SAPIEN XT Transcatheter Heart Valve。5例患者均采用气管插管全麻[5]。麻醉成功后,用经食管超声(transesophageal echocardiographic,TEE)再次评估主动脉瓣瓣环直径、瓣膜功能、大小、钙化程度等情况。行一侧股静脉穿刺,顺行放置临时起搏导线至右心室,接临时起搏器备用。行同侧股总动脉穿刺,0.035英寸直头导丝引导5 F pigtail导管至主动脉瓣口处造影,显示主动脉瓣(图1)、冠状动脉开口、升主动脉、主动脉弓及弓上分支动脉及部分降主动脉。穿刺另一侧股总动脉,0.035英寸直头导丝配合5 F导管进至主动脉瓣开口,导丝通过主动脉瓣口入左心室,导管通过主动脉瓣口,交换0.035英寸260 cm Amplatz超硬导丝,退出导管交换预扩球囊至主动脉瓣,人工起搏心率至180次/min,血压降至60 mmHg左右,脉压差小于10 mmHg后,球囊充分扩张后回缩,恢复自主心率及血压,退出球囊。经超硬导丝导入SAPIEN XT Transcatheter Heart Valve输送系统,将球扩式支架瓣膜精确定位至主动脉瓣瓣环部位,再次人工起搏心率至180次/min,血压降至60 mmHg左右,脉压差小于10 mmHg后,瞬间充分扩张球囊,释放瓣膜,回缩球囊,恢复自主心率及血压,退出输送系统。X线透视下观察支架瓣膜位置、形态,固定良好。

图1 人工瓣膜植入前
TEE及造影显示球扩式支架瓣膜工作良好(图2),冠状动脉开口良好。依次退出全部导管及导丝,Proguide封堵器闭合动脉穿刺口。
图2 人工瓣膜植入后
2 结果
5例手术均成功,其中1例经股动脉导丝无法通过主动脉瓣膜,行心尖穿刺,抓捕器自左心室通过主动脉瓣,将主动脉内导丝抓入左心室。
术后患者生命体征平稳,术后第1天即可下床活动,无并发症,术后3~5 d出院。随访6个月,患者均可生活自理,无心率失常,无瓣膜感染及移位。术后心功能评估对比情况见表2。
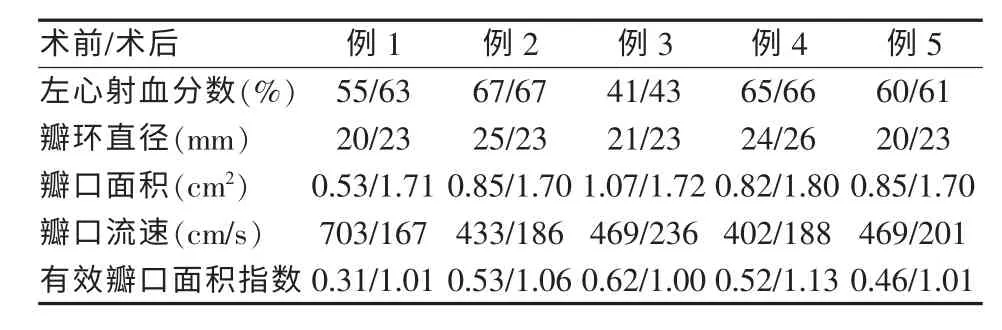
表2 术前、术后心脏各参数对照
3 讨论
入选的5例都为主动脉瓣重度狭窄患者,瓣膜钙化严重。Euro评分(logistic)大于15%,手术指征明确。5例患者都曾在心胸外科就诊,由于心、肺等脏器功能不全无法耐受外科瓣膜置换手术,经评估风险极高[6]。经TBDAVR术前评估认为,手术指征明确,无明显禁忌证,可行TBDAVR手术。
3.1 经股动脉路径的优点及难点
股动脉途径也称逆行法,Webb等[7]报道18例有高危外科手术风险患者,经股动脉路径,在原瓣膜处置入主动脉瓣膜支架,其中14例置入成功,血流动力学明显改善。本组5例手术均采用经股动脉路径,我们认为,另2种路径(经静脉,经心尖)都需穿刺心肌(房间隔或心尖部左心室),仍有一定的心脏损伤,在一定程度上加大了围手术期的手术风险[8]。经股动脉路径优点在于操作简单,与主动脉、冠状动脉等其他介入手术路径类似,有一定的技术兼容性[9]。目前导入系统已发展至18 F,口径更小,对股动脉直径的要求更低,同时损伤也更小[10]。
另一方面,经股动脉路径在操作过程中也存在一些另2种路径能较好规避的技术难点,例如,髂股动脉及主动脉扭曲狭窄,造成导入系统输送困难。5例中有1例造影提示股动脉内径为8.0 mm左右,髂总动脉狭窄(动脉硬化)内径为5.0 mm左右。随后于球囊扩张后,导入系统成功通过[7]。其次,经股动脉路径方式决定了术中导丝及导管需逆行通过狭窄的主动脉瓣口,在逆向血流和压力的作用下,导丝和导管通过主动脉瓣口的难度将成倍增加,在手术过程中可能会花费大量时间,甚至仍无法通过瓣口,以至于更换手术方式或放弃手术[11-12]。因此,对术者的经验及技术要求相对较高。5例中,有1例由于主动脉瓣口严重狭窄,在多次尝试后,导丝仍无法逆行通过瓣口,随后侧开胸,超声引导下,心尖部穿刺置入5 F短鞘后,导入抓捕器自左心室通过主动脉瓣,将主动脉内导丝抓入左心室,完成手术。
3.2 术前评估
术前评估对于TBDAVR的患者尤为重要,与常规术前检查相比有更高的要求。
3.2.1 心脏彩色多普勒超声心脏彩色多普勒超声主要用于评估患者心脏结构和功能状况,包括各心腔大小、心肌厚度、运动情况;各瓣膜的形态及功能状况,尤其是主动脉瓣的瓣环直径、瓣口面积、返流面积、返流流速、跨瓣压差、钙化情况等;心内有无赘生物及其他异常结构(左房黏液瘤、瓣下隔膜、假腱索等)[13]。可以认为心脏彩色多普勒超声是评估和筛选患者的第一项关键检查。心脏彩色多普勒超声的主要检查方法可分为TTE和TEE 2种方式。在国内,TTE更为常用,因其无创,操作更简便、安全,但在某些方面不如TEE准确[14]。TEE在测量心内各项指标时更准确,而且,在TAVR术中仍需TEE全程监测,术前行TEE检查则可使术前、术中及术后的测量数据更加统一,更具参考价值,同时,在一定程度上可提高手术成功率和安全性。因此,在条件允许情况下,推荐TEE作为术前检查方式[15-16]。
对于手术,心脏彩色多普勒超声仍是把握手术适应证的重要参数之一,目前第三代Edward生物瓣主要有3个型号产品,瓣环直径分别为23 mm,26 mm及29 mm。对于国人主要适用前2个型号,因此对患者的主动脉瓣环直径要求在18~25 mm,同时瓣膜病变必须以钙化狭窄为主。瓣环直径过小会导致瓣膜开放不完全,影响瓣膜形态及功能,造成瓣周漏及瓣口返流;瓣环直径过大及非钙化型瓣膜病变会导致瓣膜固定不佳,出现瓣膜移位甚至脱落。这些都有赖于超声的诊断与监测。
3.2.2 CAG目前仍是评价冠状动脉血管病变的金标准。在TBDAVR围手术期发生心肌急性缺血甚至梗死是极为危险的并发症,术前通过CAG检查可确切了解冠状动脉情况,评估手术风险,必要时,可在造影过程中行支架植入或者其他治疗。
通过CAG测量冠状动脉开口与主动脉瓣环间的最小距离。TAVR手术要求患者的冠状动脉开口与主动脉瓣环之间的距离不能小于10 mm,这是由于球扩式支架瓣膜会将原来的病变瓣膜推向瓣窦区,间距过短的情况下,移位的瓣膜和钙化斑块容易堵塞冠状动脉开口。另外,瓣膜支架的长度在14~17 mm,即使瓣膜位置良好,也需7~9 mm的空间。
经股总动脉穿刺行CAG的方式有:①冠状动脉开口与主动脉瓣环间距需要5 F pigtail导管在主动脉瓣开口处造影,桡动脉直径过细无法通过6 F导管;②CAG完成后在腹主动脉下段至股动脉分叉的范围内造影,评估导入动脉的口径,形态及通畅情况。此造影仍由5 F pigtail导管完成,无需更换导管和重新穿刺,可提高安全性和减少费用,并且股动脉穿刺造影对后续手术并无明显影响。
3.2.3 全主动脉CTA经股动脉方式决定了股动脉以上的全主动脉都是手术路径,全主动脉CTA检查可对主动脉形态、直径、扭曲、各主要分支动脉状况等方面进行评估,即对手术路径评估[17]。
3.3 术中操作技巧
3.3.1 穿刺或解剖股动脉SAPIEN XT Transcatheter Heart Valve系统已把导入鞘管直径缩小至18 F,整个手术可由穿刺完成,术毕用2枚proguide封堵器缝合股动脉穿刺点。我们认为在条件和技术允许情况下解剖,暴露股动脉后再行手术[18]。首先,解剖股动脉的切口和路径同动脉瘤或夹层腔内隔绝术的切口一致,操作简便,技术成熟;其次,有利于术中操作,术者可直接在股动脉上操作,更容易观察和处理股动脉情况(出血、损伤等);再次,术后安全性高,解剖股动脉方式在术后使用无损伤线缝合股动脉,比封堵器更为安全、有效,尤其对于肥胖、血管壁条件不好等易造成封堵不佳的患者,可大大减少术后出血或血管狭窄等并发症。
3.3.2 临时起搏器和快速心率起搏TAVR术中需快速心率起搏2次,分别在球囊预扩和瓣膜释放时,方式是由股静脉穿刺将临时起搏导线安置于右心室接临时起搏器备用。在2次球囊扩张之前先予快速心率起搏,频率在180~220次/min,使主动脉脉压差在短时间内小于10 mmHg,平均压维持在60 mmHg左右,其中脉压差更为重要。血压过高会造成血压对球囊的冲击而导致球囊移位和瓣膜移位甚至脱落[19]。
综上所述,目前TAVR手术在全世界范围已开展了5万余例,已证实TAVR的安全性和有效性[20],并开始大规模应用于临床。对严重主动脉瓣狭窄又合并多种疾病、无法耐受开胸手术的患者具有很好的适应性[21]。但TAVR手术在国内基本属于空白[22]。我们初步验证了经股动脉球扩式主动脉瓣置换术,Edward生物瓣和SAPIEN XT Transcatheter Heart Valve系统用于我国患者的可行性。但是整套系统在国人或亚洲患者体质及疾病特点等方面的匹配程度,以及适合国人及亚洲患者的诊断、筛选及治疗原则、标准等方面尚缺乏系统研究,更缺乏系统及推广治疗的一系列规范等。这些都有待于在后续研究中进一步改进及完善。
[1]Andersen HR,Knudsen LL,Hasenkam JM.Transluminal implantation of artificial heart valves.Description of a new expandable aortic valve and initial results with implantation by catheter technique in closed chest pigs[J].Eur Heart J,1992,13:704-708.
[2]Cribier A,Eltchaninoff H,Bash A,et al.Percutaneous transeatheter implantation of an aortic valve prosthesis for ealeillc aortic stenosis:first human case description[J].Circulation,2002,106:3006-3008.
[3]Eltchaninoff H,Tron C,Bauer F,et al.Aortic bioprosthesis implanted percutaneously:three year follow up[J].Arch Mal Coeur Vaiss,2007,100:901,904-901,908.
[4]Eltchaninoff H,Zajarias A,Tron C,et al.Transcatheter aortic valve implantation:technical aspects,results and indications[J].Arch Cardiovasc Dis,2008,101:126-132.
[5]Guinot PG,Depoix JP,Tini L,et al.Transcutaneous aortic valve implantation:Anesthetic and perioperative management[J].Ann Fr Anesth Reanim,2011,30:734-742.
[6]Nashef SA,Roques F,Hammill BG,et al.Validation of European system for cardiac operative risk evaluation(EuroSCORE)in North American cardiac surgery[J].Eur J Cardiothorac Surg,2002,22:101-105.
[7]Webb JG,Chandavimol M,Thompson CR,et al.Percutaneous aortic valve implantation retrograde from the femoral artery[J].Circulation,2006,113:842-850.
[8]Walther T,Falk V,Borger MA,et al.Minimally invasive transapical beating heart aortic valve implantation—proof of concept[J].Eur J Cardiothorac Surg,2007,31:9-15.
[9]Cribier A,Eltchaninoff H,Tron C,et al.Early experience with percutaneous transcatheter implantation of heart valve prosthesis for the treatment of end-stage inoperable patients with calcific aortic stenosis[J].J Am Coll Cardiol,2004,43:698-703.
[10]Cribier A,Eltchaninoff H,Tron C,et al.Treatment of calcific aortic stenosis with the percutaneous heart valve:mid-term follow-up from the initial feasibility studies:the French experience[J].J Am Coll Cardiol,2006,47:1214-1223.
[11]Ye J,Cheung A,Lichtenstein SV,et al.Six-month outcome of transapical transcatheter aortic valve implantation in the initial seven patients[J].Eur J Cardiothorac Surg,2007,31:16-21.
[12]Lichtenstein SV,Cheung A,Ye J,et al.Transapical transcatheter aortic valve implantation in humans:initial clinical experience[J].Circulation,2006,114:591-596.
[13]Mesa Rubio D,Suárez de Lezo Cruz Conde J,Alvarez-Osorio MP,et al.Measurement of aortic valve annulus using different cardiac imaging techniques in transcatheter aortic valve implantation:agreement with finally implanted prosthesis size[J].Echocardiography,2011,28:388-396.
[14]Dashkevich A,Blanke P,Siepe M,et al.Preoperative assessment of aortic annulus dimensions:comparison of noninvasive and intraoperative measurement[J].Ann Thorac Surg,2011,91:709-714.
[15]Bagur R,Rodés-Cabau J,Doyle D,et al.Usefulness of TEE as the primary imaging technique to guide transcatheter transapical aortic valve implantation[J].JACC Cardiovasc Imaging,2011,4:115-124.
[16]许进,李治安.超声心动图在经皮主动脉瓣置入术中应用进展[J].中国超声医学杂志,2011,27:1051-1054.
[17]Blanke P,Euringer W,Baumann T,et al.Combined assessment of aortic root anatomy and aortoiliac vasculature with dual-source CT as a screening tool in patients evaluated for transcatheter aortic valve implantation[J].Am J Roentgenol,2010,195:872-881.
[18]Rodés-Cabau J,Gutiérrez M,Bagur R,et al.Incidence,predictive factors,and prognostic value of myocardial injury following uncomplicated transcatheter aortic valve implantation[J].J Am Coll Cardiol,2011,57:1988-1999.
[19]Ferreira ND,Caeiro D,Adão L,et al.Incidence and predictors of permanent pacemaker requirement after transcatheter aortic valve implantation with a self-expanding bioprosthesis[J].Pacing Clin Electrophysiol,2010,33:1364-1372.
[20]Mostafa AE,Geist V,Abdel-Wahab M.Ad-hoc percutaneous coronary intervention and transcatheter aortic valve implantation as a combined transfemoral procedure[J].J Invasive Cardiol,2011,23:E102-E105.
[21]Lichtenstein SV.Closed heart surgery.Back to the future[J].J Thorac Cardiovasc Surg,2006,131:941-943.
[22]丁仲如,秦永文.经皮心脏瓣膜置换或修复治疗[J].国外医学·心血管疾病分册,2005,23:16-18.