霉酚酸酯对IgA肾病大鼠肾组织中TGF-β1及Smad2/3表达的影响
2013-06-14高娴绯赵凯姝翟淑波马青山
高娴绯,赵凯姝,翟淑波,马青山
(吉林大学白求恩第一医院,长春130021)
IgA肾病(IgAN)是世界范围内最常见的原发性肾小球疾病,以肾小球系膜区有大量颗粒性IgA或以IgA为主的循环免疫复合物沉积为特征,其发病机制目前不清。转化生长因子-β1(TGF-β1)、Smad蛋白已被证实为IgAN病理机制中的关键性因子[1]。大量临床研究证实,免疫抑制剂霉酚酸酯(MMF)联合激素治疗IgAN有较好的临床效果[2]。本研究观察了MMF对IgAN大鼠肾组织中TGF-β1及其信号转导分子Smad2/3表达的影响,旨在进一步探讨MMF治疗IgAN的效果及可能作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级6周龄健康清洁级雄性Wistar大鼠24只,体质量(180±20)g,由吉林大学白求恩医学部实验动物中心提供。按照SPF级饲养,自由进食和饮水,适应性饲养1周。
1.1.2 主要试剂与药物 牛血清白蛋白(Bevine Serum albumin,BSA)购自上海生物工程有限公司;脂多糖(Lipopolysaccharide,LPS)购自美国Sigma公司;异硫氰酸荧光素标记兔抗大鼠IgA抗体、TGF-β1抗体、Smad2/3抗体购自北京博奥森生物技术有限公司;MMF购自上海罗氏制药有限公司。
1.2 实验方法
1.2.1 动物分组及处理 将24只大鼠随机分为对照组、MMF组、模型组各8只。后两组均参考文献[3]建立IgAN模型:自实验第1天起以BSA 400 mg/kg(蒸馏水配成水溶液4 mL/kg)隔日灌胃1次,共8周;皮下注射蓖麻油 0.3 mL+CCl40.1 mL,每周 1次,持续9周;第6周自尾静脉注射LPS 0.05 mg/只(用0.9%NaCl配成溶液0.5 mL)。自第9周开始,MMF组予MMF 10 mg/(kg·d)每日灌胃1次,对照组和模型组予等量蒸馏水灌胃,持续至12周末。
1.2.2 尿液指标检测 分别于第 4、6、8、10、12 周末将各组大鼠放入代谢笼,收集24 h尿液,4 000 r/min离心10 min后取上清,用考马斯亮蓝法检测24 h尿蛋白定量;取尿沉渣用光学显微镜计数红细胞。
1.2.3 血清学指标检测 各组均于第12周末以3%戊巴比妥钠腹腔注射麻醉后自腹主动脉取全血,以3 000 r/min离心10 min分离血清。用全自动生化分析仪测定血 BUN、SCr、ALT、AST、总蛋白(TP)、Alb、TG、CH。
1.2.4 肾组织病理学检测 实验结束后取各组大鼠肾组织标本,经固定、脱水、透明、石蜡包埋,切片3μm厚。HE染色观察肾组织病理学改变。用直接法进行免疫荧光染色,荧光显微镜下观察有无IgA沉积,电镜下观察肾组织病理超微结构改变。
1.2.5 肾组织 TGF-β1、Smad2/3表达的检测 用SP免疫组织化学方法检测TGF-β1、Smad2/3定位和表达。取各组大鼠肾组织标本,经固定、脱水、透明、石蜡、包埋,切片3μm厚,80℃烘烤3 h;经二甲苯脱蜡,梯度乙醇水化;蒸馏水洗1 min,PBS冲洗3次;滴加3%过氧化氢溶液室温放置10 min,以消除内源性过氧化物酶;PBS洗3次;滴加正常山羊免疫血清封闭液,室温放置15 min,倾去血清,勿洗,滴加按1∶100稀释的Smad2、Smad3特异性一抗,4℃冰箱过夜;PBS冲洗3次;滴加生物素标记的二抗,室温10 min;PBS洗5 min×3次;滴加辣根酶标记链霉卵白素工作液,室温10 min;PBS洗5 min×3次;DAB显色,显微镜下作用1~2 min,至显色满意,蒸馏水终止显色。苏木素复染,盐酸乙醇分化,流水冲洗返蓝1 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。细胞质染呈棕黄色,细胞核由苏木素复染为蓝色为阳性表达判定标准。所得数据采用Motic Images Advanced 3.2图像分析仪获取灰度值。
1.3 统计学方法 采用SPSS17.0统计软件。计量数据以±s表示,资料正态分布且方差齐时,多组比较采用单因素方差分析(ANOVA),组间两两比较采用LSD法;资料偏态分布或方差不齐时,多组比较采用秩和检验(Kruskal-Wallis法),组间两两比较用Nemenyi法。P≤0.05为差异有统计学意义。
2 结果
2.1 尿液指标
2.1.1 尿红细胞计数 0至第4周末,三组尿红细胞计数相比差异无显著性(P>0.05);第6~8周末,模型组与MMF组尿红细胞计数均明显升高,与对照组相比差异有显著性(P<0.05);第10~12周末,MMF组尿红细胞计数较模型组明显减少,差异有显著性(P <0.05),详见表1。
2.1.2 24 h尿蛋白定量 0至第6周末,三组24 h尿蛋白定量相比差异无显著性(P>0.05);第6~8周末,模型组与MMF组24 h尿蛋白定量明显升高,与对照组相比差异有显著性(P<0.05);第10~12周末,MMF组24 h尿蛋白定量较模型组明显减少,差异有显著性(P<0.05),详见表2。
表1 三组尿红细胞计数比较(个/μL±s)
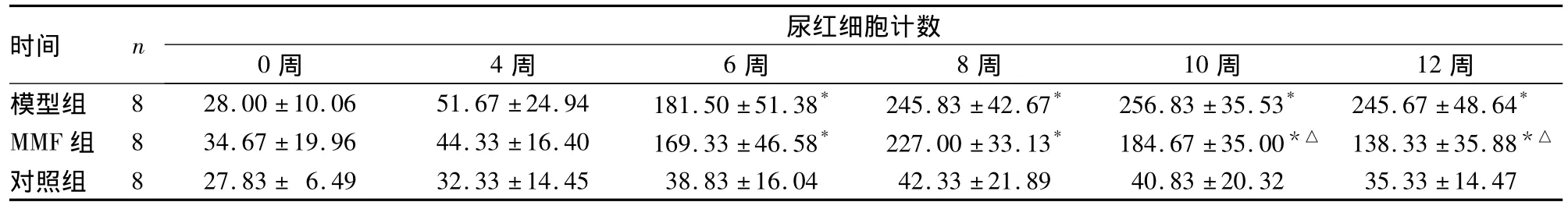
表1 三组尿红细胞计数比较(个/μL±s)
注:与对照组相比,*P <0.05;与模型组相比,△P <0.05
时间 n尿红细胞计数0周 4周 6周 8周 10周 12周模型组 8 28.00 ±10.06 51.67 ±24.94 181.50 ±51.38* 245.83 ±42.67* 256.83 ±35.53* 245.67 ±48.64*MMF 组 8 34.67 ±19.96 44.33 ±16.40 169.33 ±46.58* 227.00 ±33.13* 184.67 ±35.00*△ 138.33 ±35.88*△对照组 8 27.83 ± 6.49 32.33 ±14.45 38.83 ±16.04 42.33 ±21.89 40.83 ±20.32 35.33 ±14.47
2.2 血生化指标 模型组与MMF组血清BUN、
表2 三组24 h尿蛋白定量比较(mg/24 h±s)
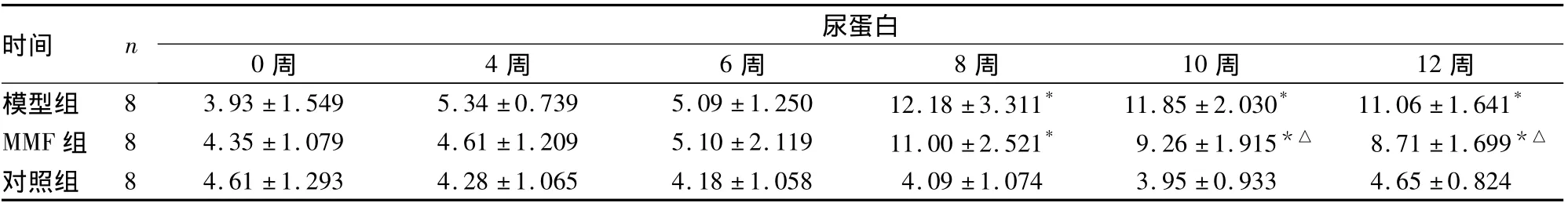
表2 三组24 h尿蛋白定量比较(mg/24 h±s)
注:与对照组相比,*P <0.05;与模型组相比,△P <0.05
时间 n尿蛋白0周 4周 6周 8周 10周 12周模型组 8 3.93 ±1.549 5.34 ±0.739 5.09 ±1.250 12.18 ±3.311* 11.85 ±2.030* 11.06 ±1.641*MMF 组 8 4.35 ±1.079 4.61 ±1.209 5.10 ±2.119 11.00 ±2.521* 9.26 ±1.915*△ 8.71 ±1.699*△对照组 8 4.61 ±1.293 4.28 ±1.065 4.18 ±1.058 4.09 ±1.074 3.95 ±0.933 4.65 ±0.824
SCr、ALT、AST、TP、ALB、TG、CH 与对照组相比,差 异无显著性(P >0.05),详见表3。
表3 三组血生化指标比较±s)

表3 三组血生化指标比较±s)
组别 n BUN(mmol/L)SCr(μmol/L) ALT(U/L) AST(U/L) TP(g/L) ALB(g/L) TG(mmol/L)CH(mmol/L)MMF 组 8 7.20 ±0.77 28.95 ±3.12 48.17 ± 8.29 143.67 ±35.57 54.95 ±12.95 32.97 ±2.31 1.33 ±0.23 1.33 ±0.17模型组 8 7.77 ±0.33 29.30 ±2.18 51.67 ± 8.55 138.50 ±23.93 50.05 ±13.58 32.05 ±0.93 1.38 ±0.23 1.42 ±0.18对照组 8 6.90 ±1.02 26.82 ±4.19 46.50 ±10.51 146.00 ±21.56 62.83 ±14.65 35.00 ±2.10 1.17 ±0.26 1.29 ±0.17
2.3 肾组织病理学改变 光镜下,对照组肾小球系膜细胞及基质无增生,毛细血管襻开放,肾小球、肾小管、间质结构正常;模型组肾小球系膜细胞增生,系膜基质增多,毛细血管管腔狭窄,肾小管间质有较多炎细胞浸润,肾小管上皮细胞肿胀变性;MMF组病理改变较模型组有所减轻,肾小球系膜细胞、系膜基质轻度增生,毛细血管管腔轻度狭窄,肾小管上皮细胞轻度变性,少量炎细胞浸润。电镜下,对照组肾小球足细胞足突正常,基底膜完整、均匀一致,系膜区系膜细胞无增生,肾小管上皮细胞正常;模型组系膜区基质内可见较多电子致密物,肾小囊内微绒毛化,毛细血管腔变大;MMF组系膜区改变较模型组减轻,肾小管上皮细胞未见坏死,毛细血管襻开放好。荧光显微镜下,对照组肾小球系膜区无IgA沉积;模型组肾小球系膜区有黄绿色强IgA荧光;MMF组肾小球系膜区内IgA黄绿色荧光强度较模型组减弱。
2.4 肾组织中TGF-β1及 Smad2、Smad3的表达与分布 对照组大鼠肾组织中有少量 TGF-β1及Smad2、Smad3 表 达;模 型组 TGF-β1 及 Smad2、Smad3阳性表达增强;MMF组 TGF-β1及 Smad2、Smad3表达较模型组减弱,其灰度值详见表4。
表4 三组肾组织中TGF-β1、Smad2、Smad3灰度值比较(n=8±s)

表4 三组肾组织中TGF-β1、Smad2、Smad3灰度值比较(n=8±s)
注:与对照组相比,*P <0.05;与模型组相比,△P <0.05
组别 TGF-β1 Smad2 Smad3 MMF 组 125.40 ±2.95*△ 135.37 ±2.26*△ 133.07 ± 7.63*△模型组 72.98 ±2.08* 80.80 ±5.97* 97.67 ±15.13*对照组199.98 ±5.80 193.48 ±6.16 219.77 ±11.41
3 讨论
研究显示,IgAN的预后差异较大,部分患者以进行性肾脏损伤为显著特征。近年来研究表明,在确诊IgAN的20 a内有15%~40%的患者进入终末期肾病(End-stage renal disease,ESRD)[4],由于肾小管纤维化被视为导致终末性肾脏衰竭的最终途径[5],采取有效措施控制肾纤维化的发展成为控制该病进展的关键环节。
研究证实,TGF-β1既是导致IgAN的中间因子,亦是加重肾脏损伤和纤维化的关键因素,其高表达于IgAN患者和系膜增生型肾小球硬化模型中[1,6,7],且在系膜增生型肾小球硬化模型的实验研究中,TGF-β1拮抗剂可减轻IgAN患者的肾小球硬化[8]。与普通人群相比,有高表达 TGF-β1基因的患者,TGF-β1蛋白表达越高,其肾脏损伤也愈重[9]。对处于IgAN早期炎症改变阶段的患者,TGF-β1蛋白是导致细胞增生和分泌的细胞因子[10]。因此,TGF-β1被视为反映IgAN预后及治疗效果的关键指标[11]。Smad蛋白是使 TGF-β1目的基因表达的细胞内关键性调节因子,根据作用不同可分为三类[12]:受体激活型如 Smad1、Smad2、Smad3,共同介质型如Smad4,抑制型如Smad6、Smad7等。TGF-β1与胞膜上相应受体结合后,能引起受体激活型Smad2/3蛋白磷酸化,进而吸引共同介质型Smad4形成复合物,转移至核内,调节转录活动,加速纤维化进展[13]。大量研究表明,在IgAN患者及IgAN动物模型中 TGF-β1、Smad2/3 的表达升高[14~17]。近年来的大量药物研究发现,多种对于IgAN疗效显著的药物,可通过降低Smad2/3及 TGF-β1表达延缓 IgAN大鼠肾脏病变恶化的持续进展[15,16]。上述研究表明,Smad蛋白增多可导致 TGF-β1表达升高,进而加重IgAN病变进展。因此,可通过降低Smad蛋白水平下调TGF-β1表达,从而减轻IgAN病变程度。
MMF联合激素治疗IgAN疗效肯定,能显著降低尿蛋白水平、保护肾功能,且毒副作用相对较少、患者耐受性好[2]。在MMF缓解单侧输尿管梗阻大鼠模型[18]、糖尿病大鼠模型等肾脏损伤病理机制的研究中,学者认为机制可能为通过减少Smad2/3蛋白、下调TGF-β1的过度表达而发挥肾脏保护作用。本研究中,第6~8周末模型组及MMF组24 h尿蛋白定量、尿液红细胞计数均显著高于对照组,肾脏病理改变均重于对照组;模型组较对照组肾组织中TGF-β1及Smad2/3表达升高。提示前两组成功建立IgAN模型,根据其肾脏病理表现及造模时长判定为早期轻微病变型;TGF-β1及Smad2/3为IgAN病理机制中的关键性因子,轻微病变早期时两者表达即升高,且肾脏病理改变越重,表达水平升高越明显。故TGF-β1及Smad2/3可能成为反映IgAN肾脏病变严重程度的敏感指标。本研究还显示,第10~12周末MMF组24 h尿蛋白定量、尿液红细胞计数均显著低于模型组,肾脏病理改变轻于模型组,TGF-β1、Smad2/3表达低于模型组。提示 MMF治疗IgAN有效,机制可能是通过下调Smad2/3表达,而减少TGF-β1的过量表达、延缓IgAN的进展。有关MMF对IgAN治疗的确切机制及疗效还需要进一步深入研究和大量的循证医学证据来证实。
综上所述,MMF治疗IgAN的病理机制可能是通过下调Smad2/3、TGF-β1表达发挥肾脏保护作用。
[1]Li XZ,Feng JT,Hu CP,et al.Does Arkadia contribute to TGF-β1-induced IgA expression through up-regulation of Smad signaling in IgA nephropathy[J].Int Urol Nephrol,2010,42(3):719-722.
[2]Tasanarong A,Thitiarchakul S.Mycophenolate mofetil treatment in primary glomerular disease:one-year follow-up in steroid dependent and resistant nephrotic syndrome[J].J Med Assoc Thai,2006,89(Suppl 2):S218-227.
[3]汤颖,娄探奇,成彩联,等.实验性IgA肾病模型的改进[N].中山大学学报(医学科学版),2006,27(2):184-187.
[4]Lai AS,Lai KN.Molecular basis of IgA nephropathy[J].Curr Mol Med,2005,5(5):475-487.
[5]Eddy AA.Molecular insights into renal interstitial fibrosis[J].J Am Soc Nephrol,1996,7(12):2495-2508.
[6]Border WA,Noble NA.TGF-beta in kidney fibrosis:a target for gene therapy[J].Kidney Int,1997,51(5):1388-1396.
[7]Yoshioka K,Takemura T,Murakami K,et al.In situ expression of cytokines in IgA nephritis[J].Kidney Int,1993,44(4):825-833.
[8]Border WA,Noble NA,Yamamoto T,et al.Antagonists of transforming growth factor-beta:a novel approach to treatment of glomerulonephritis and prevention of glomerulosclerosis[J].Kidney Int,1992,41(3):566-570.
[9]Lim CS,Kim YS,Chae DW,et al.Association of C-509T and T869Cpolymorphisms of transforming growth factor-beta1 gene with susceptibility to and progression of IgA nephropathy[J].Clin Nephrol,2005,63(2):61-67.
[10]Wang F,Xie X,Fan J,et al.Expression of P311,a transforming growth factor beta latency-associated protein-binding protein,in human kidneys with IgA nephropathy[J].Int Urol Nephrol,2010,42(3):811-819.
[11]周莹,吕吟秋,杜园园,等.TGF-β1与I gAN肾小管间质病变相关性研究[J].山东医药,2009,49(8):30-32.
[12]Massague RP.Transcriptional control by the TGF-β1/Smad signaling system[J].EMBO,2000,19(8):1745-1754.
[13]Javelaud D,Mauviel A.Mammalian transforming growth factor-beta Smad signaling and physio-pathological role[J].Int J Biochem Cell Biol,2004,36(7):1161-1165.
[14]Wu W,Jiang XY,Zhang QL,et al.Expression and significance of TGF-beta1/Smad signaling pathway in children with IgA nephropathy[J].World J Pediatr,2009,5(3):211-215.
[15]黄国东,许健,姜云,等.复方仙草颗粒对 IgA肾病肾小球硬化大鼠TGF-β/Smads信号通路的影响[J].时珍国医国药,2010,21(11):2822-2824.
[16]张霞,丁樱.清热止血颗粒(血尿停)对IgA肾病模型大鼠TGF-β1/Smad信号转导通路的影响及机理探讨[D].河南中医学院,2006:12.
[17]蒋小云,吴伟,张巧玲,等.IgA肾病患者血清IgA1对人肾小球系膜细胞转化生长因子β1/Smads信号通路的影响[J].中华生物医学工程杂志,2009,15(4):203-207.
[18]张浩,唐静,张显明,等.霉酚酸酯对UUO大鼠肾间质p-Smad2/3表达的影响[J].医学临床研究,2006,12(23,12):1910-1913.
