手足口病患儿体内淋巴细胞亚群和细胞因子水平变化及意义
2013-06-14张克昌曹明杰李维春徐元宏
张克昌,曹明杰,李维春,,徐元宏
(1滁州市第一人民医院,安徽滁州239000;2安徽医科大学第一附属医院)
手足口病(Hand,foot and mouth disease,HFMD)是以发热和手、足、口腔等部位的皮疹、疱疹或溃疡为主要特征的一种常见的小儿急性传染病,少数患儿可出现无菌性脑膜炎、脑干脑炎、脊髓灰质炎样麻痹、神经源性肺水肿、心肌炎等并发症[1]。引起HFMD的病毒主要有柯萨奇病毒(CoxA组和CoxB组)、肠道病毒71型(EV71)和埃柯病毒等,其中以CoxA16和EV71最多见[2]。绝大多数HFMD患儿病情较轻、病程自限、病愈后皮肤不留任何痕迹,个别病例进展较快,尤其是EV71病毒感染引起的重症病例,如出现神经系统症状,病死率极高。HFMD发生和发展过程中常伴随着患者体内免疫学变化。本研究观察了HFMD患儿淋巴细胞亚群、抗原递呈细胞及细胞因子等免疫学指标变化,旨在为了解病情、疗效观察和预防并发症提供依据。
1 资料与方法
1.1 临床资料 我院2011年5~8月收治的115例HFMD住院患儿(HFMD组),男72例,女43例;年龄4个月~8岁。均符合卫生部办公厅制定的《手足口病诊疗指南(2010年版)》诊断和病情评估标准,其中轻症91例、重症24例,均按上述指南进行治疗。选择20例体检健康儿童为对照组,男12例,女8例;年龄3~7岁。两组年龄、性别具有可比性(P >0.05)。
1.2 标本采集 按卫生部发布的《手足口病预防控制指南》(2008年版)附件手足口病实验室检测方案(试行),采集HFMD组入院时及重症患儿治疗后症状好转时[一般为(8±2)d]外周血4 mL,置入干燥管和EDTA抗凝管中;对照组于查体时抽取等量外周血,同法保存。
1.3 淋巴细胞亚群及树突状细胞(DC)表面分子表达检测 两组均吸取50μL新鲜EDTA-K2抗凝全血,加入置有10 μL 荧光抗体(CD3、CD4、CD8、CD80、CD86、CD16/CD56、CD19)的专用试管中,混匀,室温避光孵育15 min;每管加入1 mL溶血素,室温避光孵育10 min;1 500 r/min离心5 min,弃去上清液,加入生理盐水500μL混匀后以流式细胞仪检测T淋巴细胞亚群(CD3、CD4、CD8、CD16/CD56)、B 淋巴细胞(CD19)及DC表面分子(CD80、CD86)表达。所用仪器为BD FACSCalibur型流式细胞仪;试剂购于美国EB公司。
1.4 细胞因子浓度检测 两组均吸取2 mL新鲜EDTA-K2抗凝全血,采用ELISA法检测血清IL-13、IL-10、转化生长因子(TGF-β1)浓度。试剂盒购自美国R£D公司,严格按照试剂盒使用说明书操作。同时常规检查血常规和血糖、心肌酶谱、超敏C反应蛋白等生化指标。
1.5 统计学方法 采用SPSS13.0统计软件。计量资料用±s表示,组间比较行方差分析。P≤0.05为差异有统计学意义。
2 结果
表1 两组T淋巴细胞亚群表达阳性细胞比较(%±s)

表1 两组T淋巴细胞亚群表达阳性细胞比较(%±s)
注:与对照组相比,#P <0.01
组别 n CD+3 CD+4 CD+8 CD+16/CD+56 HFMD组115重症 24 29.967 ±14.269#15.346 ±8.598#15.946 ±7.849#8.842 ±6.260轻症 91 42.280 ±15.577 21.456 ±9.102 20.423 ±6.233 10.366 ±6.224对照组 20 47.437 ±13.296 23.679 ±8.216 21.326 ±4.695 11.479 ±5.102
2.2 两组DC及B淋巴细胞表面分子表达比较与对照组相比,HFMD组体内DC胞表面分子、比例明显升高(P<0.01),而B淋巴细胞表面分子比例无明显变化。见表2。
表2 两组细胞表面分子阳性的DC及B淋巴细胞比较(% ± s)

表2 两组细胞表面分子阳性的DC及B淋巴细胞比较(% ± s)
注:与对照组相比,★P <0.01
组别 n CD+80 CD+86 CD+19 HFMD组115重症 24 2.562 ±0.783★ 3.424 ±1.064★ 20.013 ±12.724轻症 30 2.613 ±0.873★ 3.441 ±1.553★ 22.600 ±13.784对照组20 0.634 ±0.291 1.242 ±0.493 25.842 ±12.780
2.3 两组细胞因子水平比较 HFMD组重症患儿血清 IL-13、IL-10、TGF-β1 水平显著高于轻症患儿及对照组(P<0.05或0.01),其中轻症患儿 IL-10水平显著高于对照组(P<0.01)。详见表3。
表 3 两组细胞因子 IL-13、IL-10、TGF-β1 水平比较±s)
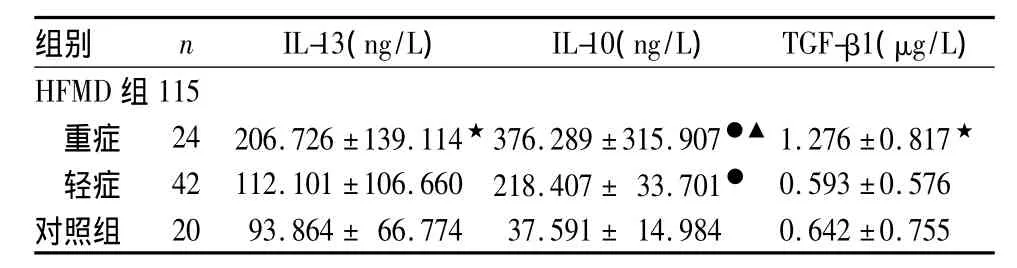
表 3 两组细胞因子 IL-13、IL-10、TGF-β1 水平比较±s)
注:与对照组相比,★P <0.05,●P <0.01;与轻症患儿相比,▲P <0.01
组别 n IL-13(ng/L) IL-10(ng/L) TGF-β1(μg/L)HFMD组115重症 24 206.726 ±139.114★376.289 ±315.907●▲ 1.276 ±0.817★轻症 42 112.101 ±106.660 218.407 ± 33.701● 0.593 ±0.576对照组20 93.864 ± 66.774 37.591 ± 14.984 0.642 ±0.755
2.4 HFMD组重症患儿治疗前后上述相关指标比较 HFMD组重症患儿治疗后、比例无明显变化,而/明显升高、/明显下降(P<0.05),详见表4;DC和B淋巴细胞表面分子比例均较治疗前显著升高(P<0.05),详见表5;HFMD组重症患儿治疗前后血清IL-13、IL-10及TGF-β1浓度均无明显变化,详见表6。
表4 HFMD组重症患儿治疗前后体内淋巴细胞亚群表达阳性细胞比较(±s)

表4 HFMD组重症患儿治疗前后体内淋巴细胞亚群表达阳性细胞比较(±s)
注:与对照组相比,★P <0.05
组别 n CD+3(%) CD+4(%) CD+8(%) CD+16/CD+56(%) CD+4/CD+8治疗前 12 28.600 ±16.726 14.685 ±7.743 17.600 ±7.862 9.931 ±6.577 0.861 ±0.360治疗后 12 35.746 ±15.908 18.723 ±8.074 16.815 ±8.708 4.392 ±4.323★ 1.294 ±0.428★
表5 HFMD组重症患儿治疗前后DC及B淋巴细胞表面分子表达阳性细胞比较(%±s)

表5 HFMD组重症患儿治疗前后DC及B淋巴细胞表面分子表达阳性细胞比较(%±s)
注:与对照组相比,★P <0.05
组别 n CD+80 CD+86 CD+19治疗前12 2.136 ±0.782 2.765 ±1.356 19.123 ±13.574治疗后 12 3.539 ±2.081★ 2.962 ±1.208★ 32.969 ±11.719★
表6 HFMD组重症患儿治疗前后细胞因子浓度比较(%±s)
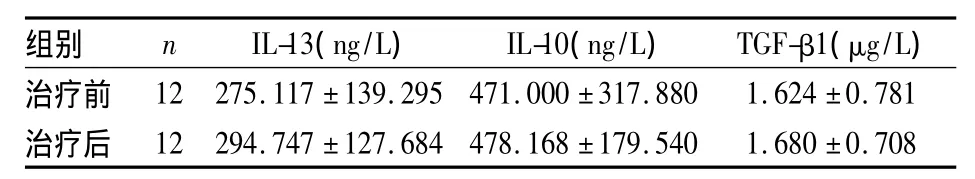
表6 HFMD组重症患儿治疗前后细胞因子浓度比较(%±s)
组别 n IL-13(ng/L) IL-10(ng/L) TGF-β1(μg/L)治疗前 12 275.117 ±139.295 471.000 ±317.880 1.624 ±0.781治疗后 12 294.747 ±127.684 478.168 ±179.540 1.680 ±0.708
3 讨论
研究证实,引起HFMD的病毒多为肠道单股正链RNA病毒,其能引发多种疾病,且传染性很强。病毒感染后机体会发生一系列变化,抗原提呈细胞(Antigen presenting cells,APC)、淋巴细胞亚群以及体内多种细胞因子水平都会发生改变。正常人体的免疫状态是在多种细胞及细胞因子的相互作用下保持平衡。外源性抗原进入机体后,一方面由活化的单核细胞、组织细胞、T细胞和巨核细胞释放出趋化因子,可以吸引粒细胞、吞噬细胞等聚集吞噬并消化抗原,从而将抗原转换成免疫原性多肽,以抗原肽-MHCⅡ分子复合物的形式表达于APC表面,供T细胞抗原受体(TCR)识别。内源性抗原被宿主细胞加工处理后以抗原肽-MHCⅠ类分子复合物的形式表达于T细胞表面,供特异性CD+8T细胞识别。T细胞经过双识别活化后,可通过自分泌和旁分泌途径分泌多种细胞因子对Th1和Th2细胞的分化进行调控,一方面通过分泌IL-4、IL-12等细胞因子,促进并放大免疫应答;另一方面也分泌IL-10、IL-13等细胞因子,对免疫强度进行调节,防止免疫应答过度亢进而损伤机体。上述过程同时也受到APC及NK细胞的调节[3],过度活化的巨噬细胞可转变成抑制性巨噬细胞,分泌前列腺素、TGF-β、活性氧分子等免疫抑制性物质,抑制免疫细胞活化、增殖和直接杀伤靶细胞。
CD分子是将来自不同实验室的单克隆抗体所识别的同一分化抗原归为一个分化群(Cluster of differentiation,CD),不同细胞表面的 CD分子参与不同的免疫应答过程。DC是目前发现的功能最强的专职APC,能加工和提呈抗原,CD80(B7-1)、CD86(B7-2)是DC表面重要的共刺激分子,在抗原等物质的刺激下表达增强。本研究结果显示,HFMD组体内 CD+80、CD+86表达水平明显高于对照组。说明HFMD儿童的DC细胞活化功能正常,成熟DC递呈抗原的能力进一步增强。T细胞通过TCR识别、捕捉由APC递呈的抗原,并由CD3分子将活化的信号传入胞内,借助CD4/CD8与MHCⅠ或Ⅱ 类抗原的相互作用,进一步巩固APC与T细胞的结合,CD3可将TCR双识别信号传入T细胞内,促进T细胞活化,故CD3分布于所有活化T细胞表面。CD4+T细胞上的TCR可识别抗原肽-MHCⅡ类分子复合物,参与Th2细胞激活;CD8+T细胞可识别并结合MHCⅠ类分子,参与细胞毒性T细胞(CTL)激活。本研究结果显示,与对照组相比,HFMD组外周血CD3+T细胞、CD4+T细胞、CD8+T细胞比例均明显下降。说明HFMD患儿机体内活化的T淋巴细胞数量较少,免疫功能较低,使得病毒有浸入和发病的机会。此与石海矾等[4]研究结果相一致。本研究还显示,HFMD重症患儿经治疗后活化T细胞比例虽有上升,但与治疗前比较无明显差异;CD+4/CD+8较治疗前显著升高。说明重症儿童体质较差、免疫系统恢复较慢,也可能是采血时患者虽然症状有所缓解但免疫系统功能尚未完全恢复;治疗后症状缓解时机体抵抗力正在恢复。活化的DC还能通过分泌IL-12等多种途径促进NK细胞活化及CTL活性,发挥杀伤功能[5,6]。/是活化 NK 细胞重要的表面分子。本研究显示,两组/表达无显著差异。原因一方面可能是在APC通过胞膜接触和分泌细胞因子途径上调NK细胞活性,同时淋巴细胞和单核细胞分泌的IL-10、TGF-β等细胞因子下调其活性[7],使得NK细胞活性总体表现无明显变化。本研究还显示,抑制性细胞因子IL-13、L-10、TGF-β浓度与HFMD病情轻重有明显关系,重症患儿显著高于轻症患儿高于对照。提示这些细胞因子参与了HFMD的发生与发展。本研究中重症患儿治疗前后细胞因子浓度虽无明显变化,但治疗后致炎性因素减少,对NK细胞的刺激作用下降,故NK含量下降、病情出现好转。
HFMD患儿体内发生细胞免疫变化的同时也发生体液免疫变化。CD19是全部B细胞所共有的表面标志,B细胞活化后也不消失,是B细胞抗原受体(BCR)共受体复合物成员之一,参与 B细胞活化[8]。受病毒感染时,机体会发生类似变态反应的免疫学变化,初次接触病毒时体内B淋巴细胞开始活化,胞内发生一系列分子生物学变化,如蛋白质和核酸合成增加,再次受到刺激上述B细胞开始分裂和分泌大量免疫球蛋白样抗体,发挥体液免疫功能。本研究中两组CD+19表达无显著差异,但重症患儿治疗后显著升高。可能原因是B细胞持续受到炎症刺激发生增殖。同时部分B细胞也表达CD80,此可能是重症患儿治疗后CD8+0表达升高的原因(而非DC有所增加),机制可能是抗原持续刺激、DC增殖减弱[9]。
总之,HFMD患儿体内存在细胞免疫和体液免疫状态变化,正确认识和了解这些变化,对此类疾病的诊治有极其重要的参考价值。
[1]周伯平,李成荣.肠道病毒71型手足口病[M].北京:人民卫生出版社,2009:1-9.
[2]李燕婷.手足口病的流行病学特征及预防控制[J].上海预防医学杂志,2008,20(6):601-603.
[3]Nakayama M,Takeda K,Kawano M,et al.Naturalkiller(NK)-dendritic cell interactions generate MHC classⅡ-dressed NK cells that regulate CD4+T cells[J].Proc Natl Acad Sci U S A ,2011,108(45):18360-18365.
[4]石海矾,陈益平,徐志伟,等.手足口病患儿外周血淋巴细胞亚群变化的临床研究[J].中国小儿急救医学,2010,17(1):48-49.
[5]Löhr HF,Pingel S,Böcher WO,et al.Redueed virus specific T helper cell induction by autologous dendritic cells in patients with chronic hepatitis B-restoration by exogenous interleukin-12[J].Clin Exp Immunol,2002,130(1):107-114.
[6]赵飞兰,晁耐霞,李日伦,等.肝癌相关抗原Kinectin蛋白致敏树突状细胞诱导的CTL对肝癌细胞株杀伤作用的检测[J].中国现代医学,2011,(26):3203-3207.
[7]Tomihara K,Kato K,Masuta Y,et al.Gene transter of the CD-40ligand to human dendritic cells induces NK-mediated antitumor effects against human carcinoma cells[J].Int J Cancer,2007,120(7):1491-1498.
[8]龚菲力.医学免疫学[M].2版.北京:科学出版社,2004:154-158.
[9]申健,何阳胜,张魏巍,等.细菌脂多糖对人树突状细胞分化成熟及表达PD-1的影响及意义[J].实用医学杂志,2012,8(7):1239-1241.
