不同剂量右美托咪定麻醉对食管癌根治术患者术后认知功能的影响
2013-06-14张加强孟凡民
张 伟,张加强,孟凡民
(河南省人民医院,郑州450003)
术后认知功能障碍(POCD)是手术后常见并发症之一,属于轻度神经认知功能紊乱,临床表现为记忆力、注意力、学习能力等认知功能的改变,但其发生机制尚无定论。文献报道,右美托咪定具有减轻缺血再灌注损伤、抗炎、脑保护等作用[1~3],且在改善患者术后认知功能方面具有潜在优势(多集中于对术后谵妄等严重器质性脑综合征的观察)[4,5],但其对开胸手术患者术后POCD有何影响尚无定论。本研究观察了不同剂量右美托咪定对食管癌根治术患者POCD的影响,并对其机制进行了分析。现报告如下。
1 资料与方法
1.1 临床资料 本研究已获本院医学伦理委员会批准,患者及其家属签署知情同意书。择期全麻下行食管癌根治术患者60例,ASA分级Ⅱ或Ⅲ级,男28例、女30例,年龄45~64岁,体质量指数18~25 kg/m2。病例入选标准:无糖尿病史,术前心肺功能基本正常,肝肾功能未见异常。排除标准:术前有明确的中枢神经系统或精神心理方面的疾病史;正在服用镇静药物或抗抑郁药物;严重酗酒;简易智能状态量表 (MMSE)评分≥17分;贫血(Hb<10 g/dL);伴严重的视力或听力障碍。采用随机数字表法,将60例患者分为右美托咪定1组(D1组)、右美托咪定2组(D2组)及对照组(C组)各20例,其一般资料及病情具有可比性。
1.2 围术期麻醉管理 三组均未使用术前用药,入室后常规监测心电图、无创血压、脉搏氧饱和度,Narcotrend电极贴于前额监测麻醉深度,右肘静脉行静脉留置针穿刺置管备术中采集血样,右桡动脉穿刺置管行有创血压监测。静脉注射丙泊酚1.5~2 mg/kg、顺式阿曲库铵0.15 ~0.2 mg/kg及芬太尼3~5μg/kg常规快速诱导插管,纤维支气管镜确认位置良好。术中切开皮肤即刻,对照组静脉输注生理盐水20 mL,D1组和D2组分别静脉输注右美托咪定0.5、1μg/kg(均用生理盐水稀释至20 mL),输注时间均为10 min;其后D1组和D2组分别以右美托咪定0.3、0.5 μg/(kg·h)持续输注至术毕,C 组输注等量生理盐水;三组术中均静脉输注丙泊酚维持适宜麻醉深度(D1-E1),间断静脉注射顺式阿曲库铵及芬太尼。术中心率<50次/min者静脉注射阿托品0.25~0.5 mg,心率 >100次/min者静脉注射艾司洛尔10~20 mg,平均动脉压升高超过基础值20%者静脉注射乌拉地尔15~25 mg,平均动脉压降低超过基础值20%者静脉注射麻黄碱5~10 mg。三组术中均采用单肺通气(OLV)隔离技术,潮气量为8 mL/kg,吸入氧浓度为100%,吸呼比为1∶2,调整呼吸频率维持呼气末二氧化碳压在35~40 mmHg;术中出现严重低氧血症(SpO2<90%的时间超过5 min),经纤维支气管镜再次确认双腔气管导管对位良好且经吸痰、呼气末正压通气等措施仍无改善者,退出本研究,改为双肺通气。术后三组均行静脉自控镇痛,药物配方均为芬太尼1.2 mg+氟比洛芬酯100 mg+托烷司琼10 mg+生理盐水稀释至200 mL。
1.3 观察指标 ①血液学指标:于麻醉诱导前即刻(T1)、术毕(T2)、术后第 1天(T3)、术后第 7天(T4)采集患者肘静脉血5 mL,离心提取血清。采用黄嘌呤氧化酶法测定血清超氧化物歧化酶 (SOD)活性,采用硫代巴比妥酸法测定丙二醛 (MDA)浓度;采用ELISA法测定血清IL-6水平、神经元特异性烯醇化酶(NSE)浓度。②认知功能:由非手术医师分别于术前24 h(D0)、术后第1天(D1)、第3天(D3)、第7天(D7)采用MMSE双盲评估三组认知功能变化,评估时间固定为每天下午5点左右,术后评分低于术前1分以上者即诊断为POCD[6]。③其他指标:OLV时间、手术时间、丙泊酚用量、术中出血量。
1.4 统计学方法 采用SPSS16.0统计学软件。计量资料以±s表示,组间比较采用单因素方差分析,组内比较采用重复测量设计的方差分析;计数资料采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 两组手术一般情况 C组和D2组各有1例术中出现严重低氧血症,退出本研究;其余患者均顺利完成手术,术中均未输血,术后未出现严重并发症。三组OLV时间、手术时间、丙泊酚用量、术中出血量等比较均无显著差异(P均>0.05),见表1。
表1 三组OLV时间、手术时间、丙泊酚用量、术中出血量比较± s)
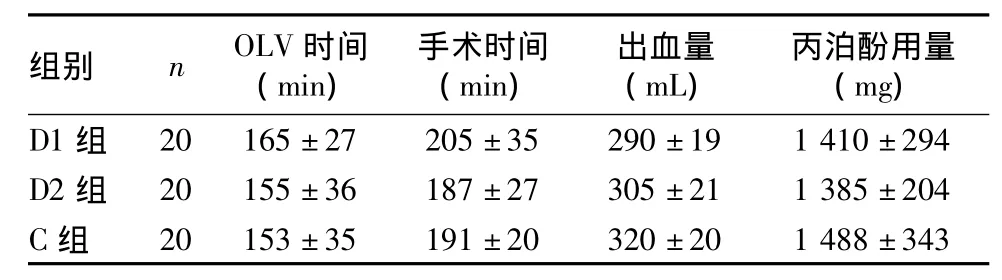
表1 三组OLV时间、手术时间、丙泊酚用量、术中出血量比较± s)
组别 n OLV时间(min)手术时间(min)出血量(mL)丙泊酚用量(mg)D1组20 165±27 205±35 290±19 1 410±294 D2组 20 155±36 187±27 305±21 1 385±204 C组20 153±35 191±20 320±20 1 488±343
2.2 两组血清SOD活性和MDA含量比较 与T1比较,三组T2和T3时SOD活性降低;D2组T3时点SOD活性高于其他两组。与T1比较,三组T2和T3时MDA含量均升高,D2组T3时点MDA含量低于其他两组,详见表2。
2.3 两组血清IL-6水平及NSE浓度比较 与T1比较,三组其他时点IL-6水平均升高,D2组T2和T3时点低于其他两组;与T1比较,三组T2、T3时点NSE浓度均升高,T4时恢复至术前水平,D2组T2、T3时点低于其他两组,详见表3。
2.4 两组手术前后MMSE评分及POCD发生率比较 与术前24 h比较,术后第1天三组MMSE评分均降低,D2组术后第1、3天MMSE评分显著高于其他两组(P均<0.05),详见表4。D1组、D2组和C组分别有8、4、10例发生POCD,D2组发生率显著低于D1组和C组(P均<0.05)。
表2 三组不同时点SOD活性和MDA含量比较(±s)
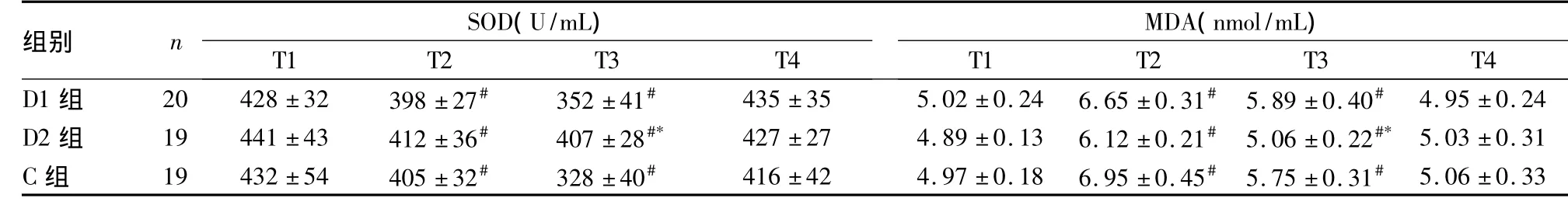
表2 三组不同时点SOD活性和MDA含量比较(±s)
注:与同组T1比较,#P<0.05;与同时点D1组和C组比较,*P<0.05
组别 n SOD(U/mL)MDA(nmol/mL)T1 T2 T3 T4 D1 组 20 428 ±32 398 ±27# 352 ±41# 435 ±35 5.02 ±0.24 6.65 ±0.31# 5.89 ±0.40#T1 T2 T3 T4 4.95 ±0.24 D2 组 19 441 ±43 412 ±36# 407 ±28#* 427 ±27 4.89 ±0.13 6.12 ±0.21# 5.06 ±0.22#* 5.03 ±0.31 C 组 19 432 ±54 405 ±32# 328 ±40# 416 ±42 4.97 ±0.18 6.95 ±0.45# 5.75 ±0.31#5.06 ±0.33
表3 三组不同时点血清IL-6水平和NSE浓度比较±s)
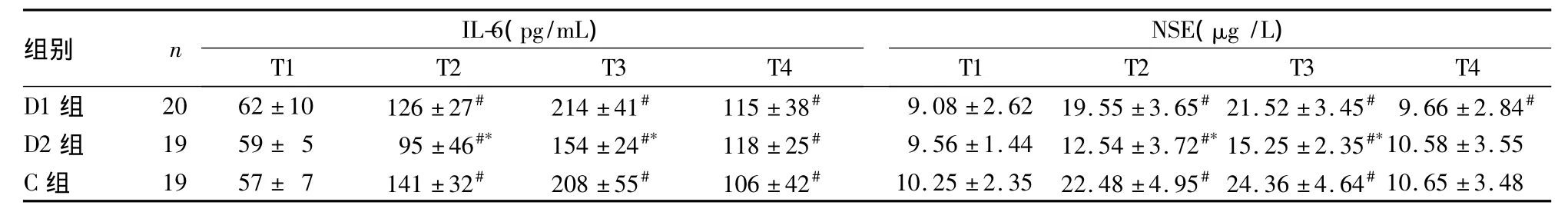
表3 三组不同时点血清IL-6水平和NSE浓度比较±s)
注:与同组T1比较,#P<0.05;与同时点D1组和C组比较,*P<0.05
组别 n IL-6(pg/mL)NSE(μg/L)T1 T2 T3 T4 D1 组 20 62 ±10 126 ±27# 214 ±41# 115 ±38# 9.08 ±2.62 19.55 ±3.65#21.52 ±3.45# 9.66 ±2.84 T1 T2 T3 T4#D2 组 19 59 ± 5 95 ±46#* 154 ±24#* 118 ±25# 9.56 ±1.44 12.54 ±3.72#*15.25 ±2.35#*10.58 ±3.55 C 组 19 57 ± 7 141 ±32# 208 ±55# 106 ±42# 10.25 ±2.35 22.48 ±4.95#24.36 ±4.64#10.65 ±3.48
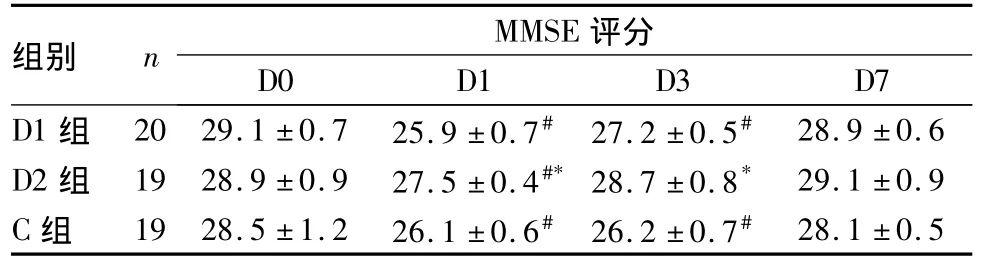
表4 三组不同时点MMSE评分比较(分,¯x±s)
3 讨论
临床实践证实,POCD可导致术后并发症增加、住院时间延长、生活质量下降等。开胸手术创伤大、时间长,OLV过程中易出现低氧血症,造成通气血流比值失调及肺缺血再灌注等生理紊乱,POCD发生率为26.1%[1]。故对开胸术患者及时进行POCD干预及评估非常重要。评价POCD的方法很多,本研究采用 MMSE法,其具有简便易行、敏感性(87%)和特异性(82%)均较高等特点[6],适合对老年患者进行认知功能的评价。影响POCD发生的因素很多,如年龄、创伤强度、手术类型、术中出血和输血情况等[7]。本研究三组患者一般情况具有可比性,且均为同一组手术医生的病例,最大程度保证了组间手术创伤强度、OLV时间、手术时间、丙泊酚用量、术中出血量等一致性;术中均通过Narcotrend电极监测维持相同麻醉深度,术中各组生命体征平稳;MMSE评分由非手术医师双盲评估。故可以认为本研究三组观察指标检测结果不同与右美托咪定使用情况有关。对右美托咪定为新型高选择性α2肾上腺素受体激动剂,具有镇静、镇痛、遗忘、抗焦虑等药理作用。本研究结果显示,三组术后第1天均出现POCD,MMSE评分在D2组术后第3天即恢复至术前水平,而余两组均于术后第7天才恢复至术前水平。表明1μg/kg右美托咪定麻醉能促进食管癌手术患者术后认知功能恢复,对患者术后整体恢复有利。
有研究指出,抑制氧化应激反应激活的NF-κB活性可减少上腹部全麻术后 POCD的发生[8]。由此,我们推测机体氧化应激反应水平高低与术后POCD可能有关。胸科手术中OLV所致肺组织缺血再灌注过程中,可产生大量的氧自由基并可触发炎性反应。MDA是脂质过氧化物的分解产物,可间接反映机体脂质过氧化反应程度;SOD为内源性自由基清除剂,自由基产生增加时其消耗增加,可间接反映体内自由基产生情况。检测SOD活性、MDA含量可间接反映出氧自由基对细胞的损伤程度。E-ser等[3]研究表明,在对兔建立全脑缺血再灌注模型后,右美托咪定可降低MDA及NO含量、升高SOD活性,表明右美托咪定可减轻此过程发生的缺血再灌注损伤。Ayoglu等[9]研究表明,右美托咪定可减轻兔蛛网膜下腔出血过程中发生的氧化应激反应,且与其剂量呈相关性。本研究结果表明,三组围术期均出现SOD活性降低及MDA含量升高,D2组T3时点SOD活性显著高于其他两组、MDA含量显著低于其他两组。表明三组术中均出现了氧化应激损伤,1μg/kg右美托咪定麻醉可减轻此类氧化应激损伤,对改善POCD可能具有一定价值。
IL-6是一种主要的急性相反应促炎因子,是组织损伤的早期敏感指标,参与炎症反应,其水平高低可反映组织损伤的程度[10]。近年来研究表明,围术期POCD的发生与炎症反应密切相关。Watkins等[11]研究结果表明,冠状动脉搭桥术后1周出现POCD的患者体内IL-6的水平显著升高;Ramlawi等[12]调查结果发现,IL-6表达水平与3 298名中风患者认知功能总体评估相关。右美托咪定可抑制脓毒症患者及内毒素大鼠炎症反应过程中IL-6水平升高[13,14],机制可能是通过下调单核细胞核和巨噬细胞膜上的Toll样受体4抑制IL-6生成[15]。本研究结果表明,三组围术期均出现血清IL-6水平升高,但D2组较其余两组炎症反升高幅度低。表明1μg/kg右美托咪定具有显著抗炎作用。NSE是神经元和神经内分泌细胞所特有的一种酸性蛋白酶,正常情况下在外周血中含量很低,神经元受到缺氧、缺血刺激后其细胞膜完整性遭到破坏,NSE便从细胞内释放出来,进而通过血脑屏障释放入血。本研究结果表明,三组围术期血清NSE浓度均升高,直至术后第7天恢复正常;D2组T2、T3时点血清NSE浓度显著低于其他两组。表明围术期出现了可逆的脑损伤过程,NSE浓度变化与MMSE临床评价具有一致性,对诊断患者POCD具有参考价值;1μg/kg右美托咪定可减轻围术期脑损伤,对围术期脑保护及认知功能的保护具有一定价值。值得注意的是,本研究样本量偏小,仅采用MMSE一种方法进行POCD的评价,缺乏稳定性,且容易出现实践性效应;以后尚需大样本、多中心、多种评测方法联合应用对此类患者进行POCD的评价。
综上所述,1μg/kg右美托咪定麻醉可改善食管癌根治术患者围术期认知功能,其机制可能与降低氧化应激损伤及炎症水平有关。
[1]彭志友,封小美,薛庆生,等.胸科手术术后认知功能障碍的危险因素分析[J].临床麻醉学杂志,2011,27(5):433-435.
[2]Misthos P,Katsaragakis S,Theodorou D,et al.The degree of oxidative stress is associated with major adverse effects after lung resection:a prospective study[J].Eur J Cardiothorac Surg,2006,29(4):591-595.
[3]Shukry M,Clyde MC,Kalarickal PL,et al.Does dexmedetomidine prevent emergence delirium in children after sevoflurane-based general anesthesia[J].Paediatr Anaesth,2005,15(12):1098-1104.
[4]Maldonado JR,Wysong A,van der Starre PJ,et al.Dexmedetomidine and the reduction of postoperative delirium after cardiac surgery[J].Psychosomatics,2009,50(3):206-217.
[5]Rasmussen LS.Defining postoperative congnitive dysfunction[J].Eur J Anesthesiol,1998,15(6):761-764.
[6]Anthony JC,LeResche L,Niaz U,et al.Limits of the'Mini-Mental State'as a screening test for dementia and delirium among hospital patients[J].Psychol Med,1982,12(2):397-408.
[7]Hudetz JA,Iqbal Z,Gandhi SD,et al.Postoperative dysfunction in older patients with a history of alcohol abuse[J].Anesthesiology,2007,106(3):423-430.
[8]李伟,薛荣亮.氧化应激反应对老年患者炎症反应及术后认知功能障碍的影响[J].山西医科大学学报,2011,42(12):986-989.
[9]Ayoglu H,Gul S,Hanci V,et al.The effects of dexmedetomidine dosage on cerebral vasospasm in a rat subarachnoid haemorrhage model[J].JClin Neurosci,2010,17(6):770-773.
[10] Miki C,Hiro J,Ojima E,et al.Perioperative allogemeic blood transfusion,the related cytokine response and long-term survial after potentially curative of colorectal cancer[J].Clin Oncol(R Coll Radiol),2006,18(1):60-66.
[11]Watkins LR,Maier SF.Glia:a novel drug discovery target for clinical pain[J].Nat Rev Drug Discov,2003,2(12):973-985.
[12]Ramlawi B,Rudolph JL,Mieno S,et al.C-Reactive protein and inflammatory response associated to neurcognitive decline following a aciatic nerve constriction injury[J].Brain Res,1991,565(1):1-7.
[13]Memis D,Hekinoglu S,Vatan I,et al.Effects of midazolam and dexmedetomidine on inflammatory responses and gastric intramucosal pH to sepsis,in critically ill patients[J].Br JAnaesth,2007,98(4):550-552.
[14]Taniguchi T,Kidani Y,Kanakura H,et al.Effects of dexmedetomidine on mortality rate and inflammatory responses to endotoxininduced shock in rats[J].Crit Care Med,2004,32(6):1322-1326.
[15]闫东来,于永浩,刘宏伟,等.右美托咪定对脂多糖诱导大鼠外周血单核细胞Toll样受体4 mRNA表达的影响[J].中华麻醉学杂志,2011,3(1):115-117.
