处方工艺对聚乙烯醇/魔芋胶复合水凝胶体外释药的影响
2013-06-12张瑜,张缨
张 瑜,张 缨
(1.河南大学 药物研究所,河南 开封 475004;2.河南大学 软件学院,河南 开封 475004)
聚乙烯醇(polyvinyl alcohol,简称PVA)作为功能性高分子材料,具有生物相容性好等优点,可用于水凝胶的制备[1]。PVA 凝胶的制备方法有化学交联和物理交联,前者通常采用醛类、硼酸等交联剂使PVA 分子链间通过化学键交联而形成凝胶,但存在交联剂残留毒性问题,影响其应用范围;后者采用反复冷冻-解冻法,PVA 分子链间通过范德华力、氢键力及微晶的存在,形成物理交联点,制得三维网络结构的水凝胶。与化学交联相比,此方法可避免交联剂毒性及药物与交联剂之间可能存在的配伍问题,有利于保持药物活性,应用范围广,可作为给药系统应用而日益受到关注[2-4]。PVA 单一材料采用循环冷冻-解冻法制备的水凝胶强度低,溶胀性能差,不利于有效控制药物释放,因此,如何调节其凝胶性质,改善调控药物释药特性成为PVA 水凝胶作为给药系统应用的关键。研究[4-6]发现,PVA 凝胶强度与材料分子量、浓度和冷冻-解冻条件等有关,如PVA 浓度提高至10%~20%,冷冻-解冻循环次数达到5 次以上可控制药物释放等,但存在材料用量大、制备时间长的缺点。人们考虑将PVA与多糖材料如海藻酸钠、壳聚糖等配合使用,调节其结构性能,控制药物释放。魔芋胶(konjac glucomannan,简称KGM)作为一种新型多糖材料,是从我国优势资源植物——魔芋中分离提纯得到,具有黏度高、溶胀度大等特性,作为增稠剂和载体材料已广泛用于医药、食品等行业[7]。本实验以盐酸小檗碱为模型药物,采用循环冷冻-解冻法制备PVA/KGM 载药复合水凝胶,考察处方工艺因素对凝胶控制药物释放特性的影响,为PVA/KGM 复合水凝胶作为新型给药系统应用提供基础。
1 仪器与试药
RCZ-8A 智能药物溶出仪(天津大学精密仪器厂);紫外-可见分光光度计(WFZ UV-2000型,龙尼柯仪器有限公司);PVA(聚合度1750,醇解度99%,国药集团化学试剂有限公司);KGM(16000mPa·s,成都协力魔芋科学种植加工园有限公司);盐酸小檗碱(98%,西安赛邦医药科技有限公司);盐酸小檗碱对照品(110713-201212,中国食品药品检定研究院),其他试剂均为分析纯。
2 方法与结果
2.1 盐酸小檗碱测定方法学研究
2.1.1 标准曲线的建立 精密称取盐酸小檗碱对照品适量,以纯化水为介质,配置系列浓度盐酸小檗碱溶液(分别为0.811、1.622、3.244、6.488、9.732、12.976μg/ml),以纯化水为空白对照,于344nm 波长处测定吸光度,以药物浓度C(μg/ml)为横坐标,吸光度A为纵坐标作标准曲线,得标准曲线方程:
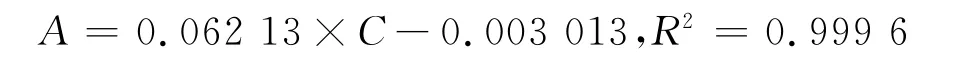
由标准曲线方程可知,盐酸小檗碱溶液浓度在(0.811~12.976)μg/mL范围内,吸光度与浓度线性关系良好。
2.1.2 精密度试验 配制低、中、高浓度的盐酸小檗碱对照品溶液(分别为0.811、6.488、12.976μg/mL),分别连续测定6次,计算RSD 值。低、中、高三种浓度的RSD 值分别为0.96%、0.64%、0.72%,说明测定方法精密度良好。
2.1.3 稳定性试验 配制低、中、高浓度的盐酸小檗碱对照品溶液(分别为0.811、6.488、12.976μg/mL,放置不同时间(分别为0、2、4、6、8、10h),测定吸光度,计算RSD 值。低、中、高三种浓度的RSD 值分别为1.02%、0.79%、0.75%,说明在考察的时间范围内样品稳定性良好。
2.1.4 PVA/KGM 载药复合水凝胶释放度测定 取PVA/KGM 载药复合水凝胶,按中国药典(2010年二部附录XC)桨法操作,介质为脱气纯化水,体积900mL,温度(37±0.5)℃,搅拌转速50r/min,于规定时间(分别为0.5、1.0、1.5、2.0、3、4、6、8、10h)取样5mL,同时补加等温等量纯化水,样品溶液适当稀释,同时配制浓度为6.488μg/ml的盐酸小檗碱对照品溶液,分别采用紫外分光光度法测定样品和对照品溶液的吸光度,按外标一点法计算药物浓度和累积释药百分率,绘制释药曲线。
2.2 PVA/KGM 载药复合水凝胶的制备
2.2.1 PVA和KGM 贮备液的制备 称取PVA和KGM 分别加至纯化水中,精密称定重量,置于30℃水浴条件充分溶胀,然后加热至90℃,保温至完全溶解,放冷,精密称定,并加水补足重量,分别制得PVA贮备液和KGM 贮备液。
2.2.2 PVA/KGM 载药复合水凝胶的制备 按处方量取PVA和KGM 贮备液,混合均匀,加入盐酸小檗碱充分搅拌均匀,室温放置除去气泡。将上述混合液定量分装至5mL离心管中,然后置于-20℃条件下冷冻18h,再置于8℃条件下解冻6h,反复循环数次,从离心管中取出已形成的水凝胶,40℃条件下真空干燥,即得。
2.3 PVA/KGM 载药复合水凝胶制备的处方工艺因素考察
2.3.1 冷冻-解冻循环次数的影响 配制PVA、KGM和盐酸小檗碱的混合溶液(其中PVA/KGM/盐酸小檗碱的质量比为2∶1∶1,PVA 质量浓度为5.0%),分装于5mL 离心管中,每管4 mL,采用上述冷冻-解冻条件,循环次数分别为1、2、3、4次,制得PVA/KGM 载药复合水凝胶,进行体外释放度测定,结果见图1。
由图1释药曲线比较发现,随着循环次数增加,复合水凝胶的释药速度减慢,这与冷冻-解冻法制备PVA 凝胶的原理有关。冷冻过程中,PVA 水溶液分子运动状态受到限制,相互接触的分子链通过范德华力和氢键作用力而紧密结合,形成有序结构体,并在解冻过程中不受影响。随着冷冻-解冻循环次数增加,紧密结合的有序结构体增多,凝胶交联强度增加,从而有效阻滞药物的扩散释放[4]。循环3次与4次的释药特性相差不大,说明冷冻-解冻循环3 次,PVA/KGM 载药复合水凝胶已可形成有效交联强度的凝胶结构,控制药物释放。
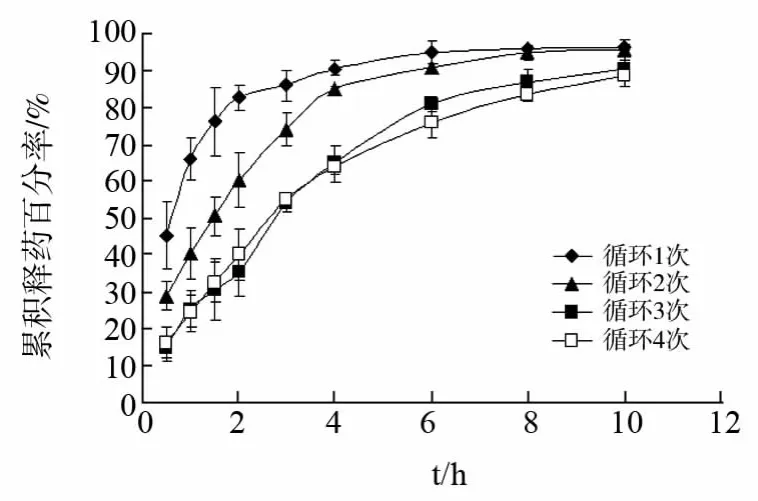
图1 冷冻-解冻循环次数对PVA/KGM 载药复合水凝胶体外释药的影响
2.3.2 凝胶材料用量的影响 配制不同浓度PVA、KGM和盐酸小檗碱的混合溶液(其中PVA/KGM/盐酸小檗碱的质量比为2∶1∶1,PVA 质量浓度分别为1.0%、3.0%、5.0%和7.0%),分装于5mL 离心管中,每管4mL,采用上述冷冻-解冻条件,循环次数均为3次,制得PVA/KGM 载药复合水凝胶,进行体外释放度测定,结果见图2。
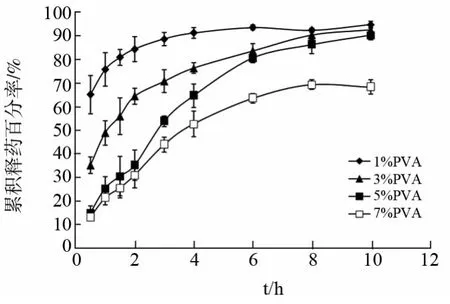
图2 凝胶材料用量对PVA/KGM 载药复合水凝胶体外释药的影响
从图2释药曲线比较发现,随凝胶材料用量增加,PVA/KGM 载药复合水凝胶的释药速度下降,PVA 浓度为1%和3%时,药物释放过快,当PVA 浓度达到5%以上,可有效控制药物缓慢释放,但PVA 浓度过高如7%时,凝胶后期释药过慢,影响药物的完全释放。这与凝胶材料用量增加,凝胶中物理交联点增多,网状结构紧密,溶胀度减小,不利于药物扩散释放有关。
2.3.3 PVA/KGM 比例的影响 配制不同浓度PVA、KGM和盐酸小檗碱的混合溶液(其中PVA/KGM的质量比分别为1∶0、2∶1、1∶1和1∶2,PVA与KGM 混合液的总浓度均为5.0%,盐酸小檗碱质量浓度为2.5%),分装于5mL 离心管中,每管4mL,采用上述冷冻-解冻条件,循环次数均为3次,制得PVA/KGM 载药复合水凝胶,进行体外释放度测定,结果见图3。
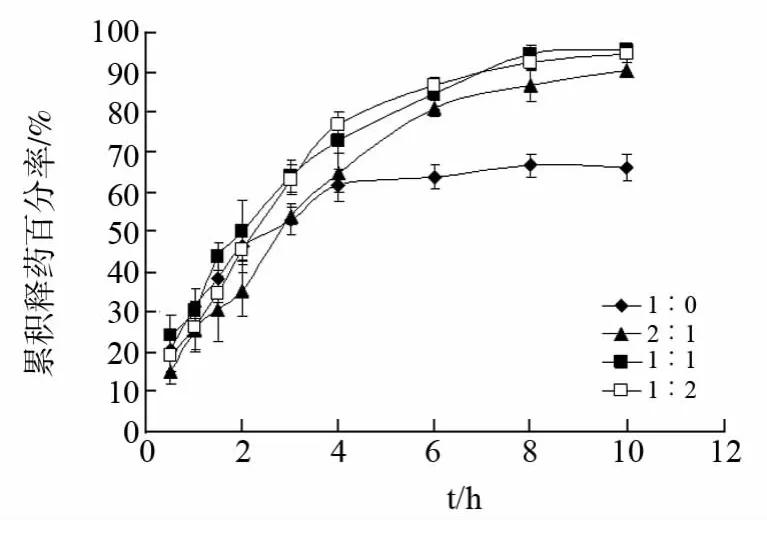
图3 PVA/KGM 比例对PVA/KGM 载药复合水凝胶体外释药的影响
从图3释药曲线比较发现,单纯PVA 水凝胶的药物释放不完全,这与PVA 材料溶胀性能差,无法有效形成药物扩散通道而影响药物释放有关。PVA/KGM 载药复合水凝胶的药物释放较完全,随着KGM在凝胶材料中所占比例增加,释药前期的药物释放减慢,而后期释药加快,与KGM 具有较强的亲水性和溶胀性有关。前期KGM 亲水迅速形成凝胶层,可有效阻滞药物释放;后期KGM 充分溶胀,可改善凝胶骨架的扩散孔道,孔隙增大,有利于药物释放。
2.3.4 盐酸小檗碱载药量的影响 配制不同浓度的PVA、KGM和盐酸小檗碱混合溶液(其中PVA/KGM 质量比为2∶1,PVA与KGM 混合液总浓度为5.0%,盐酸小檗碱质量浓度分别为1.0%、2.0%、3.0%和4.0%),分装于5mL离心管中,每管4mL,采用上述冷冻-解冻条件,循环次数均为3次,制得PVA/KGM 载药复合水凝胶,进行体外释放度测定,结果见图4。
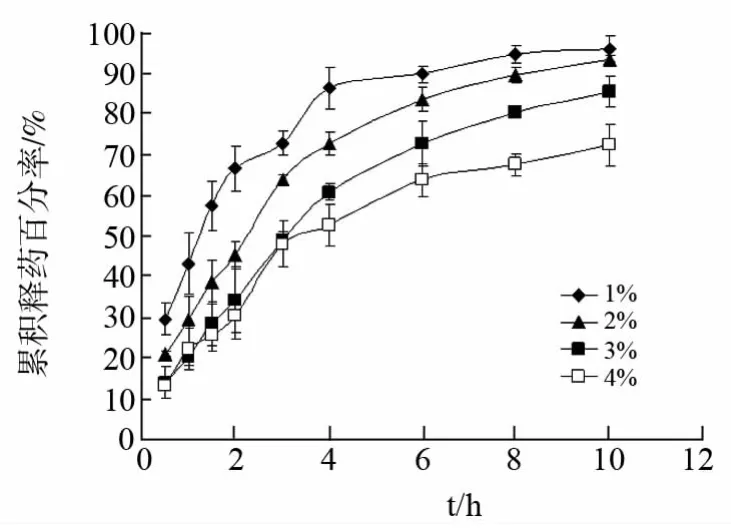
图4 盐酸小檗碱载药量对PVA/KGM 载药复合水凝胶体外释药的影响
从图4释药曲线比较发现,随着盐酸小檗碱载药量增加,PVA/KGM 载药复合水凝胶的释药速度减慢,与药物水溶性较差,载药量增加,凝胶溶胀性降低,影响扩散孔道形成,同时过量药物颗粒阻塞扩散孔道,影响药物释放有关。
3 结论
聚乙烯醇/魔芋胶复合水凝胶通过改变处方工艺因素,实现药物释放的调控,可作为一种新型给药系统用于缓释制剂的制备。
[1]DeMerlis CC,Schoneker DR.Review of the oral toxicity of polyvinyl alcohol[J].Food and Chemical Toxicology,2003,41(3):319-326.
[2]Nugent MJD,Higginbotham CL.Preparation of a novel freeze thawed PVA composite hydrogel for drug delivery applications[J].European Journal of Pharmaceutics and Biopharmaceutics,2007,67(2):377-386.
[3]An Y,Koyama T,Hanabusa K,et al.Preparation and properties of highly phosphorylated poly (vinyl alcohol)hydrogels chemically cross linked by glutaraldehyde[J].Polymer,1995,36(11):2297-2301.
[4]高瀚文,杨荣杰,何吉宇,等.冷冻/解冻制备的聚乙烯醇水凝胶的结构和流变性研究[J].高分子学报,2010,53(5):542-549.
[5]Xie L,Jiang M,Dong X,et al.Controlled mechanical and swelling properties of poly(vinyl alcohol)/sodium alginate blend hydrogels prepared by freeze-thaw followed by Ca2+crosslinking[J].Journal of Applied Polymer Science,2012,124(1):823-831.
[6]Ranjha NM,Khan S.Chitosan/Poly(vinyl alcohol)Based Hydrogels for Biomedical Applications:A Review[J].Journal of Pharmacy and Alternative Medicine,2013,2(1):30-42.
[7]黄明发,张盛林.魔芋葡甘聚糖的增稠特性及其在食品中的应用[J].中国食品添加剂,2008,18(6):127-131.
