白芍提取物肠溶微囊的制备及体外释放度的研究*
2013-06-09崔亚男刘春华付英杰王慧云
崔亚男 管 华 刘春华 付英杰 王慧云
(1济宁医学院药学院,山东 日照276826;2济宁医学院临床学院,山东 济宁272067)
本文作者曾成功制备了复方参芍注射剂[1-2]。但近年来,随着中药注射剂的产销量快速增长,有关中药注射剂的产品质量问题和临床安全问题的报道也逐渐增多。因此,本文在前期研究的基础上,进一步对复方参芍进行研究,拟通过微囊化技术,将白芍及人参茎叶皂苷分别包囊,提高储存稳定性,延长和控制膜内物质的释放,提高生物利用度。
1 仪器与试剂
白芍饮片(日照市药材公司);芍药苷对照品(中国药品生物制品检验所);AB-8型大孔吸附树脂(南开大学化工厂);Eudragit L100(连云港制药厂);HPMC(石家庄优甫化工有限公司);甲醇、乙腈为色谱纯;其它均为分析纯;DMBA数码显微镜(麦克奥迪实业集团有限公司);光学显微镜(Nikon YS100);78HW-1型恒温磁力搅拌器(杭州仪表电机厂);冷冻干燥机(北京四环科学仪器厂);LC-10ATVP高效液相色谱泵(日本岛津株式会社);SPD-10AVP高效液相检测器(日本岛津株式会社);柱温箱(大连中汇达科学仪器有限公司);ZRS-8G智能溶出试验仪(天津大学无线电厂)。
2 方法与结果
2.1 白芍提取物的制备
将白芍饮片粉碎过20目筛,取100g,加80%乙醇200ml,回流提取2次,每次2h[2],合并提取滤液,将提取液减压浓缩至稠膏,于真空干燥箱内60℃干燥至恒重,称取提取物0.02g,加水超声定容至10ml容量瓶中,用离心机离心20min(4 000 r/min),取上清,定容10ml,抽滤,得上柱液。取该液35ml,用AB-8型大孔吸附树脂吸附,选择5倍柱体积的25%乙醇为洗脱剂,洗脱流速为6ml/min。收集洗脱液,于60℃干燥,最终得白芍提取物。以指标成分芍药苷为代表,其含量占提取物的33%。
2.2 白芍提取物肠溶微囊的制备
本文采用改进的相凝聚法制备微囊[3]。将10g的Eudragit L100溶于100ml丙酮中制成胶液,4.2g白芍提取物中加入少许span-60润湿后,加入Eudragit L100胶液中,作为油相。将HPMC溶于0.1mol/L的磷酸盐缓冲液(pH 7.2)中制成1%HPMC溶液作为水相。将15ml的1%HPMC溶液逐渐滴加到10ml的油相中,于750rpm搅拌10min后,并逐渐升温至45℃,溶液出现浑浊,继续搅拌5min。然后加入同温度下50ml蒸馏水,继续搅拌10min,迅速将混悬液于2500rpm离心10min,然后冷冻干燥,即得微囊。通过此工艺所制得的微囊外观圆整,平均粒径为(460±120)μm,微囊的光学显微镜照片如图1。
2.3 微囊中白芍提取物含量的测定
2.3.1 最大吸收波长的选择 分别称取芍药苷对照品和按处方投药比制备的空白微囊,用pH6.8的磷酸盐缓冲溶液与无水乙醇液(1∶1)溶解,配成浓度约为10μg/ml的2份试液,在190~310nm波长范围内进行扫描。扫描图见图2。由图可知,芍药苷于230nm处有最大吸收,辅料在此波长范围内对检测无影响,所以选择波长λ=230nm处测定芍药苷。
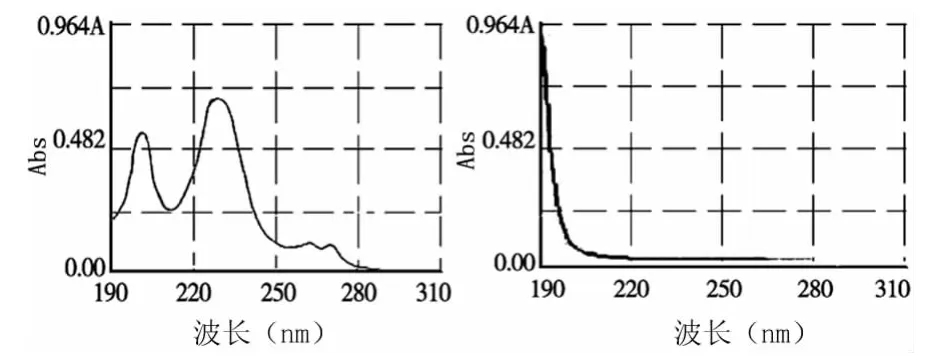
图2 检测波长的确定
2.3.2 色谱条件 色谱柱:ODS C18柱(250×4.6mm,5μm迪马公司);流动相:乙腈-水-甲醇(60∶25∶15);检测波长:230nm;流速:1.0ml/min;柱温:30℃;进样量:20μl。
2.3.3 标准曲线的绘制 精密称取芍药苷对照品4.2mg,置于100ml量瓶中,用pH6.8的磷酸盐缓冲溶液与无水乙醇液(1∶1)溶解并稀释至刻度,摇匀,作为贮备液。分别精密吸取贮备液2.0、4.0、6.0、8.0和10.0ml于10ml量瓶中,用pH6.8的磷酸盐缓冲溶液与无水乙醇液(1∶1)稀释至刻度,摇匀,作为标准供试液。精密取各供试液20μl,进样,按上述色谱条件测定,重复操作3次,测定结果见表1。以峰面积(A)对浓度(C)进行线性回归,得标 准 曲 线 方 程A=121619C-102160,R2=0.9992,标准曲线见图3。芍药苷在8.4~42.0 μg/ml范围内,线性关系良好(r=0.9996)。
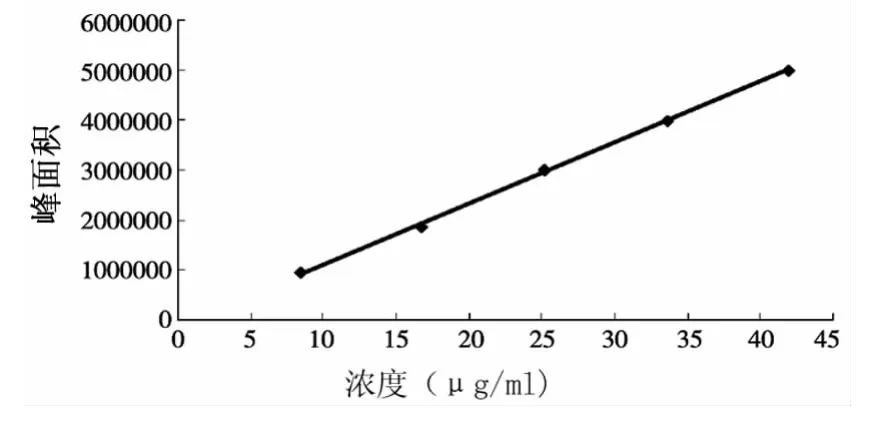
图3 芍药苷含量测定标准曲线
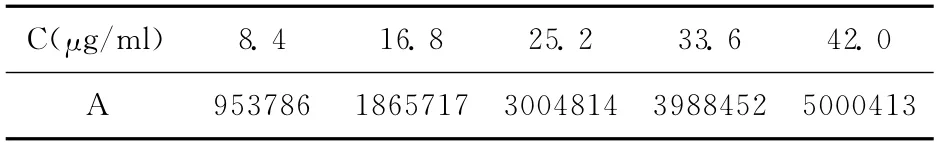
表1 芍药苷浓度的测定
2.3.4 仪器精密度考察 取中间浓度的标准供试液,连续进样6次,测定峰面积,计算RSD为1.42%;连续6d求得日间含量的RSD为1.83%。
2.3.5 溶液稳定性考察 取中间浓度的标准供试液,分别于0、4、8、12、24h进样,测定芍药苷的峰面积。结果表明,24h内峰面积的RSD为1.67%,说明样品稳定性良好。
2.3.6 加样回收率 称取空白微囊适量,用pH6.8的磷酸盐缓冲溶液与无水乙醇液(1∶1)溶解制备空白样品溶液。精密量取芍药苷标准贮备液(52μg/ml)2.0、4.0、8.0ml各3份于10ml容量瓶中,用空白样品溶液定容10ml,进样,测定其峰面积,根据标准曲线计算浓度,求得平均加样回收率为100.24%,相对标准偏差为1.64%。结果见表2。
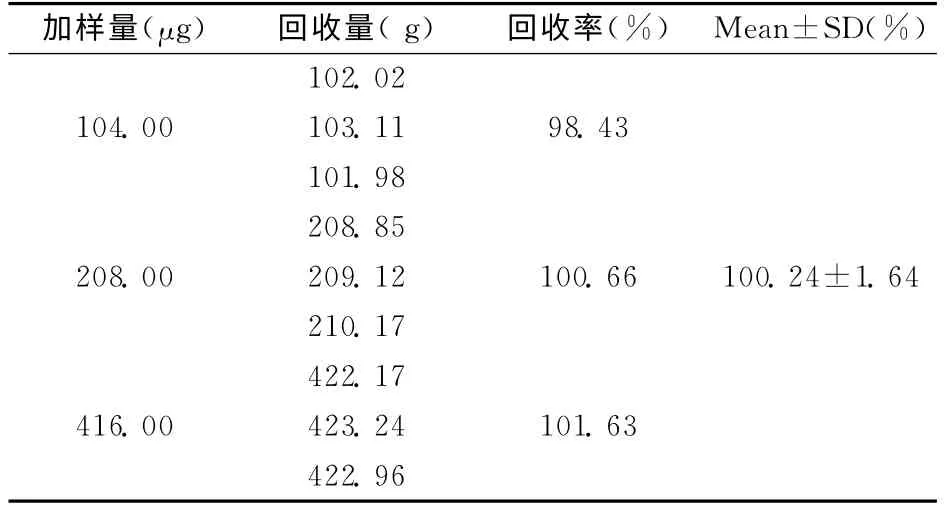
表2 芍药苷回收率的测定(n=3)
2.3.7 载药量、包封率的确定 精密称取制得的微囊10mg于100ml容量瓶中,加入50ml pH6.8的磷酸盐缓冲溶液与无水乙醇液(1∶1)振摇溶解,然后定容100ml。进样,测定峰面积,根据标准曲线计算浓度,依据下式计算微囊载药量与包封率:
载药量=微囊中所含芍药苷的量/(0.33×微囊的总量)×100%
包封率=微囊中所含芍药苷的量/(0.33×白芍提取物投药量)×100%
2.4 释放度的测定
精密称取制得的微囊100mg,3份,按《中国药典》2010版二部释放度测定方法[4],首先将微囊投放至0.1mol/L的盐酸溶液500ml中,在(37±0.5)℃,100rpm条件下,分别于10、20、40、60、90、120 min取样5ml(同时补充同体积同温新鲜溶出介质),用0.22μm微孔滤膜过滤,依法测定其峰面积,计算样品浓度,并计算累积释放百分率。2h后,于上述酸溶液中加入的0.2mol/L的磷酸盐缓冲液250ml,同时以2mol/L的NaOH溶液调节pH值至6.8,在(37±0.5)℃,100rpm条件下,同时开始计时,分别于30、45、60、90、120min后取样5ml,用0.22μm微孔滤膜过滤,依法测定其峰面积,计算样品浓度,并计算累积释放百分率。结果见图4。

图4 白芍提取物肠溶微囊在人工胃液、肠液中释放结果
3 结果与讨论
经过本法提取纯化的白芍提取物,水溶性差,在50%以上的乙醇溶液中溶解良好,亦可溶于丙酮中,因此本文选择将白芍提取物加入到EudragitL100的丙酮溶液中作为油相。同时在测定载药量和包封率时,选用pH6.8的磷酸盐缓冲溶液与无水乙醇液按1∶1的比例作为微囊的良溶剂。
在筛选微囊的最佳处方工艺时,通常以载药量和包封率为指标。本文所制备的微囊载药量为92.3%,而包封率仅为43.04%,主要考虑的是为防止剂量过大,为今后制备口腔崩解片打下基础。
[1] 崔亚男,王东凯,邱志斌.2种溶血性试验方法在复方参芍注射剂研究中的应用[J].中国药房,2007,18(3):182-183.
[2] 崔亚男,王东凯,邱志斌,等.复方参芍注射剂制备工艺的研究[J].中成药,2007,29(3):447-450.
[3] Dong W,Bodmeier R.Encapsulation of lipophilic drugs within enteric microparticles by a novel coacervation method[J].Int J Pharm,2006,326:128-138.
[4] 国家药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2010.
