颈椎黄韧带叠压症兔黄韧带TGF-β1的表达*
2013-06-09孟纯阳王海滨贾存岭赵益峰贾代良
吴 彬 孟纯阳 王海滨 贾存岭 赵益峰 贾代良
(济宁医学院附属医院,山东 济宁272029)
颈椎病患者病因与颈椎间盘退变、关节突增生及黄韧带肥厚密切相关[1-2],其中黄韧带肥厚在颈椎病的发病中起了重要的作用[3-4]。在此过程中,黄韧带发生了何种组织学改变及细胞因子的变化,文献鲜见报道。本文通过手术破坏新西兰大白兔颈5/6椎间稳定结构,引起后方黄韧带退变增生,在颈椎后伸时增生的黄韧带突入椎管,造成对脊髓的压迫,建立兔颈椎黄韧带叠压模型,观察黄韧带形态学、生物化学方面的变化。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康3月龄新西兰大白兔48只,雌雄不限,普通级,质量(3000±250)g,合格证号:SCXK(鲁)20110013,由山东农业科学院畜牧兽医研究所提供。
1.1.2 主要试剂及仪器 胰蛋白酶购自美国Sigma公司,免疫组化TGF-β1试剂盒购自武汉博士德生物工程有限公司。
1.2 实验方法
1.2.1 颈椎叠压症动物建模 48只新西兰大白兔随机分为2组,每组24只动物,模型组通过颈椎前路穿刺破坏纤维环及抽吸颈5/6髓核组织的办法建立黄韧带叠压动物模型。10%水合氯醛(300mg/kg)腹腔注射麻醉,动物取仰卧位,以颈5为中心取前路纵切口长约3cm,逐层切开,钝性分离,显露颈5/6椎间盘,针刺法破坏纤维环并抽吸髓核组织,彻底止血后缝合深筋膜及皮肤,术中注意观察呼吸、心率的变化,术后分笼喂养,肌注青霉素1周,4×105u/d,对照组动物不作处理。术后让动物自由活动颈部。
1.2.2 颈5/6黄韧带标本处理 建模后4、8、12周分别空气栓塞法处死对照组、模型组各8只动物,锋利刀片切取颈5/6黄韧带组织,置于4%多聚甲醛中固定24h,10%EDTA中脱钙72h,流水冲洗24h,梯度酒精脱水,二甲苯透明,浸蜡包埋备用。石蜡包埋后进行连续切片备用,片厚5μm,进行苏木精-伊红染色,用日本奥林帕斯BX51显微镜进行观察,免疫组化法检测TGF-β1,一抗为TGF-β1抗体(武汉博士德生物工程有限公司),二抗为DAB显色剂ZLI-9032(北京中杉金桥生物技术有限公司),使用高温高压抗原修复,37℃温箱孵育2h,用DAB显色,阳性颗粒呈棕黄色。
1.3 统计学方法
所有数据均用±s表示,采用SPSS13.0统计分析软件进行统计学处理。
2 结果
2.1 颈5/6黄韧带组织学变化
颈5/6黄韧带组织进行苏木精-伊红染色,对照组颈5/6黄韧带纤维环排列规则,细胞排列与分层的纤维环方向一致,纤维环的细胞呈梭形,其细胞核呈长茄形。模型组整个纤维环变得粗糙,排列紊乱,玻璃样变性及色素沉着,纤维环中可见圆形的纤维软骨细胞,纤维环之间形成裂隙,术后12周时最为明显,见图1。
2.2 颈5/6黄韧带TGF-β1表达的变化
用SABC免疫组织化学方法标记黄韧带中的TGF-β1,阳性颗粒呈棕褐色,定位于基质中,呈网束状。
模型制作后4、8、12周,模型组黄韧带TGF-β1的阳性染色面积较对照组明显增加,两组比较具有显著性学意义(P<0.01);术后8周及12周组黄韧带TGF-β1的阳性面积较术后4周组减少,两两比较无统计学意义(P>0.05)。见图2、表1。

图1 两组颈5/6黄韧带组织学变化

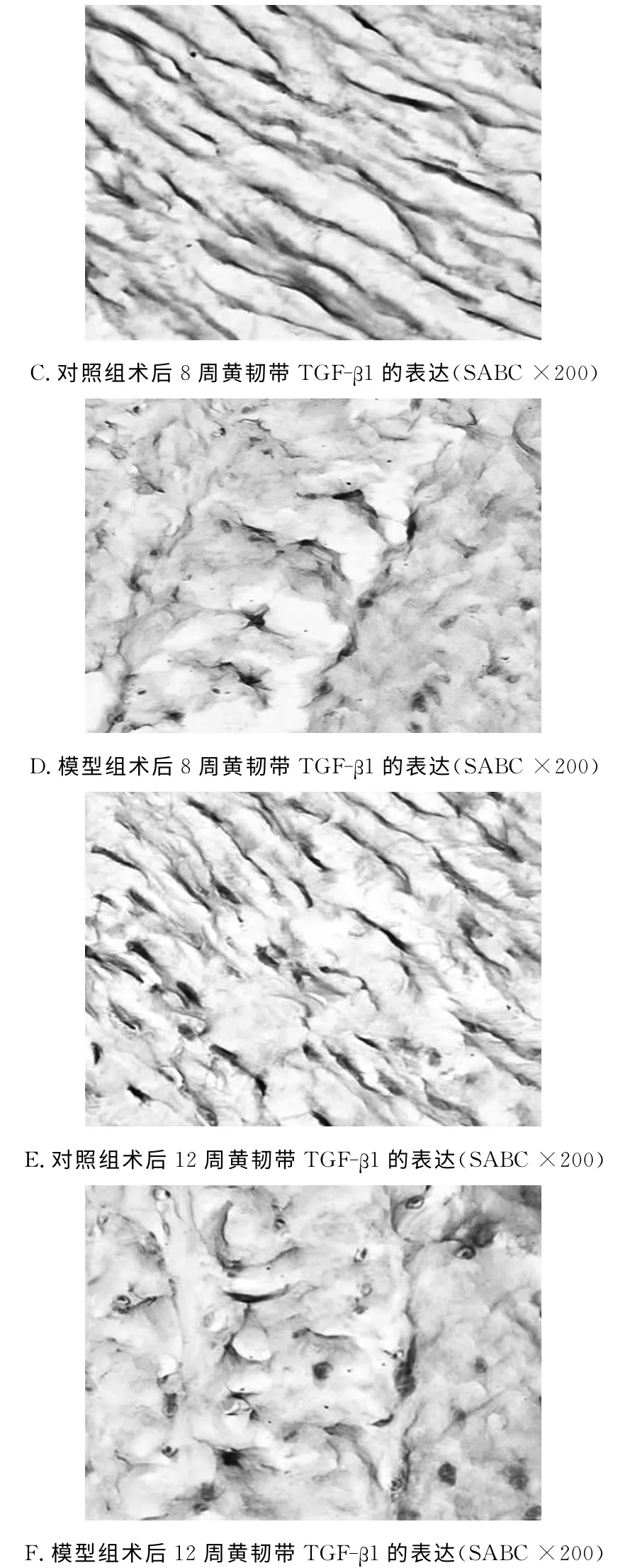
图2 两组颈5/6黄韧带TGF-β1的表达变化
表1 颈椎黄韧带叠压症C5/6黄韧带TGF-β1阳性表达面积(±s)
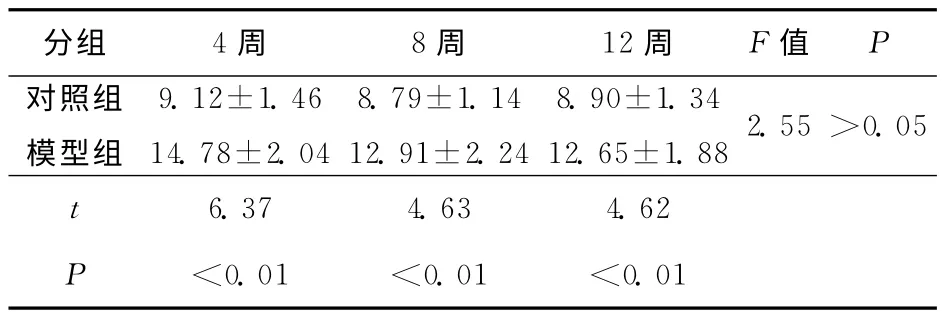
表1 颈椎黄韧带叠压症C5/6黄韧带TGF-β1阳性表达面积(±s)
分组 4周 8周 12周 F值P对照组模型组9.12±1.46 14.78±2.04 8.79±1.14 12.91±2.24 8.90±1.34 12.65±1.882.55>0.05 6.37 4.63 4.62 P <0.01 <0.01 <0.01 t
3 讨论
黄韧带连接椎弓板,从上位椎弓板的下缘和内面,连至下位椎弓板的上缘和外面,参与围成椎管的后壁和后外侧壁。黄韧带退变后拉伸增厚,颈椎后伸时黄韧带形成皱褶,突入椎管,压迫脊髓,严重者可致瘫痪,毛宾尧称之为黄韧带叠压症[5]。临床上对其研究甚少,且文献鲜见报道。本文模拟人颈椎退变的过程,前路破坏椎间盘的稳定性、降低椎间高度,造成后方黄韧带拉伸、退变,增生、肥厚,颈椎后伸时突入椎管内压迫脊髓。在此过程中我们发现TGF-β1在模型制作的早期明显增加,而随着时间的延长,未再持续增加,而是稍有下降,可能为颈椎黄韧带退变的早期刺激TGF-β1的异常表达,而退变过程中,TGF-β1可能作为加速退变的因素仍持续表达。
颈椎的稳定平衡主要由2部分来维持,一是静力性平衡,包括椎体、椎弓及其突起、椎间盘和相连的韧带结构。二是动力性平衡,主要为颈部肌肉的调节与控制[6]。上述任何一个环节遭受破坏,均可能引起或诱发颈椎正常结构及平衡功能的丧失,从而导致颈椎不稳定,加速椎间盘及后方黄韧带的退变。本文通过颈椎前侧入路,针刺破坏了纤维环,并抽吸出髓核组织,使颈椎前方稳定性下降,同时椎间高度下降,导致颈椎后方稳定性受到影响,表现为黄韧带退变、增生、肥厚,后期黄韧带突向椎管,压迫脊髓,同时黄韧带本身的形态学发生改变。对照组正常黄韧带纤维排列规则,细胞排列与分层的纤维方向一致,纤维的细胞呈梭形,其细胞核呈长茄形。而模型组整个纤维变得粗糙,排列紊乱,玻璃样变性及色素沉着,纤维之间形成裂隙,术后12周时最为明显,并出现了纤维骨化的表现。
TGF-β1是一种调节细胞生长与分化的超家族分子,几乎参与了哺乳动物所有细胞的病理生理过程,尤其在细胞外基质的产生及调控方面意义重大[7-8]。正常情况下TGF-β1在颈椎黄韧带中少量表达,当黄韧带受到刺激后表达增加,本文证实了这一点。在我们制作的模型中,椎间高度降低,颈椎稳定受到影响,后方的黄韧带生物力学改变,受刺激后发生退变,出现增生、钙化、骨化。TGF-β1在黄韧带受到刺激的早期即出现大量表达,随着时间的变化,不是持续的增长,而是在保持高水平的过程中略有下降。TGF-β1表达增加可能为黄韧带退变的首要原因及促成因素。
脊柱稳定结构对维持脊柱的正常形态和生理功能意义重大[9-11]。本实验破坏了颈椎前方静力平衡结构,这种平衡的失调导致后方黄韧带的受力改变,从而导致了黄韧带退变、增生、突向椎管,形态学表现为黄韧带纤维层次结构不清,玻璃样变性,后期出现纤维骨化,在生物化学方面表现为黄韧带中TGF-β1表达增加。
综上,前方椎间高度的降低及稳定性改变会导致后方黄韧带退变、拉伸、突向椎管,形成黄韧带叠压,引起TGF-β1的表达增加,这可能是引起黄韧带退变的主要因素之一,但由于黄韧带退变的机制较为复杂,我们研究的时间较短,是否还有其他细胞因子的参与,需要进一步的研究。
[1] Jiang SD,Jiang LS,Dai LY.Degenerative cervical spondylolisthesis:a systematic review[J].Int Orthop,2011,35(6):869-875.
[2] Ng HW,Teo EC,Lee KK,et al.Finite element analysis of cervical spinal instability under physiologic loading[J].Spinal Disord Tech,2003,16(1):55-65.
[3] Ratliff J,Voorhies R.Increased MRI signal intensity in association with myelopathy and cervical instability:case report and review of the literature[J].Surq Neurol,2000,53(1):8-13.
[4] 贾连顺.颈椎病研究的现状进展和展望[J].中国矫形外科杂志,2001,11(8):733-734.
[5] 毛宾尧,应忠追,胡裕桐,等.颈椎黄韧带叠压症[J].中国矫形外科杂志,2001,8(10):949-952.
[6] Hoogendoorn RJ,Wuisman PI,SmitTH,et al.Experimental intervertebral disc degeneration induced by chondroitinase ABC in the goat[J].Spine,2007,32(17):1816-1825.
[7] Wynn TA.Cellular and molecular mechanisms of fibrosis[J].J Pathol 2008,214(2):199-210.
[8] Gorelik L,Flavell RA.Transforming growth factor beta in Tcell biology[J].Nat Rev Immunol,2002,2(1):46-53.
[9] Smith LJ,Nerurkar NL,Choi KS,et al.Degeneration and regeneration of the intervertebral disc:lessons from development.[J]Dis Model Mech,2011,4(1):31-41.
[10]Yoon JY,Chang H,Park KB,et al.Effect of the number of involved spinal cord segments on gait function in patients with cervical spondylotic myelopathy[J].Asian Spine,2012,6(4):233-240.
[11]Kotani Y,Takahata M,Abumi K,et al.Cervical myelopathy resulting from combined ossification of the ligamentum flavum and posterior longitudinal ligament:report of two cases and literature review[J].Spine,2013,13(1):e1-e6.
