人类输卵管上皮永生化细胞系的建立及鉴定
2013-06-09高雯臧荣余王雁杨丽娜刘杨亓子豪尹胜杨恭
高雯臧荣余王雁杨丽娜刘杨亓子豪尹胜杨恭
1.复旦大学附属肿瘤医院妇科,复旦大学上海医学院肿瘤学系,上海200032;
2.复旦大学附属肿瘤医院实验研究中心,复旦大学上海医学院肿瘤学系,上海200032
人类输卵管上皮永生化细胞系的建立及鉴定
高雯1,2臧荣余1王雁2杨丽娜2刘杨1亓子豪2尹胜1杨恭2
1.复旦大学附属肿瘤医院妇科,复旦大学上海医学院肿瘤学系,上海200032;
2.复旦大学附属肿瘤医院实验研究中心,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:最近研究表明卵巢高级别浆液性癌可能起源于输卵管上皮。本课题通过基因沉默和端粒酶导入技术将原代输卵管上皮细胞永生化,为以后建立恶性转化细胞系和卵巢癌动物模型奠定基础。方法:分离并培养输卵管上皮细胞,导入p53和pRb shRNA结合hTERTcDNA,建立p53和pRb基因同时沉默并过表达hTERT的永生化细胞系,并对永生化细胞系进行连续传代、沉默基因的蛋白质印迹法(Western blot)测定、SA-β-gal染色和非停泊生长实验及体内致瘤活性鉴定。结果:我们建立了稳定表达p53、pRbshRNA和hTERT的永生化输卵管上皮细胞系:FTE248116/p53i+pRbi+hTERT及FTE312249/p53i+pRbi+hTERT。结论:可以通过导入端粒酶基因及敲除抑癌基因p53和pRb来建立永生化细胞系,并有望于构建恶性转化细胞系和人类高级别浆液性卵巢癌动物模型。
输卵管上皮细胞;p53;pRb;hTERT;永生化
卵巢癌(ovarian cancer)是致死率最高的妇科恶性肿瘤。在原发性卵巢癌中,75%~90%是上皮性癌。目前越来越多的证据表明:高级别浆液性卵巢上皮性癌起源于输卵管上皮,卵巢只是继发受累。无论从形态学分析还是经过蛋白组学分析都证实高级别浆液性卵巢癌起源于输卵管上皮[1]。正常上皮细胞在体外连续传代6~15次后出现生长阻滞、复制危机乃至衰老死亡,而癌变细胞的最大特性却是永生不老[2]。细胞永生化是细胞恶性转化的必经阶段。所谓的“永生化” 是指培养细胞在体外能稳定传代、生长,但又不发生恶性转化,即不具有癌细胞的特征,这有助于体外研究[3]。抑癌基因p53和pRb的失活是人体细胞获得永生化的必要条件[4-6]。为了克服细胞分裂过程中端粒缩短现象,在正常细胞中导入端粒酶反转录酶催化亚基基因(human telomerase reverse transcriptase,hTERT)是目前用于维持端粒结构完整和稳定的最有效途径,可防止细胞复制性衰老,使正常上皮细胞永生化[7-9]。因此,本课题用shRNA沉默p53和pRb基因表达,并结合hTERT转导的方法建立永生化的人类输卵管上皮(fallopian tube epithelia,FTE)细胞系。
1 材料和方法
1.1 组织来源
选取复旦大学附属肿瘤医院2011年手术切除标本:宫颈癌Ia期的输卵管组织,经病理证实输卵管正常。
1.2 主要试剂
细胞培养液:培养正常人类卵巢表面上皮细胞是用MCDB培养液和 M199培养液以1∶1混合,加入10%~20%的胎牛血清,20 ng/mL的上皮细胞生长因子(epidermal growth factor, EGF)和1%的青霉素及链霉素。研究表明MCDB不仅能促进正常人类卵巢表面上皮细胞的生长潜能,而且能维持其上皮表型。
胰酶2.5% trypsin购自Gibco公司。胎牛血清购自Gibco公司。MTT粉购自Sigma公司。双抗购自Biowest 公司。GENMED细胞衰老特异性β-半乳糖苷酶检测试剂盒购自上海杰美医药科技有限公司。低熔点琼脂糖购自Biowest。CK-7/17 (628701,按1∶1 000稀释)购自Biolgend公司;E-cadherin(BD 6101820,按1∶2 000稀释)购自BD公司;pRb抗体购自(G3-245,按1∶2 000稀释)购自BD公司;p53抗体(sc-1261,按1∶1 000稀释)购自Santa cruz公司;β-actin(A5441,1∶2 000)购自Sigma公司。hTERT(sc-7212,按1∶1 000稀释)购自Santa cruz公司。对照卵巢癌细胞系SKOV3 购自美国菌种保藏中心(American Type Culture Collection,ATCC)。动物实验在复旦大学上海医学院动物实验中心完成,实验动物购自BK公司。
1.3 正常输卵管上皮细胞的分离和培养
用无菌手术刀片切取输卵管标本后,立即放入无菌细胞培养皿中并将培养皿置于冰上,拿到原代细胞培养房内,此过程不超过15 min。然后在生物安全柜内操作,保证整个过程都无菌:将组织块用无菌镊子移到一个新的细胞培养皿,用加入10% 双抗的PBS温和的清洗表层上皮3次,每次5 min,然后用培养基清洗1次,洗过之后将培养基吸掉,加入新鲜培养基,用无菌手术刀片温和地刮输卵管的表面细胞,也可用刀背钝性刮取。直到把整个组织块刮到非常小不能再刮取为止。将培养皿放到37 ℃、CO2体积分数为5%的温箱进行培养。3 d之后更换培养基,一般经过5~6 d可以看到明显的贴壁细胞,以后每2 d观察1次细胞,隔3 d更换1次培养基。在正常情况下,14 d后,细胞长满培养皿。当细胞密度长到80%~90%时,用胰酶消化并以1∶3进行细胞传代。如果上皮细胞中参杂有间质细胞,可以采用以下方法移除:将培养基吸弃,加入PBS温和地冲洗2次,加入0.5 mL 0.05%的胰酶在培养皿中,左右摇晃使胰酶铺平培养皿的底部,然后在显微镜下持续观察,大约60 s后,成纤维细胞脱离皿的底部而上皮细胞仍然贴壁,此时立即用培养基中和,从而将上皮细胞和成纤维细胞分开,上皮细胞传代2~3次就可以得到纯化的上皮细胞。
1.4 检测细胞的上皮起源
显微镜下观察培养的输卵管上皮细胞的形态学特征。并用蛋白质印迹法(Western blot)检测上皮性标志:CK 7/17和E-cadherin。
1.5 以逆转录病毒感染的方式导入永生化相关基因
1.5.1 p53i+ pRbi +hTRER载体的构建
p53 shRNA构建:根据cDNA序列设计2对shRNA引物P1:5’GCAGTCACAGCA CATGACGTTCAAGAGACGTCATGTG CTGTGACTGCCCTTTTTG-3’;P2:5’AA TTCAAAAAGGGCAGTCACAGCACAT GACGTCTCTTGAACGTCATGTGCTGTGACT GCC-3’;pRb shRNA构建:根据cDNA序列设计2对shRNA引物P1:5’-GGAGAAAGTTTCATCTGTGGACTACGTA CTCCACAGATGAAACTTTCTCCCTTTTTG-3’;P2:5’-AATTCAAAAAGGGAGAAAGTTTCATCTG TGGAGTACGTAGTCCACAGATGAAAC TTTCTCC-3’;pBabe-hTERT/hygromycin由Dr Robert Weinberg惠赠,将cDNA片段酶切下来再与pBabe/p53siRNA+pRbsiRNA连接,经测序鉴定后,成功购建质粒pBabe/ p53siRNA+pRbsiRNA+hTERT(图1)。

图 1 反转录病毒载体质粒pBabe/p53siRNA+pRbsiRNA+hTERT结构示意图Fig. 1 Schematic overview of retroviral vector plasmid pBabe/p53siRNA+pRbsiRNA+hTERT
1.5.2 转染phoenix 病毒包装细胞
转染前 1 d,将phoenix细胞按1∶3密度传代于2个6 cm培养皿中,24 h后待细胞密度达70%~80%时即可用于转染。2个培养皿分别用于转染EGFP荧光质粒和p53i+pRbi+hTERT质粒。转染采用磷酸钙法:质粒20 μg,H2O 450 μL,2.5 mol/L CaCl250 μL,2×HBS (pH为7.0) 500 μL,混匀后加到培养液中,细胞放于32 ℃、CO2体积分数为5%的恒温箱进行培养。分别于12、24 h后换新鲜培养液4 mL,然后分别于转染后 48、96 h收集病毒。
1.5.3 病毒的收获
收集转染后48 h的细胞上清液,4 ℃,1 200×g离心5 min除去细胞碎片,用0.45 μm滤器过滤上清液于1.5 mL无菌EP管中,封口,于-80 ℃条件下备用。
1.5.4 感染正常输卵管表面上皮细胞
收获对数生长期正常输卵管上皮细胞, 细胞按 1∶3 密度消化传代于2个 6 cm培养皿中,37 ℃,CO2体积分数为5%的恒温箱培养 24 h,细胞贴壁后感染p53i+pRbi+hTERT病毒。吸去培养基,加入 3 mL新鲜培养基、1 mL病毒液和10 μL(4 μg/μL)polybrene轻轻混匀,32 ℃,CO2体积分数为5%的恒温箱培养 48 h后换液,加强感染1次,感染48 h后, 按 1∶4 持续传代,进行自然筛选。
1.6 永生化上皮细胞的鉴定
通过转入p53和pRb的shRNA结合hTERTcDNA的办法,建立p53和pRb基因同时沉默并过表达hTERT的永生化细胞系。建立的永生化细胞系为:FTE248116/p53i+pRbi+hTERT及FTE312249/p53i+pRbi+hTERT。并通过以下方法对上述2个细胞系进行鉴定。
1.6.1 外源基因在细胞中沉默及过表达的情况
蛋白质印迹法(Western blot)细胞总蛋白的提取通过RIPA裂解液,按照BCA试剂盒的操作步骤进行蛋白定量,Western blot的上样量为20 μg。进行10%SDS-PAGE电泳,电泳后含目的蛋白的胶电转移至PVDF膜上,5%脱脂奶粉封闭,于室温封闭3 h将封闭后的 PVDF 膜置入TBST适当稀释的一抗溶液中,4 ℃缓慢摇动过夜,室温洗膜,将PVDF膜置入以TBST 1∶2 000稀释的的二抗(羊抗鼠及羊抗兔抗体)溶液中,于室温反应1 h。辣根过氧化物酶标记的化学发光液后,在ImageQuant LAS 4000化学发光成像分析仪中进行曝光。
1.6.2 体外持续传代的能力
取第一代生长状态良好细胞,持续传代,记录传代天数,最后计算细胞的群体倍增时间。
1.6.3 衰老相关的β-半乳糖苷酶染色
在6孔板中培养细胞过夜,第2天待细胞密度达到50%~60%时,按照β-半乳糖苷酶试剂盒的说明书进行染色,之后在显微镜下拍照。
1.6.4 非停泊生长实验
双层软琼脂培养,制备底层为1.4 %、上层为0.7%的低熔点琼脂糖培养基的平皿,取对数生长期细胞,消化细胞,计数。每个6 cm平皿中接种10×105个细胞, 培养20~30 d,1周后补充上层胶。于倒置显微镜下观察细胞集落的形成,并计算形成克隆的个数。
1.6.5 裸鼠体内成瘤实验
动物实验在复旦大学上海医学院动物房完成,选用6 ~7周无胸腺裸鼠。实验分3组:FTE248116/p53i+pRbi+hTERT、FTE312249/ p53i+pRbi+hTERT及SKOV3。每组5只裸鼠,每只裸鼠接种两个点,每个点5×106个细胞。卵巢癌细胞系SKOV3作为阳性对照, 裸鼠饲养共观察6个月。
2 结 果
2.1 细胞的形态及表型
原代输卵管细胞培养 72 h,经换液后, 可见少量贴壁细胞。为单个或几个细胞的克隆,经10 d左右长满培养皿。此时贴壁细胞为圆形或离心即为第一代细胞,细胞进入对数生长期,生长迅速(图2)。经Western blot检测原代的输卵管上皮细胞高表达上皮标志CK7及E-cadherin(图3)。证明细胞系FTE248116、FTE312249是上皮细胞。永生化的细胞系FTE248116/p53i+pRbi+hTERT及FTE312249/ p53i+pRbi+hTERT 中也表达CK7及 E-cadherin,表明该永生化细胞系维持了正常的上皮表型。永生化细胞经染色体核型分析是正常的二倍体核型,无异倍体的出现。
2.2 基因沉默的鉴定结果
Western blot结果显示,永生化的细胞系FTE248116/p53i+pRbi+hTERT及FTE312249/ p53i+pRbi+hTERT低表达p53及pRb蛋白,表明这两个基因在细胞内被敲除。高表达hTERT蛋白,表明 hTERT已被稳定地转染入永生化细胞。永生化细胞端粒酶活性增强,延长并维持了端粒的长度,使细胞得以无限增殖(图4)。
2.3 群体倍增时间
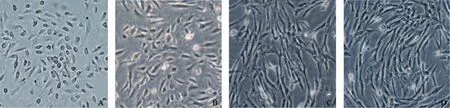
图 2 细胞的形态特征Fig. 2 Morphological characteristics of cells (×40)
永生化细胞系:FTE248116/ p53i+pRbi+hTERT及FTE312249/ p53i+pRbi+hTERT 在体外已经连续传代100次以上,还可以继续传代下去。原代细胞在长到60 d时逐渐衰老,进入生长停滞期。而永生化的细胞可以一直传代下去,在第180天仍处于对数生长期,说明永生化细胞具有无限增殖能力(图5)。

图 4 Western blot 检测永生化细胞的基因沉默及过表达情况Fig. 4 Western blot of p53, pRb and hTERT protein in immortalized cell lines
2.4 衰老相关的β-半乳糖苷酶染色结果
原代细胞在第8代时,细胞扩大变得扁平,β-半乳糖苷酶染色后蓝染细胞增多。而永生化的细胞在第60代的时候细胞仍然增殖很快,衰老相关的β-半乳糖苷酶染色后蓝染细胞很少。说明永生化细胞没有发生衰老,可以持续传代(图6)。
2.5 非停泊生长实验结果
在倒置显微镜下观察细胞集落的形成即克隆的个数。永生化细胞系FTE248116/p53i+pRbi+hTERT及FTE312249/ p53i+pRbi+hTERT在非停泊生长实验20 d后有克隆形成,而原代的细胞FTE248116及FTE312249在非停泊生长实验30 d后仍然没有克隆形成。说明永生化细胞在体外具有无限增殖的能力(图7)。
2.5 裸鼠体内成瘤实验结果
裸鼠共饲养观察6个月后仍没有观察到肿瘤形成,而对照组SKOV3在接种相同数量的细胞1周后均出现皮下移植瘤,提示永生化细胞系无致瘤性。

图 5 原代细胞及对应永生化细胞系体外培养180 d的生长曲线Fig. 5 Growth curve of parental normal cells and corresponding immortalized lines in 180 days of culture
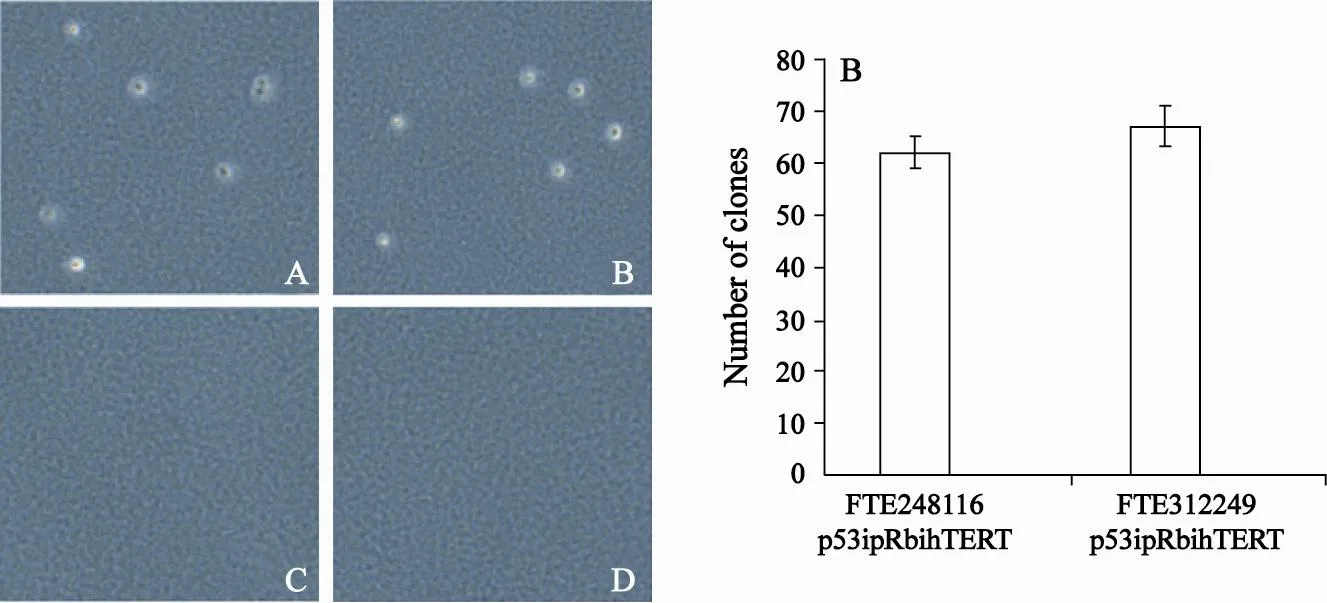
图 7 非停泊生长实验(软琼脂克隆形成实验)Fig. 7 Anchorage-independent growth assay
3 讨 论
本实验通过导入p53和pRb shRNA结合hTERTcDNA的方法,建立p53和pRb基因同时沉默并过表达hTERT的永生化细胞系。建立的细胞系明显延缓细胞的衰老并延长了细胞的传代次数,可以在体外稳定传代;而且维持了正常的上皮表型,染色体核型分析中没有异倍体的出现及染色体断裂现象,表明这是稳定的正常人类永生化细胞系。在非停泊生长实验中能形成克隆,但在体外没有致瘤活性符合永生化细胞的特性。因此,本实验建立的是成功的永生化细胞系,可望用来建立转化细胞系。本课题研究的永生化输卵管上皮细胞系的方法也可以用来永生化其他的上皮细胞,从而研究其他肿瘤的发生、发展。
目前越来越多的证据表明,卵巢上皮性癌起源于输卵管上皮,卵巢只是继发受累。世界上许多妇科肿瘤和病理科专家认为卵巢高级别浆液性癌源于输卵管上皮瘤,当这些细胞恶变并扩散到腹腔或卵巢后,很快形成典型的高级别浆液性卵巢癌[1]。之前很多研究都是基于卵巢癌细胞系来研究卵巢癌的发生、发展机制[10],本课题通过先建立永生化输卵管细胞系,后经过导入致癌基因或敲出抑癌基因,使细胞发生恶性转化,从而为探讨卵巢浆液性癌新的发生机制提供依据。
以前建立的永生化及转化细胞系经常用到病毒成分比如SV40或E6/E7,本课题研究人员也曾用SV40 T/t抗原结合hTERT成功建立了卵巢癌永生化细胞系[11]。然而自然发生的卵巢癌组织中并无猴病毒SV40大T抗原的存在,而且由于SV40大T抗原可以使p53、pRb、PP2A、p300等抑癌蛋白或一些未知蛋白丧失正常功能,因而用SV40大T抗原建立永生化的人类OSE细胞系的研究工作已逐渐被放弃[12]。如何用非病毒成分的手段建立永生化的上皮细胞系是很多科学家想要解决的问题。之前有报道用敲除p53基因同时导入hTERT基因的方法建立了永生化的卵巢上皮细胞系[13]。有研究人员只用导入hTERT基因的方法建立了永生化的卵巢上皮细胞系,维持了功能性p53和pRb的表达[14]。而本实验采用将p53和pRb shRNA和hTERTcDNA建立在一个逆转录病毒载体上,只需转染一个质粒就可以达到同时敲除p53和pRb及过表达hTERT的多重作用,并且提高了细胞永生化的效果。
[1] LI J, FADARE O, XIANG L, et al. Ovarian serous carcinoma: recent concepts on its origin and carcinogenesi[J]. J Hematol Oncol, 2012, 5: 8.
[2] LI N F, WILBANKS G, BALKWILLl F, et al. A modified medium that significantly improves the growth of human normal ovarian surface epithelial (OSE) cells in vitro[J]. Lab Invest, 2004, 84(7): 923-931.
[3] SHAY J W, WRIGHT W E. Senescence and immortalization: role of telomeres and telomerase[J]. Carcinogenesis, 2005, 26(5): 867-874.
[4] YE X, ZERLANKO B, ZHANG R, et al. Definition of pRB-and p53-dependent and -independent steps in HIRA/ASF1amediated formation of senescence-associated heterochromatin foci[J]. Mol Cell Biol, 2007, 27(7): 2452-2465.
[5] HAFERKAMP S, TRAN S L, BECKER T M, et al. The relative contributions of the p53 and pRb pathways in oncogeneinduced melanocyte senescence[J]. Aging (Albany NY), 2009, 1(6): 542-556.
[6] VERMEULEN K, VAN BOCKSTAELE D R, BERNMAN Z N. The cell cycle: a review of regulation, deregulation and therapeutic targets in cancer[J]. Cell Prolif, 2003, 36(3): 131-149.
[7] RAMIREZ R D, SHERIDAN S, GIRAAD L, et al. Immortalization of human bronchial epithelial cells in the absence of viral oncoproteins[J]. Cancer Res, 2004, 64(24): 9027-9034.
[8] MASUTOMI K, YU E Y, KHURTS S, et al. Telomerase maintains telomere structure in normal human cells[J]. Cell, 2003, 114(2): 241-253.
[9] SEALEY, D C, ZHENG L, TABOSKI M A, et al. The N-terminus of hTERT contains a DNA-binding domain and is required for telomerase activity and cellular immortalization[J]. Nucleic Acids Res, 2010, 38(6): 2019-2035.
[10] SHAN W W, LIU J.Epithelial ovarian cancer: focus on genetics and animal models[J]. Cell Cycle, 2009, 8(5): 731-735.
[11] LIU J S, YANG G, THOMPSON-LANZA J A, et al. A genetically defined model for human ovarian cancer[J]. Cancer Res, 2004, 64(5): 1655-1663.
[12] JUNGH H M, CHOI S J, KIM J K. Expression profiles of SV40-immortalization-associated genes upregulated in various human cancers[J]. J Cell Biochem, 2009, 106(4): 703-713.
[13] YANG G, ROSEN D G, MERCADO-URIBE I, et al. Knockdown of p53 combined with expression of the catalytic subunit of telomerase is sufficient to immortalize primary human ovarian surface epithelial cells[J]. Carcinogenesis, 2007, 28(1): 174-182.
[14] LI N F, BROAD S, LU Y J, et al. Human ovarian surface epithelial cells immortalized with hTERT maintain functional pRb and p53 expression[J]. Cell Prolif, 2007, 40(5): 780-794.
Immortalization of human fallopian tube epithelial cells
GAO Wen1,2, ZANG Rong-yu1, WANG Yan2, YANG Li-na2, LIU Yang1, QI Zi-hao2, YIN Sheng1, YANG Gong2(1.Departements of Gynecological Oncology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2.Cancer Research Laboratory, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
YANG Gong E-mail: yanggong@fudan.edu.cn
Background and purpose: Recent researches indicate that high grade serous ovarian carcinoma is derived from fallopian tube epithelial malignancy. In this study, we used primary fallopian tube epithelium to establish the immortalized cell lines by silencing of tumor suppression genes and introduction of hTERT, in order to further build malignant cell lines and ovarian cancer animal models. Methods: Primary fallopian tube epithelia were isolated and transfected with a plasmid containing pRb and p53 shRNAs combined with hTERT to establish immortalized cell lines. The resulting cells were validated through examining cell population doublings, p53 and pRb expression, SA-β-gal activity; anchorage-independent growth and in vivo tumorgenesis. Results: We successfully established two immortalized fallopian tube epithelial cell lines: FTE248116/p53i+pRbi+hTERT, FTE312249/p53i+pRbi+hTERT through silencing of p53 and pRb and introduction of hTERT simultaneously. Conclusion: The establishment of immortalized cell lines can be accomplished by introduction of p53 and Rb shRNA and overexpression of hTERT, and these cells may be used to establish the transformed cell lines and ovarian cancer animal models.
Human fallopian tube epithelia cells; p53; pRb; hTERT; Immortalization
10.3969/j.issn.1007-3969.2013.04.00X
R737.32
:A
:1007-3639(2013)04-0241-07
2013-02-25
2013-03-20)
国家自然科学基金项目(No: 81171911)。
杨恭 E-mail:yanggong@fudan.edu.cn
