ELISA高通量筛选PIM靶向抑制剂的研究
2013-06-09尚琨张鹏周璐王瑧曹越李影奕
尚琨张鹏周璐王瑧曹越李影奕
1.复旦大学附属肿瘤医院实验研究中心,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学药学院,上海 201203
ELISA高通量筛选PIM靶向抑制剂的研究
尚琨1张鹏2周璐2王瑧1曹越1李影奕1
1.复旦大学附属肿瘤医院实验研究中心,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学药学院,上海 201203
背景与目的:Pim家族是具有丝氨酸/苏氨酸激酶活性的原癌基因,包括Pim-1、Pim-2、Pim-3。研究发现,Pim能够抑制细胞凋亡,促进细胞增殖,导致肿瘤发生。本研究利用ELISA反应原理建立高通量筛选体系,对Pim抑制剂进行筛选,为药物的应用和解决恶性肿瘤临床治疗的难题提供研究基础。方法:通过计算机辅助药物设计的手段,以蔓生百部碱母核三环酰胺作为核心结构合成系列衍生物;利用Pim重组蛋白和Bad重组蛋白可以与Ni2+特异性结合的亲和层析原理进行重组蛋白的纯化精制;利用ELISA方法,通过Pim激酶磷酸化促凋亡蛋白分子Bad在112位丝氨酸的反应,建立筛选Pim靶向抑制剂的体系。结果:0.01 mmol/L的IPTG在37 ℃条件下,诱导Bad蛋白2 h,可以获得最大量的可溶性Bad重组蛋白;0.02%的阿拉伯糖在37 ℃条件下,诱导Pim-1、Pim-2、Pim-3蛋白3 h,可以获得最大量的Pim重组蛋白;ELISA结果显示,Pim激酶与Bad底物之间的作用存在剂量依赖性反应关系,进而成功建立药物筛选体系;初步筛选出低分子化合物T-18,在体外能有效抑制Pim激酶活性。结论:利用ELISA反应原理建立的筛选药物方法,是一种经济、简单、快速、高效、敏感的筛选手段,并初步筛选出小分子化合物T-18,能够抑制Pim激酶活性,阻断Pim对凋亡蛋白分子Bad的磷酸化过程,进而抑制肿瘤的发生。
Bad;Pim;ELISA,;药物筛选;Pim靶向抑制剂
[Key words]Bad; Pim; ELISA; Drug screening; Pim kinase inhibitors
Pim家族是具有丝氨酸/苏氨酸激酶活性的原癌基因,包括Pim-1、Pim-2、Pim-3[1]。Pim蛋白对某些正常的或肿瘤细胞的增殖和细胞周期具有调节功能,能增强细胞的抗凋亡作用[2]。Pim-1最早是作为莫罗尼小鼠白血病病毒的前病毒插入点而被发现[3]。同时,Pim-1激酶也是丝氨酸激酶和(或)苏氨酸激酶Pim家族的第一位成员,随后发现其也在前列腺癌[4]、急性髓细胞性白血病[5]等恶性肿瘤中过度表达。Pim-2也被证实为一个MMLV前病毒整合的共同位点,能导致T细胞淋巴瘤的发生[6]。Pim-2的反义核苷酸已被证实具有抑制前列腺肿瘤DU2145细胞系的增殖作用[7]。Pim-3最初是由大鼠细胞系PC12去极化诱导的基因而被首先报道[8]。最近研究发现,Pim-3蛋白在内胚层来源的肝癌[9]、胰腺癌[10]、结肠癌[11]和胃癌[12]组织中过度表达,而在正常组织中不表达,还发现在胰腺癌细胞株中,Pim-3通过磷酸化凋亡蛋白分子Bad,使其失活,从而抑制胰腺癌细胞的程序化死亡[10]。
在使用小分子化合物对肿瘤治疗的研究方面,蛋白激酶已成为一个主要的靶点[13]。针对Pim的抑制剂是通过与ATP竞争性结合Pim的ATP结合位点,抑制Pim激酶活性,从而抑制Pim的底物磷酸化,抑制肿瘤发生。我们之前的研究发现,以蔓生百部碱为基础合成的各种衍生化合物即是针对Pim的分子靶向治疗药物[14],能够抑制Pim激酶活性,促进肿瘤细胞凋亡。因此,本实验是在此基础上通过ELISA实验建立高通量筛选体系,筛选出抑制Pim激酶的小分子化合物,为分子靶向治疗恶性肿瘤奠定研究基础。
1 材料和方法
1.1 试剂
大肠杆菌感受态细胞DL21和DL21(DE3)分别购自全式金生物技术有限公司和天根生化科技有限公司,IPTG和阿拉伯糖购自Sigma公司,考马斯亮蓝R250为Amresco公司产品,氨苄青霉素购自Sigma公司,卡那霉素购自天根生化科技有限公司,Bugbuster蛋白抽提试剂、核酸酶和溶菌酶为Merck公司产品,蛋白酶抑制剂为Roche公司产品,Ni2+填料为GE healthcare公司产品,尿素和咪唑购自经科宏达生物有限公司,ELISA专用96孔板为Merck公司产品,激酶缓冲液和ATP为Cell Signaling technology 公司产品,兔抗人pBad(Ser112)抗体为Cell Signaling technology 公司产品,碱性磷酸酶标记的二抗为Pierce公司产品,磷酸对硝基苯酯和二甲基亚砜(DMSO)购自Sigma公司。
1.2 Bad蛋白的表达和纯化
含有人全长Bad cDNA核苷酸序列的重组质粒pET29a-Bad转入大肠杆菌感受态细胞DL21(DE3)中,在含有卡那霉素的培养基中培养,用分光光度计测得A值为0.4~0.6时,加入不同浓度(0.1、0.5、1.0 mmol/L)的IPTG诱导Bad蛋白表达,37 ℃分别诱导2、3 h,以未加入IPTG作为阴性对照组,经过SDS-PAGE以及考马斯亮蓝染色后,确定能够最大诱导Bad蛋白产生的浓度和时间,并在此条件下,进行Bad蛋白的大量表达。
收集大肠杆菌菌体沉淀,加入蛋白抽提试剂Bugbuster(含有蛋白酶抑制剂和溶菌酶),室温下摇床温育20 min,4 ℃离心收集上清液。将上清液加入到Ni2+柱中,随后依次加入漂洗缓冲液(300 mmol/L NaCl、50 mmol/L PBS、20 mmol/L咪唑,pH为8.0)和洗脱缓冲液(300 mmol/L NaCl、50 mmol/L PBS、250 mmol/L咪唑,pH为8.0),收集纯化后的Bad蛋白,经SDS-PAGE以及考马斯亮蓝染色后确定纯度。
1.3 Pim蛋白的表达和纯化
含有人全长Pim-3 cDNA核苷酸序列的重组质粒pBAD/Thio-TOPO-pim-3转入大肠杆菌感受态细胞DL21中,在含有氨苄青霉素的培养基中培养,用分光光度计测得A值为0.4~0.6时,加入不同浓度(0.02%、0.1%、0.2%)的阿拉伯糖诱导Pim-3蛋白表达,37 ℃诱导3 h,以未加入阿拉伯糖作为阴性对照组,经过SDS-PAGE以及考马斯亮蓝染色后,确定能够最大程度诱导蛋白表达的浓度和时间。并分别取该浓度下的全菌液、上清液和沉淀,染色后确定蛋白的含量。大量诱导Pim-3蛋白,收集大肠杆菌菌体沉淀,加入蛋白抽提试剂Bugbuster(含有蛋白酶抑制剂和溶菌酶),室温下摇床温育20 min,4 ℃离心收集沉淀。用8 mol/L尿素(pH为7.8)变性蛋白,4 ℃离心收集上清液加入到Ni2+柱中,随后依次加入漂洗缓冲液(500 mmol/L NaCl、20 mmol/L磷酸盐缓冲液、8 mol/L尿素,PH为6.0)和洗脱缓冲液(500 mmol/L NaCl、20 mmol/L磷酸盐缓冲液、8 mol/L尿素、200 mmol/L咪唑,pH为4.0),收集纯化后的Pim-3蛋白,经SDS-PAGE以及考马斯亮蓝染色后确定纯度。最后对变性后的纯化蛋白通过透析的方式进行复性。
人全长Pim-1 和Pim-2 cDNA核苷酸序列插入到pBAD/Thio-TOPO载体中,Pim-1和Pim-2重组蛋白的精制方法同Pim-3。
1.4 ELISA筛选体系的建立
已有研究表明,Pim家族激酶能够使Bad(Ser112)蛋白发生磷酸化[10,15-16],因此可以建立体外激酶活性检测体系。首先,96孔板每孔包被100 μL pH为9.6的碳酸盐缓冲液(含Bad蛋白3 μg/mL)4 ℃温育过夜。洗板3次后,PBS(1%BSA) 37 ℃封闭1 h,洗板3次,加入40 μL激酶缓冲液、ATP及各种不用浓度梯度的激酶30 ℃反应1 h。随后分别加入100 μL兔抗人pBad(Ser112)抗体和相应二抗,37 ℃反应1 h,最后每孔100 μL磷酸对硝基苯酯室温避光反应30 min进行显色,出现明显颜色差异时,用3 mol/L NaOH中止反应。利用多功能酶标仪检测405mm和450 nm时的A值。有些实验反应在ELISA反应液中加入一定浓度的小分子化合物一起温育。
1.5 蔓生百部碱合成中间体的制备
蔓生百部碱合成中间体依据前述制备[17]。合成顺序依次为T-10>T-6、 T-10>T-4>T-5、T-10>T-2>T-3、T-10>T-18。实验开始前将该化合物溶于DMSO中,终浓度为100 mmol/L。已有文献报道,T-2能够抑制Pim的活性,故此作为阳性对照;而T-10作为阴性对照[14]。
1.6 统计学处理
实验数据采用SPSS 17.0软件进行整理和统计分析。计量数据以表示,采用χ2检验和Student’s t-test对资料进行统计分析, P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结 果
2.1 Bad蛋白诱导条件的确立和精制纯化
在IPTG浓度分别为0.1、0.5、1.0 mmol/L的条件下分别诱导Bad重组蛋白,以不加IPTG组为阴性对照。考马斯亮蓝染色结果显示,与阴性对照组相比较,在IPTG存在的条件下,检测到Bad蛋白表达条带,当浓度为0.1 mmol/L时检测到Bad重组蛋白表达量最多,其相对灰度值之间差异有统计学意义(P<0.05)。而不同诱导时间的蛋白表达差异无统计学意义(P>0.05),考虑到IPTG对大肠菌生长的毒性影响,我们选择采用0.1 mmol/L IPTG处理2 h,在37 ℃条件下,诱导表达Bad重组蛋白。纯化的Bad蛋白带有His标签,可以与Ni2+发生特异性结合,在低浓度咪唑条件下漂洗杂蛋白,高浓度咪唑条件下洗脱目的蛋白,根据这一原理,我们对Bad蛋白进行了纯化。考马斯亮蓝染色结果显示,只有单一目的条带(图1A、B)。提示Bad蛋白精制纯化成功,蛋白纯度可达到95%以上,能够用于体外Pim激酶反应。
2.2 Pim蛋白诱导条件的确立和精制纯化
在阿拉伯糖浓度分别为0.02%、0.1%、0.2%的条件下诱导Pim-3蛋白,以不加阿拉伯糖诱导组为阴性对照。考马斯亮蓝结果显示(图2A),在阿拉伯糖存在条件下,检测到Pim-3蛋白表达条带,当浓度为0.02%时检测到Pim-3重组蛋白表达量最多,其相对灰度值之间有显著差异。
有文献报道,Pim家族蛋白为包涵体蛋白[18]。因此,本研究在0.02%阿拉伯糖条件下诱导Pim蛋白,分别取全菌液、沉淀、上清液检测(图2B),Pim-3蛋白主要存在于沉淀中,是以包涵体的形式存在。因此,对其的纯化方法选用了变性复性的方式进行。本研究采用了同样的诱导条件诱导Pim-1和Pim-2重组蛋白的表达。
纯化的Pim蛋白带有His标签,可以与Ni2+发生特异性结合,根据这一原理,我们对Pim蛋白进行了纯化。洗脱下来的Pim蛋白在PBS缓冲液中,采用尿素浓度梯度透析方法复性。考马斯亮蓝染色结果显示,只有单一目的条带(图2C和图3)。提示Pim蛋白精制纯化成功,蛋白纯度可达到95%以上。
2.3 ELISA体系建立
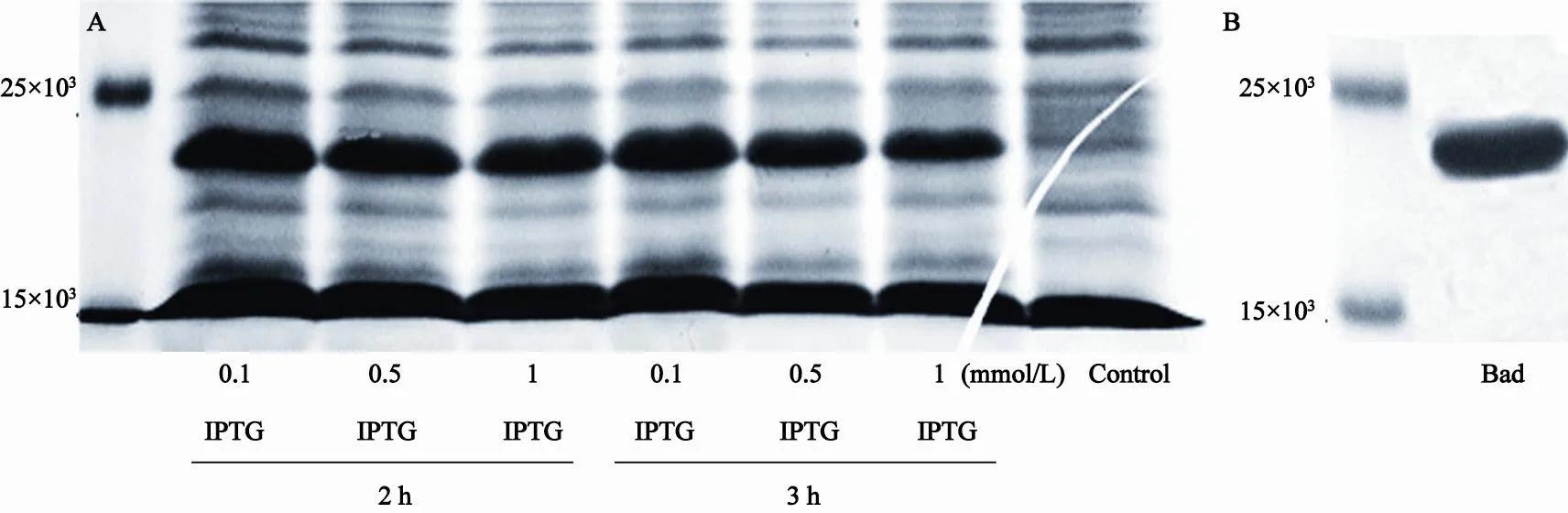
图 1 IPTG诱导凋亡蛋白Bad的表达以及Bad重组蛋白的精制纯化Fig. 1 The expression of Bad protein induced by IPTG and the purification of recombinant Bad protein

图 2 阿拉伯糖诱导Pim-3重组蛋白的表达以及Pim-3重组蛋白的精制纯化Fig. 2 The expression of Pim-3 protein induced by arabinose and the purification of recombinant Pim-3 protein

图 3 Pim-1和Pim-2重组蛋白的精制纯化Fig. 3 The purification of recombinant Pim-1 and Pim-2 proteins
本研究利用体外Pim激酶活性测定体系,检测了上述精制纯化蛋白的活性。在不同Pim激酶剂量(0、10、20、40、80、160、320 ng)梯度条件下,检测其对底物Bad蛋白的磷酸化反应,结果显示,随着Pim激酶剂量的增加,A值呈现上升趋势,当Pim激酶达到一定剂量时,Bad的磷酸化达到饱和,随着Pim激酶剂量继续增加A值呈现平台期(图4)。提示Pim激酶活性测定的ELISA体系成功建立,可以用于分子靶向治疗药物的筛选。

图 4 ELISA方法测定Pim激酶活性Fig. 4 The determination of Pim kinase activity by ELISA
2.4 T-18可以抑制Pim激酶活性
Li等[14]的实验结果显示,蔓生百部碱合成中间体T-2可以在体内和体外抑制Pim-3的激酶活性,促进肿瘤细胞凋亡,抑制细胞增殖。本研究以T-2为先导化合物合成了一系列小分子化合物,利用体外Pim激酶活性测定体系,以T-10为阴性对照,T-2为阳性对照,对这些化合物进行了初筛。结果发现其中T-18可以一定程度抑制Pim激酶的活性(图5,表1),并且T-18对Pim-1和Pim-2激酶活性的抑制程度与Pim-3类似(图5A)。显示Pim-1、Pim-2和Pim-3在激酶结构域中有类似结构。Akt/PKB蛋白激酶可以磷酸化相似的作用底物Bad。因此,我们进一步探讨了T-18对Akt1 和Akt2 激酶活性的影响。Akt1/2,是Akt1和Akt2激酶的特异性抑制剂,能明显抑制Akt1 和Akt2的激酶活性,而T-18对其没有抑制效果(图5B)。因此,T-18可能特异性地抑制Pim激酶活性。
3 讨 论
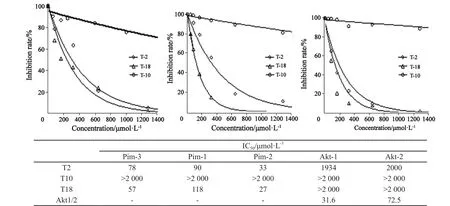
图 5 小分子化合物对Pim激酶活性的抑制作用Fig. 5 The inhibitory activities of stemonamide synthetic intermediates on Pim kinase.
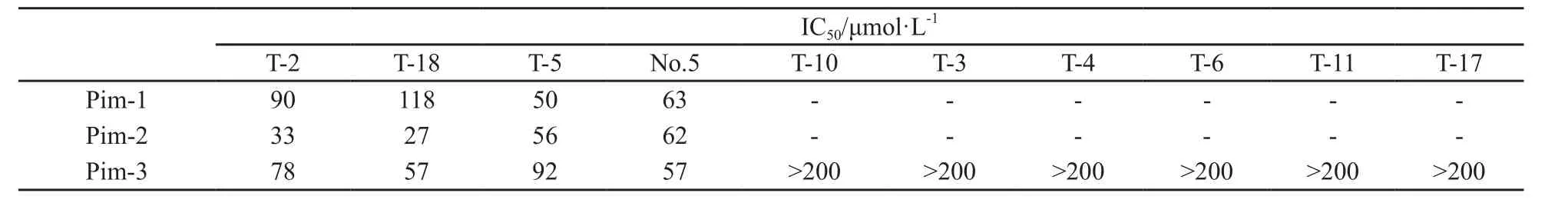
表 1 小分子化合物对Pim激酶的半数抑制剂量Tab. 1 The inhibitory activities of stemonamide synthetic intermediates on Pim kinase
恶性肿瘤是人类生命的主要杀手之一,由于传统治疗手段存在的缺点,分子靶向治疗被认为是一种具有发展前景的治疗方法,而蛋白激酶则成为了一个主要的靶点。作为靶向分子,应该具备在正常组织中不表达,而在肿瘤组织中过度表达,并且在肿瘤细胞的过度增殖中起到了不可或缺的调节作用,Li等[10]认为,Pim具备作为靶向治疗分子的条件。因此,能够进一步筛选出针对Pim激酶活性的特异性强,单位抑制剂量范围内抑制效果更强的小分子化合物,将具有重要的科学意义和应用前景。而在筛选药物时,建立一个能够在普通实验室里完成,且经济、简单、快速、有效、高通量的体外筛选体系至关重要。
高通量药物筛选是一种优化的微量分析方法,是药物研制开发早期的最重要工具之一。利用这一技术能够快速地进行大量药物筛选,从中找到能选择性作用于靶点的具有生物活性的化合物[19]。其中, ELISA是一种极为敏感的检测方法,而且应用极为广泛。有报道显示,可以用ELISA方法高通量筛选拮抗性类肽药物防治自身免疫病[20]。因此,本实验也是通过建立ELISA体系筛选分子靶向药物。我们发现,Pim能够使凋亡蛋白分子Bad发生磷酸化,提示通过大肠杆菌提取的Pim蛋白具有激酶活性,并发现在不同剂量梯度下,Bad的磷酸化水平呈现上升趋势,并能达到饱和,根据Pim和Bad之间存在的这一剂量依赖性反应关系,进而成功建立药物筛选体系,并对能够抑制Pim激酶活性的分子靶向药物进行筛选,使获得的药物具备Pim选择性强以及单位剂量抑制性强的特点。
Akt也是具有丝氨酸/苏氨酸活性的蛋白激酶,与Pim-3有相似的作用底物。Akt也可以磷酸化促凋亡蛋白分子Bad,诱导肿瘤细胞过度增殖。Amaravadi等[21]认为,Akt是一个很好的靶向治疗分子。Rhodes等[22]报道Akt的抑制剂GSK690693在一期临床实验中显示了潜在的抗肿瘤活性。Akt-1、Akt-2、Akt-3广泛表达在各种正常组织和器官,参与正常的生理活动。有报道显示,敲除Akt的表达,可引起新生小鼠死亡、生长迟缓及脑发育不全[23-25]。Pim家族是选择性表达在一些组织器官。Pim-1、Pim-2、Pim-3同时敲除,对小鼠的生长没有显著影响[26],提示Pim蛋白激酶在正常生理活动中不起主要作用。因此,开发针对Pim-3的抑制剂,其产生的不良反应小于Akt。本研究结果显示,与Akt特异性抑制剂Akt1/2相比,T-18能够抑制Pim家族成员,而对Akt-1和Akt-2没有明显抑制作用。因此,推测T-18可能特异性抑制Pim家族激酶活性,为今后裸鼠胰腺原位癌的研究和临床试验提供有力的实验数据,进而为进一步解决恶性肿瘤治疗的临床难题提供可行的方法。
[1] MANNING G, WHYTED B, MARTINEZ R, et al. The protein kinase complement of the human genome [J]. Science, 2002, 298(5600): 1912-1934.
[2] BACHMANN M, MOROY T. The serine/threonine kinase Pim-1 [J]. Int J Biochem Cell Biol. 2005, 37(4): 726-730.
[3] MOCHIZUKI T, KITANAKA C. Pim-1 kinase stimulates c-myc-mediated death signaling upstream of CPP32-like protease activation [J]. Oncogene, 1997, 15: 1471-1480.
[4] KIM J, ROH M, ABDULKADIR S A. Pim 1 promotes human prostate cancer cell tumorigenicity and c-MYC transcriptional activity [J]. BMC Cancer, 2010, 10: 248.
[5] CHEN L S, REDKAR S, TAVEMA P, et al. Mechanisms of cytotoxicity to Pim kinase inhibitor, SGI-1776, in acute myeloid leukemia [J]. Blood, 2011, 118(3): 693-702.
[6] NOSAKA T, KITAMURA T. Pim-1 expression is sufficient to induce cytokine independence in murine hematopoietic cells, but is dispensable for BCR-ABL-mediated transformation[J]. Exp Hematol, 2002, 30 (7): 697-702.
[7] DAI J M, ZHANG S Q. Antisense oligodeoxynucleotides targeting the serine/threonine kinase P I M-2 inhibited proliferation of DU2145 cells[J]. Acta Pharmacol Sin, 2005, 26(3): 364-368.
[8] FELDMAN J D, VICIAN L, CRISPINO M, et al. KID-1, a protein kinase induced by depolarization in brain [J]. J Biol Chem, 1998, 273: 16535-16543.
[9] FUJII C, NAKAMOTO Y, LU P, et al. Aberrant expression of serine/threonine kinase pim-3 in hepatocellular carcinoma development and its role in the proliferation of human hepatoma cell lines [J]. Int J Cancer, 2005, 114(2): 209-218.
[10] LI Y Y, POPIVANOVA B K, NAGAI Y, et al. Pim-3, a protooncogene with serine/threonine kinase activity, is aberrantly expressed in human pancreatic cancer and phosphorylates bad to block bad-mediated apoptosis in human pancreatic cancercell lines [J]. Cancer Res, 2006, 66(13): 6741-6747.
[11] POPIVANOVA B K, LI Y Y, ZHENG H, et al. Protooncogene, Pim-3 with serine/threonine kinase activity, is aberrantly expressed in human colon cancer cells and can prevent Bad-mediated apoptosis [J]. Cancer Sci, 2007, 98(3): 321-328.
[12] ZHENG H C, TSUNEYAMA K, TAKAHASHI H, et al. Aberrant Pim-3 expression is involved in gastric adenomaadenocarcinoma sequence and cancer progression [J]. J Cancer Res Clin Oncol, 2008, 134(4): 481-488.
[13] SLIMANE D, RAMAN S, RICHARD H, et al. Inhibitors of PIM-1 Kinase:A computational analysis of the binding free energies of a range of imidazo [1,2-b] pyridazines [J]. J Chem Inf Model, 2010, 50: 368-379.
[14] LI Y Y, WANG Y Y, TANIGUCHI T, et al. Identification of stemonamide synthetic intermediates as a novel potent anticancer drug with an apoptosis-inducing ability [J]. Int J Cancer, 2010, 127(2): 478-484.
[15] AHO T L, SANDHOLM J, PELTOLA K J, et al. Pim-1 kinase promotes inactivation of the pro-apoptotic Bad protein by phosphorylating it on the Ser112 gatekeeper site [J]. FEBS letter, 2004, 571: 43-49.
[16] YAN B, ZEMSKOVA M, HOLDER S, et al. The pim-2 kinase phosphorylates BAD on serine 112 and reverses BAD-induced cell death [J]. J Biol Chem, 2003, 278(46): 45358-45367.
[17] TANIGUCHI T, TANABE G, MURAOKA O, et al. Total synthesis of (+/-)-stemonamide and (+/-)-isostemonamide using a radical cascade [J]. Org let, 2008, 10: 197-199.
[18] 邓欢, 刘亮明, 张吉祥. 丝/苏氨酸激酶Pim家族在细胞周期调控和肿瘤发生中的作用 [J]. 国际遗传学杂志, 2006, 29(5): 375-378.
[19] 许治良, 高虹, 欧阳克清, 等. G-蛋白偶联受体的功能测定和高通量药物筛选 [J]. 中国药理学通报, 2003, 19(12): 1330-1336.
[20] 李娜, 张利宁, 高尚先, 等. 噬菌体展示CD28、CD137及生物活性测定 [J].药物分析杂志, 2005, 25(9): 1106-1110.
[21] AMARAVADI R, THOMPSON C B. The survival kinases Akt and Pim as potential pharmacological targets [J]. J Clin Invest, 2005, 115: 2618-2624.
[22] RHODES N, HEERDING D A, DUCKETT D R, et al. Characterization of an Akt kinase inhibitor with potent pharmacodynamic and antitumor activity [J]. Cancer Res, 2008, 68: 2366-2374.
[23] CHEN W S, XU P Z, GOTTLOB K, et al. Growth retardation and increased apoptosis in mice with homozygous disruption of the Akt1 gene [J]. Genes Dev, 2001, 15: 2203-2208.
[24] EASTON R M, CHO H, ROOVERS K, et al. Role for Akt3/ protein kinase B gamma in attainment of normal brain size[J]. Mol Cell Biol, 2005, 25: 1869-1878.
[25] WOULFE D, JIANG H, MORGANS A, et al. Defects in secretion, aggregation, and thrombus formation in platelets from mice lacking Akt2 [J]. J Clin Invest, 2004, 113: 441-450.
[26] MIKKERS H, NAWIJN M, ALLEN J, et al. Mice deficient for all PIM kinases display reduced body size and impaired responses to hematopoietic growth factors [J]. Mol Cell Biol, 2004, 24: 6104-6115.
《抗癌》杂志征稿启事
《抗癌》杂志于1988年创刊,主管单位为上海市科学技术协会,主办单位为上海市抗癌协会,杂志刊号:CN31-1664/R ISSN 1008-3065。征稿栏目及内容如下。
一、《抗癌博客》栏目
记录癌症患者自强不息、热爱生活、勇敢面对病痛和生活压力的故事,能够启发其他患者自信和勇敢的精神,帮助他们建立积极、知足、感恩和达观的生活态度。可以是你的亲身经历,也可以是医生治疗患者时的所见所闻,或是你身边发生的故事。
二、《正谊明道、大医精诚》栏目
真实记录医生对患者的关怀;或是爱岗敬业、精益求精富有专业精神的事迹,能让更多医道同仁敬重和学习。可以讲述患者眼里的医生,也可以记录你的同事。
以上稿件《抗癌》杂志编辑部在发表时有修改的权力,如果不同意修改请注明,谢谢!欢迎各位作者踊跃投稿。
来稿请寄:上海市东安路270号6号楼3楼《抗癌》杂志社
邮 编:200032 电 话:021-64043766
传 真:021-64043766 E-mail:anti-cancer@163.com
Screening of Pim kinase inhibitors by the establishment of high-throughput ELISA system
SHANG Kun1, ZHANG Peng2, ZHOU Lu2, WANG Zhen1, CAO Yue1, LI Ying-yi1(1.Cancer Research Laboratory, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2.School of Pharmacy, Fudan University, Shanghai 201203, China)
LI Ying-yi E-mail: liyingyi@fudan.edu.cn
Background and purpose: Pim family is the proto-oncogene that exhibits serine/threonine kinase activity, containing Pim-1, Pim-2, Pim-3. Pim family has potent anti-apoptotic capacity, ultimately promoting tumor cells survival. This study aimed to establish a high-throughput system to screen the anti-cancer drugs targeting Pim kinase by ELISA. Methods: The stemonamide synthetic intermediates were synthesized using a radical cascade. The expression of Pim kinase proteins and Bad proteins were purified by bacterial system. A high-throughput ELISA screening was performed for in vitro Pim kinase assay. Results: Treatment with 0.01 mmol/L of IPTG for 2 hours at 37 ℃, the induction of Bad recombinant proteins was the maximum; Treatment with 0.02% of arabinose for 3 hours at 37 ℃, the induction of Pim-1, Pim-2, Pim-3 recombinant proteins was the maximum. ELISA results showed that the Pim kinase could phosphorylate Bad in a dose-dependent manner; we had found a low molecular weight compounds T-18, which could effective inhibit Pim kinase activity in vitro. Conclusion: We successfully established a screening system with Bad and Pim by ELISA. ELISA is a method for screening drug with high throughput, effect and sensitivity. Moreover, small molecule the compound T-18 that is screened by ELISA, can inhibit Pim kinase activities, ultimately reduce the amount of phosphorylated Bad and could induce apoptosis.
10.3969/j.issn.1007-3969.2013.04.004
R73-34
:A
:1007-3639(2013)04-0260-07
2012-08-02
2013-01-20)
国家自然科学基金面上项目(No:30973476);上海市浦江人才计划(No:10PJ1402100);复旦大学“985工程”三期肿瘤研究项目Ⅱ (No:985Ⅲ-YFX0102)。
李影奕 E-mail:liyingyi@fudan.edu.cn
