运动性骨骼肌微损伤和骨骼肌细胞凋亡的关系探析
2013-06-07宋卫红邹秋英
宋卫红,邹秋英
(湖南人文科技学院 体育科学系,湖南 娄底 417000)
骨骼肌是人体运动系统的动力器官,在神经系统的支配下发生收缩活动可以使机体产生各种运动。骨骼肌细胞核的变化直接影响着骨骼肌的形态结构和生理功能。年龄、体育锻炼、生产劳动和日常生活中的肌肉工作等都会对骨骼肌的结构与功能产生明显的影响,一般而言随着肌肉工作的数量和强度的增加而出现结构的增强和功能的提高,但高强度或不习惯的运动可能会引起骨骼肌的损伤。运动过程中骨骼肌的损伤大致可分为急性损伤和慢性损伤,而运动性骨骼肌微损伤(Exercise-induced muscle micro-damage,EIMmD,)与人体的一般的肌肉损伤和炎症反应有着本质的差异,运动性骨骼肌微损伤是指肌肉在大强度负荷后出现的一种正常的生理反应。人体在剧烈的耐力和力量训练(以离心运动为主)中都可能发生运动性骨骼肌微损伤,主要表现为:肌肉酸痛、肌肉体积增大、关节活动角度减小、肌肉力量减小等,其中最经常的特征就是延迟性肌肉酸痛,通常在运动后8-24 小时出现,24-48 小时达到顶点,可延续7 天左右。出现这种现象时肌肉自身的工作能力下降,收缩能力减小,使运动员产生不适,但这种工作能力的下降是暂时的,当机体功能恢复后,会产生适应现象。对运动员训练过程中和恢复后运动性骨骼肌损伤作出及时有效的评价在训练和比赛中是非常重要的。
目前关于运动性骨骼肌微损伤的原因研究很多,生理生化方面有骨骼肌钙超载学说,自由基损伤学说;组织损伤方面有机械损伤学说;能量代谢方面有肌细胞能量代谢紊乱;还有细胞骨架学说等;但众说纷纭。而关于细胞学方面的研究很少,最近的证据表明[1-4]细胞凋亡在运动期间和之后的骨骼肌细胞损伤中具有重要作用。
一 运动性组织损伤与细胞凋亡
细胞凋亡是细胞程序性死亡(Programmed Cell Death,PCD)的一种形态学上的概念,是细胞接受某种信号或受到某种因素刺激后,为了维持内环境稳定而发生的一种主动性消亡过程。它既出现在个体的正常发育过程中,也出现在非正常生理状态或疾病中。科学家运用电镜形态学观察、TUNEL、凝胶电泳DNA 断片检测、流式细胞技术等方法发现,运动性心肌微损伤,运动性肝损伤、肾损伤,神经组织损伤等发生过程中都有细胞凋亡的参与,而且细胞凋亡程度与运动强度和运动量有关。目前关于运动性损伤和细胞凋亡的研究表明,一次运动会增加细胞凋亡,加重损伤,而长时期的有规律的运动可以预防损伤和凋亡的发生[5-6]。骨骼肌细胞凋亡存在于肌肉萎缩[1,7],慢性心肌疾病的骨骼肌中[8],骨骼肌失神经[9-12],骨骼肌失重和退用[13],以及急性运动中[8-9]。在运动过程中和运动后,骨骼肌和心肌的自发性凋亡是短期或长期的运动性骨骼肌损伤一个特殊致病原因[14]。那么运动性骨骼肌超微结构的损伤与细胞凋亡的关系如何还有待更多的实验研究。
二 运动性骨骼肌微损伤的生理环境与细胞凋亡
(一)骨骼肌微损伤的钙紊乱引起细胞凋亡
1.胞浆内钙紊乱引起细胞凋亡
近年来,在肌肉疾病和肌肉损伤模型的研究[15-16]表明,胞浆Ca2+的不可逆增加是导致肌肉损伤的原因之一。Duan 等[17]报道,大鼠下坡跑后骨骼肌胞浆钙含量与肌细胞的损伤呈显著相关,在给大鼠喂食或腹腔注射钙螯合剂EDTA 和EGTA 后,胞浆钙含量明显降低,同时肌细胞损伤减轻。Baracos[18]和陈英杰等[19]的研究也表明类似的结果。
在生理状态下,胞浆内钙浓度约10-7mol/L,细胞外钙浓度为10-3mol/L。细胞浆内的钙贮存系统,如内质网和线粒体,钙浓度为10-3mol/L 。正常时细胞通过一系列转运机制可保持这种巨大的浓度梯度,以维持细胞内低钙状态,当遇到相应的刺激时,细胞会通过多种途径瞬间提高胞内局部或全部的钙离子浓度。胞浆内Ca2+浓度大幅度增加引发细胞一系列生理、生化反应,如通过激活蛋白酶,如钙蛋白酶、核支架蛋白酶、死亡相关蛋白激酶等、谷氨酰胺转移酶凋亡相关基因以及核酶(包括内切酶、拓扑异构酶)等从而介导细胞凋亡[20,21]。凋亡可能是由钙转运系统把钙离子带入核中激活核酸内切酶引起DNA 断裂而引发.所以钙离子浓度升高是大多数细胞凋亡所必需的。在哺乳动物细胞凋亡过程中,天冬氨酸特异性的半胱氨酸蛋白酶(Caspases)家族的激活起关键作用。Caspases 在正常细胞中以无活性的前体形式合成与储存,凋亡信号可激活Caspase 级联反应,从而导致细胞DNA 损伤和细胞凋亡[22]。在这个过程中,CasPase-3 的激活依赖于胞浆游离钙的参与。运动过程中,由于运动刺激导致骨骼肌胞浆游离钙离子的升高诱发骨骼肌细胞凋亡。
2.线粒体内钙浓度升高可引起细胞凋亡
近年发现,线粒体不仅控制机体的能量代谢,维持细胞钙稳态、而且还在调节细胞凋亡或坏死等过程中起着决定性作用。在生理条件下线粒体对细胞钙稳态的调节不起主要作用,只是与一定量的Ca2+结合,以维持其氧化磷酸化过程,提供肌肉活动所需能量。只有细胞功能异常,当细胞内游离钙浓度急剧升高时,线粒体才作为钙贮存池聚集细胞内多余的钙。在线粒体代谢功能紊乱、凋亡、癌变以及缺血性细胞损伤过程中,往往伴随着线粒体钙浓度的改变。田野等人发现急性运动后线粒体Ca2+浓度升高,并一直持续到运动后48小时,导致线粒体氧化功能下降,影响ATP 生成[23]。同时他们采用同位素示踪方法,观察雄性SD 大鼠跑台运动后即刻骨骼肌线粒体Ca2+摄取的动力学变化。发现急性运动引起骨骼肌线粒体摄Ca2+能力明显增加[24]。
线粒体转运钙离子主要依赖于线粒体外膜上的电压依赖性阴离子通道(VDAC)。VDAC 于1975 年首次被发现,它是存在于线粒体外膜上的31kDa 膜蛋白,能在膜上形成亲水性电压门控通道。它通过与Ca2+、ATP、谷氨酸(Glu)、NADH以及不同蛋白质相互作用,转运阴离子、阳离子、ATP 以及其他代谢物进出线粒体,调节着线粒体外膜的通透性,控制着线粒体的功能,在维持线粒体及细胞活性方面发挥重要功能[25]。它以两种主要的方式调控线粒体介导的细胞死亡;一是作为线粒体通透性转运孔(permeability transition pore,PTP)主要组成成分调控细胞凋亡;另一是与Bcl-2家族蛋白相互作用调控细胞凋亡。还有研究发现,Bax 和Bak 可直接与VDAC 结合,加速VDAC的开放;Bcl-2/Bcl-XL 与VDAC 连接后促使VDAC关闭,但Bik 和Bid 则不影响其活性。即抗凋亡因子关闭VDAC,而促凋亡因子开放VDAC[26]。运动致骨骼肌细胞中线粒体钙转运能力增强,线粒体中钙浓度加强,导致VDAC 的改变,从而可以影响线粒体膜电位,导致细胞凋亡。也有人认为钙信号可能是通过线粒体钙超载和钙依赖的酶这两种方式来控制凋亡[27]。
3.内质网钙浓度降低可引起细胞凋亡
内质网(SR)是细胞内蛋白质合成,翻译后修饰、折叠的主要场所,同时也是钙储备和钙信号转导的主要场所,当前认为细胞内的钙稳态主要是通过内质网来保持的。目前关于运动后内质网的功能和内质网内钙含量的研究结果主要有:陈万等[28]观测研究下坡跑(离心)运动对大鼠骨骼肌肌浆网Ca2+-ATP 酶活性,Ca2+摄取与释放在量与时程上的影响时,得出结果无论是肌浆网Ca2+-ATP 酶活性还是Ca2+摄取与释放在运动后即刻和运动后4h 都明显下降,而且在24h 持续下降,得出结论一次低强度,长时间下坡跑运动导致肌浆网功能长时间降低,运动后恢复期两天尚未完全恢复,亦可构成离心运动诱导的骨骼肌某些功能降低的基础。魏源[29]也得出了同样的结果。李洁[30]认为大鼠长时间运动后,由于某些因素使SR Ca2+转运减少,使运输回SR 的Ca2+量减少,使肌动蛋白和肌球蛋白形成的横桥分离速度减慢,影响肌肉的放松并造成细胞浆中游离Ca2+浓度增加,后者可通过激活蛋白水解酶和磷脂酶等造成肌纤维蛋白的降解,进而引起肌肉收缩机能的下降,导致肌肉疲劳。但是有人发现大鼠骨骼肌细胞肌浆网膜在离心收缩后完整性发生改变,而肌浆网Ca2+-ATP 酶泵功能未发生改变[31]。也有人[32]认为离心运动并不导致内质网的损伤,因为离心收缩后肌肉电——机械延迟性增加,但舒张并不受影响,这可能是DOMS 消失的结构基础。
运动后肌浆网内Ca2+转运能力下降,包括钙释放通道钙释放能力降低和钙泵逆浓度梯度摄钙能力都下降,由于离心运动导致肌浆网释放出大量的钙,所以内质网内的钙未得到及时的补充而减少,从而导致细胞凋亡。Pan 等[33]用咖啡因和雷尼定使得内质网内的Ca2+的排空会导致仓鼠卵巢细胞的凋亡。
在运动性骨骼肌微损伤过程中发生的胞浆钙离子升高,线粒体钙超载还是内质网钙排空都会导致细胞凋亡。
(二)骨骼肌微损伤过程中自由基与细胞凋亡
1.组织自由基升高可引起细胞凋亡
离心运动过程中,细胞功能受损,细胞膜脂质过氧化反应加强,产生的代谢物丙二醛(MDA)是一种活泼的交联剂,能够进入膜内与膜蛋白及膜上的氨基交联成Shiff 氏碱,使膜的流动性降低,刚性增加,从而使膜的流动性和通透性发生障碍,影响膜的正常功能。导致骨骼肌细胞的微损伤,许多实验[34-36]发现大鼠骨骼肌中MDA 值在力竭性离心运动后即刻显著升高,一天后继续上升,且显著高于运动后即刻组。自由基如H2O2、OH 等活性氧能造成细胞凋亡。活性氧诱导细胞凋亡可能通过下列途径:一是调节凋亡相关基因,如凋亡促进基因(c-myc,p53,Bax,ICE 等)和凋亡抑制基因(bcl-2,bcl-xl 等)。二是活性氧本身可诱导细胞凋亡。
2.线粒体自由基升高引起细胞凋亡
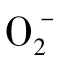
自由基不仅通过脂质过氧化损伤细胞膜和内膜系统,造成细胞损伤和凋亡,同时使蛋白质和酶分子失活,损伤线粒体DNA,调节凋亡相关基因的表达等诱导细胞凋亡。
(三)热休克蛋白在骨骼肌损伤和细胞凋亡中的作用
热休克蛋白(Heat Shock Proteins,HSPs)是生物受到环境中物理、化学、生物、精神等刺激时发生应激反映而合成的蛋白质,又名为应激蛋白(Stress Protein,SP),是一类高度保守的蛋白质,普遍存在于原核和真核生物中。HSP 主要参与一些重要的细胞生理活动,如蛋白质转运、折叠和装配,另外各种因素诱导HSP 合成后,可起到稳定细胞结构维护细胞正常生理功能,提高机体响应的适应能力。Khassaf 等人让受试者作70%VO2max单腿踩自行车运动45min 后,分别在1d、2d、3d、6d作股外侧肌活检,HSP70 直到第6 天平均值才显著增加。提示HSP 的表达在运动致骨骼肌损伤中扮演重要的角色[38。过量表达HSP70 能减少骨骼肌损伤和加速损伤后康复[39]。Paulsen 经过实验,成年健康男性股四头肌完成300 个最大运动后不同恢复时段取肌外侧肌进行肌肉活检,发现运动后即刻,HSP27 很强的表达,以后逐渐下降,而HSP70的表达在运动后24 小时开始,4 天后提高到原来的10 倍。提示热休克蛋白70 在骨骼肌的康复和重建中起着重要作用[40]。
热休克蛋白(Heat Shock Proteins,HSPs)包括HSP110、HSP90、HSP70、HSP60、HSP47、HSP30、HSP28、HSP10 及Ubiquitin(泛素)等。HSP 与细胞凋亡关系密切,尤其HSP70、HSP27 对热休克、氧化应激、电离辐射、FNF-α 等引起的细胞凋亡有保护作用,可抑制应激激活蛋白激酶、抑制凋亡基因P53 和Bax 的表达、抑制凋亡信号转导中的蛋白水解酶和抑制氧自由基生成以及对细胞线粒体功能的保护作用有关[41]。HSPs 一方面能预防骨骼肌微损伤,另一方面能抑制细胞凋亡,这是否意味着HSP 在细胞凋亡与骨骼肌微损伤之间的关系中扮演着一定角色呢?
另外,运动性骨骼肌微损伤机制中的能量代谢紊乱学说认为肌肉收缩过程中,肌细胞内能量物质耗竭、代谢产物堆积等对肌纤维的功能及整个肌肉的工作能力均产生影响,也是运动导致骨骼肌微损伤发生的一个重要原因,能源物质的耗竭在细胞凋亡中也起着重要作用。还有延迟性肌肉酸痛的可能机制缺血再灌注也与细胞凋亡有着很大的联系。
三 运动性骨骼肌微损伤与细胞凋亡的时相性
以往的研究不仅从损伤和凋亡的生理环境表明运动性骨骼肌微损伤和细胞凋亡具有很大的联系,而且很多研究表明它们的时相性具有一致性。Sandri 等人通过对mdx 小鼠的研究发现[1],小鼠自发跑步两天后骨骼肌细胞核凋亡率最高。黄颖峰等人[42]在研究恒定负荷耐力训练对大鼠骨骼肌细胞凋亡的影响时发现第1,2 周周末运动后24h时恢复组骨骼肌细胞凋亡率均大于运动后宰杀组和运动后3h 宰杀组,提示运动导致的肌肉细胞凋亡有一定时相性和矛盾性,运动导致的细胞凋亡不是运动后即刻发生的,而是延迟性的。有人在研究不同运动强度与骨骼肌细胞凋亡时序性研究时发现[43],在运动训练开始前3 d,腓肠肌细胞凋亡明显升高,表明运动引起骨骼肌细胞凋亡主要发生运动训练急性期,与骨骼肌运动损伤主要临床症状表现出延迟性肌肉酸痛发生时相一致。运动训练后大鼠骨骼肌细胞凋亡明显增加,1 周后达到高峰,2 周、3 周后下降[44]。也有实验证明,外伤后挫裂伤周围组织神经元胞浆内钙离子浓度升高,导致钙超载引起细胞凋亡,是导致颅脑外伤后颅内压增高及迟发型神经元损伤的重要原因[45]。以上研究证明骨骼肌细胞凋亡具有一定的时序性,而且与骨骼肌微损伤发生的时间相似甚至相同。但也有相反的实验结果,早期Podhorska-Okolow 等对运动后正常鼠的细胞凋亡情况进行时相研究时发现,鼠自发的在鼠轮中跑一昼(12h)后诱发骨骼肌损伤,运动后即刻,6h、96h 取样进行研究,发现运动后即刻细胞凋亡比例较高,6h 后凋亡下降,而96h 后凋亡核不足1%[46]。
从多数研究来看,运动性骨骼肌微损伤与细胞凋亡的时相性呈现出一致性。但骨骼肌微损伤是由细胞凋亡引起的,还是骨骼肌微损伤中存在凋亡现象呢,孰因孰果都值得研究者去研究。
四 展望
(1)从运动性骨骼肌微损伤的发生机制来看,细胞凋亡可能是运动性骨骼肌微损伤的一个重要因素。
(2)从运动性骨骼肌微损伤和细胞凋亡的生理环境来看,运动性骨骼肌微损伤的生理生化环境会导致骨骼肌细胞凋亡,骨骼肌微损伤和细胞凋亡存在一定的联系。但是细胞凋亡在运动性骨骼肌微损伤中到底扮演一个什么角色,是消除受损肌肉,还是导致肌核的减少引起骨骼肌损伤呢,需要更多的研究者去探索。
(3)很多实验证明,在运动训练后,运动性骨骼肌微损伤和细胞凋亡存在相同的时相性,在运动性骨骼肌损伤中出现了细胞凋亡还是细胞凋亡诱发了运动性骨骼肌损伤呢,还需要更多的实验去证明。运动性骨骼肌微损伤到底是肌肉增长过程中一个良性的过程,还是运动过程产生的一种不利影响呢,这些都没有定论。如何诱导、预防和治疗运动性骨骼肌微损伤都有待更多的实验去探索。
[1]SANDRI M,CARRARO U,PODHORSKA-OKOLOV M,et al.Apoptosis,DNA damage and ubiquitin expression in normal and mdx fibers after exercise[J].FEBS Lett,1995,373(3):291-295.
[2]SANDRI M,PODHORSKA-OKOLOW M,GDROMEL V,et al.Exercise induces myonuclear ubiquitination and apoptosis in dystrophin-deficient muscle of mice[J].J Neuropathol Exp Neurol,1997,56(1):45-57.
[3]HEATHER KS,MAXWELL L,JULIE A,et al.Nuclear DNA frag mentation and morphological alterations in adult rabbit skeletal muscle after short- term immobilization[J].Cell Tissue Res,2000,302(10):235-241.
[4]FRIDEN J,LIBER RL.Segmental muscle fiber lesion after repetitive eccentric contractions[J].Cell Tissue Res,1998,293(1):165 –171.
[5]SIU PM,BRYNER RW,MARTYN JK,et al.Apoptotic adaptations from exercise training in skeletal and cardiac muscles[J].THE FASEB Jouranal,2004,18(10):1150-52.
[6]MARUHASHI Y,KITAOKA K,NAKAMURA R et al.ROS Scavenging Activity and Muscle Damage Prevention in Eccentric Exercise in Rats[J].Journal of physiological sciences,2007,57(4):211-216.
[7]ADAMS V,JIANG H,YU J,et al.Apoptosis in skeletal myocytes of patients with chronic heart failure is associated with exercise intolerance[J].J Am Coll Cardiol.1999,33(4):959-965.
[8]BORISOV AB,CARLSON BM.Cell death in denervated skeletal muscle is distinct from classical apoptosis[J].Anat Rec.2000,258(3):305-18.
[9]胡韶楠,顾玉东,徐建光,等.臂丛神经损伤后不同部位失神经骨骼肌萎缩后细胞凋亡的研究[J].中华手外科杂志,2000,6(4):194-197.
[10]TEWS DS,GOEBEL H,SCHNEIDER I,et al.DNA-fragmentation and expression of apoptosis related proteins in experimentally denervated and reinnervated rat facial muscle[J].Neuropathol Appl Neurobiol,1997,23(2):141-149.
[10]田涛,吴明晖,金惠铭,等.大鼠臂丛神经损伤后骨骼肌萎缩时肌细胞凋亡的研究[J].中华医学杂志,2000,80(5):530-533.
[11]ALLEN DL,LINDERMAN JK,ROY RR,et al.Apoptosis:a mechanism contributing to remodeling of skeletal muscle in response to hind-limb unweighting[J].Am J Physiol.1997,27(3):579-587.
[12]CARRARO U,FRANCESCHI C.Apoptosis of skeletal and cardiac muscles and physical exercise[J].Aging(Milano).1997,9(1-2):19-34.
[13]程丽彩,何玉秀.长期耐力运动对大鼠肝细胞自由基代谢、线粒体膜电位及细胞凋亡的影响[J].中国运动医学杂志,2008(4):486-493.
[14]ARMSTRONG RB.Initial Events in Exercise Induced Musclar Injury[J].Med Sci Sports Exer,1990,22(4):429 –435.
[15]MURPHY JG,MARSH JD,SMITH TW.The Role of Calcium in Ischemic Myocardial Injury[J].Circulation,1987,75(5):15 –24.
[16]CARPENTER S,KARPATI G.Segmental Necrosis and its Demarcation in Experimental Micropuncture Injury of Skeletal Muscle Fibers[J].J.Neurol and Exper Neurol,1989,48:154 –170.
[17]DUAN C,DELP MD,HAYES DA,et al.Rat skeletal muscle mitochondrial[Ca2+]and injury from downhill walking[J].J.App Physiol 2000,68,1241-1251.
[18]BARACOS V.Influence of Calcium and Divalent Cations on Protein Turnover in Rat Skeletal Muscle[J].Am J Physiol,1986,250(6):E702-E710.
[19]陈英杰,郭庆芳.钙过负荷与运动延迟性肌肉损伤[J].中国运动医学杂志,1992,11 (3):133 –141.
[20]郑倩,骆去鹏.钙稳态紊乱和细胞凋亡[J].川北医学院学报.2001,16(4):142-144.
[21]LAUGWITZ KL,MORETTI A,WEIG HJ,et al.Blocking Caspase2 activated apoptosis improves contractility in failing myocardium[J].Hum Gene Ther,2001,12(17):2051-2063.
[22]周舟,王小华,朱光旭,等.缺氧诱导心肌细胞凋亡与Caspase-3 激活及细胞内钙超载的关系[J].中国应用生理学杂志.2005,21(1):10-16.
[23]田野,王义润,杨锡让,等.运动性骨骼肌结构、机能变化的机制研究.II.力竭运动对线粒体钙代谢水平的影响[J].中国运动医学杂志,1993,12(1):31-33。
[24]田野,李明华,张孙曦.急性运动后大鼠骨骼肌线粒体Ca2+摄取的动力学观察[J].中国运动医学杂志,2001,20(2):132-133.
[25]汤新慧,高静,徐强.线粒体电压依赖性阴离子通道及其调控功能[J].细胞生物学杂志,2005,27(2):113-116.
[26]郭静,薄咏梅,张东才.钙离子信号与细胞凋亡[J].生物物理学报.2005,21(1):1-18.
[27]VERKHRATSKY A,TOEXCU EC.Endoplasmic reticulum Ca2+ homeostasis and neuronal death[J].J Cell Mol Med,2003,7(4):351-361.
[28]CHEN W,RUELL PA,Thompson MW.Effect of downhill exercise on sarcoplasmic reticulum function in rat skeletal muscle[J].Chinese Journal of Rehabilitation Medicine,2007,22(12):1070-74.
[29]魏源,唐晖.力竭运动对大鼠骨骼肌肌浆网钙转运的影响[J].湘潭师范学院学报,2001,23(4):38-40.
[30]李洁.耐力性运动对大鼠骨骼肌肌浆网功能的影响[J].中国运动医学杂志,1997,16(4):259-263.
[31]YASUDA T,SAKAMOTO K,NOSAKA K,et al.Loss of sarcoplasmic reticulum membrane integrity after eccentric contractions [J].Acta Physiol Scand,1997,161(4):581-582.
[32]BROWN TE,CHIRILA AM,SCHRANK BR,et al.Muscle fatigue:the cellular aspects[J].Am J Sports Med,1996,24(6):S9-13.
[33]PAN Z,DAMRON D,NIEMINEN AL,et al.Depletion of intracellular Ca2+ by caffeine and ryanodine induces apoptosis of chinese hamster ovary cells transfected with ryanodine receptor[J].J Biol Chem,2000,275(26):10078-10084.
[34]DAVIES KJ,QUINTANILHA AT,BROOKS GA,et al.Free radicaland tissue damage produced by exercise[J].J.Biochem.Biochem Biophys Res Commun,1982,107(4):1198-1205.
[35]田野.运动性骨骼肌疲劳机理研究[M].北京:北京体育大学出版社,1998:21-25.
[36]袁建琴,徐勇,等.低氧、离心力竭运动对骨骼肌自由基代谢的影响[J].武汉体育学院学报,2005,39(5):40-43.
[37]田野,王义润,杨锡让.运动性骨骼肌结构、机能变化的机制研究—Ⅲ、力竭运动对脂质过氧化和ATP 代谢的影响[J].中国运动医学杂志,1994,13(2):109-110.
[38]PAROO Z,TIIDUS PM,NOBLE EG.The repeated bout effect and heat shock proteins:intramuscular HSP27 and HSP70 expression following two bouts of eccentric exercise in humans[J].Acta Physiol Scand.2002,174(1):47-56.
[39]BROOME CS,KAYANI AC,PALOMERO J,et al.Effect of lifelong over expression of HSP70 in skeletal muscle on age-related oxidative stress and adaptation after non damaging contractile activity[J].FASEB J,20(9):1549-51.
[40]PAULSEN G,VISSING K,KALHOVDE JM,et al.Maximal eccentric exercise induces a rapid accumulation of small heat shock proteins on myofibrils and a delayed HSP70 response in humans[J].Am J Physiol Regul Integr Comp Physiol,2007,293(2):844-53.
[41]PAROO Z,NOBLE EG,Noble E.strogen Attenuates Post-Exercise Hsp70 Expression in Skeletal Muscle[J].Am J Physiol,2001,10:1153.
[42]黄颖峰,徐晓阳.恒定负荷耐力训练对大鼠骨骼肌细胞凋亡的影响实验[J].体育科学,2005,25(3):58-61.
[43]蔡保塔,余斌.不同运动强度与骨骼肌细胞凋亡时序性实验研究[J].南方医科大学学报,2006:26(7):1017-1019.
[44]郑师陵,叶贤坤.不同运动训练量与骨骼肌细胞凋亡的实验研究[J].中国实验诊断学.2001,5(6):310-311.
[45]王晓东.神经元胞浆内钙离子浓度变化和细胞凋亡相关性的研究[D].济南:山东大学,2006.
[46]PODHORSKA-OKOLOW M,SANDRI M,ZAMPIERI S,et al.Apoptosis of myofibres and satellite cells:exerciseinduced damage in skeletal muscle of the mouse[J].Neuropathology and Applied Neurobiology,1998,24(6):518-531.
