非酒精性脂肪性肝炎形成中脂肪细胞因子的动态变化及意义
2013-06-05蔡丹莉陈芝芸严茂祥何蓓晖浙江中医药大学第一临床医学院浙江省中医院杭州310006
蔡丹莉 陈芝芸 严茂祥 何蓓晖 浙江中医药大学第一临床医学院 浙江省中医院 杭州 310006
非酒精性脂肪性肝炎形成中脂肪细胞因子的动态变化及意义
蔡丹莉 陈芝芸 严茂祥 何蓓晖 浙江中医药大学第一临床医学院 浙江省中医院 杭州 310006
目的:研究非酒精性脂肪性肝炎(NASH)形成中脂肪细胞因子的动态变化特征。方法:SD大鼠40只,随机分成正常组10只,模型组30只;正常组大鼠以标准饲料喂养,模型组以高脂饲料喂养。模型组大鼠分别在实验开始后4、8、12周末3个时相点分批随机处死10只,正常组全部在12周末处死。采用HE染色观察肝组织病理组织学变化,ELISA法检测血清及肝组织TNF-α、Leptin、IL-6、ADP水平。结果:病理组织学表明,高脂喂养4周大鼠表现为单纯性脂肪肝;8周时脂肪变程度加重,有少量炎细胞浸润;12周时大鼠NASH形成。模型组大鼠从4周到8、12周,血清和肝组织TNF-α、IL-6水平及血清Leptin水平逐渐增高,而血清ADP水平则逐渐减少;模型组4周末血及肝组织TNF-α、IL-6、Leptin、ADP水平与正常组比较差异无统计学意义(P>0.05),而12周末血和肝组织TNF-α、IL-6水平及血清Leptin、ADP水平均比正常组明显增高或降低(P<0.05,P<0.01)。结论:脂肪细胞因子的过度表达或异常缺失参与了NASH的发生、发展。
大鼠 非酒精性脂肪性肝炎 脂肪细胞因子
非酒精性脂肪性肝炎(nonalcoholic steatohepati⁃tis,NASH)是一种无过量饮酒史,与脂质和糖代谢紊乱有关的肝脏疾病。其病理组织学主要表现为肝细胞脂肪变性、坏死和炎症细胞浸润。NASH是单纯性脂肪肝进展为肝纤维化的关键中间环节。在普通人群中,NASH的发病率为3%~5%[1],在病态肥胖人群中,其发病率可达20%~47%[2-3]。而目前其发病机制尚不完全明确。近年研究发现,脂肪细胞因子失衡与NASH的发生发展密切相关。本研究通过高脂饮食建立大鼠NASH模型,观察NASH形成中脂肪细胞因子的动态变化。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠40只,体质量(200±10)g,上海西普尔-必凯实验动物中心提供,动物许可证号:SCXK(沪)2008-0016;饲养于浙江中医药大学实验动物中心,12h明暗交替,自由采食饮水。1.2 主要试剂与仪器 胆固醇(批号100208)为上海博奥生物科技有限公司产品,3号胆盐(批号20100125-00)为杭州微生物试剂有限公司产品,TNF-α(批号 CK-E90339R)、IL-6(批号 CKE306446R)、瘦素(Leptin,批号CK-E30492R)、脂联素[Adiponectin(ADP),批号CK-E30584R]均由上海原叶生物科技有限公司提供,总蛋白测定BCA(批号20100825)试剂盒由南京建成生物工程研究所提供。CE2041紫外分光光度仪为英国CECIL公司产品,EL×800全自动酶标仪为美国BioTeK公司产品,低温高速离心机为美国THERMO Electron公司产品。
1.3 实验方法 大鼠适应性饲养1周后随机分成正常组10只,模型组30只,后者又分4、8、12周3个时相点。正常组大鼠采用标准全价颗粒饲料喂养,模型组大鼠采用高脂饲料(10%猪油、2%胆固醇、5%蛋黄粉、0.5%3号胆盐及82.5%标准饲料)喂养;模型组分别在实验开始后第4、8、12周末随机分批处理10只,正常组全部在12周末处理。处理大鼠空腹麻醉下腹腔静脉取血,分离血清待用;取肝组织部分常规石蜡包埋HE染色观察肝组织病理组织学变化,诊断参考2010年中华医学会肝脏病学分会脂肪肝和酒精性肝病学组修订的“非酒精性脂肪性肝病诊疗指南”[4]。部分以RIPA组织裂解液[由1%SDS、1%去氧胆酸钠、1%NP-40、0.8%NaCl、10mmol/LEDTA-Na2、1mmol/LPMSF、10mmol/L Tris-HCl(pH8.0)及0.5%混合蛋白酶抑制剂组成]进行匀浆提取总蛋白,离心后取上清液待用;血清及肝组织TNF-α、Leptin、IL-6、ADP含量采用ELISA法检测,肝组织匀浆总蛋白提取物定量采用BCA法检测。
2 结 果
2.1 大鼠NASH形成中肝组织病理的动态变化 正常组大鼠肝组织光镜下肝小叶结构正常,肝细胞排列成肝索,在中央静脉周围呈放射状分布,细胞呈多边形。模型组大鼠肝组织4周时可见轻中度脂肪变,以肝腺泡Ⅲ区为明显;8周时可见程度加重,呈弥漫性脂肪变,以大泡性为主,偶见小叶内点状坏死及小叶内、汇管区少量炎症细胞浸润;12周时出现重度脂肪变性,伴不同程度肝细胞气球样变,汇管区和小叶内混合性炎细胞浸润,以小叶内明显,部分坏死灶融合成片,未见明显肝纤维化形成。
2.2 大鼠NASH形成中血清及肝组织脂肪细胞因子的动态变化 模型组大鼠从4周到8、12周血清和肝组织TNF-α、IL-6水平及血清Leptin水平逐渐增高,而血清ADP水平则逐渐减少;在4周末,血及肝组织各项指标与正常组比较,差异均无统计学意义(P>0.05);8周末,除肝组织IL-6水平较正常组明显增高外,其余各指标与正常组比较,差异均无统计学意义(P>0.05);12周末,血和肝组织TNF-α、IL-6水平及血清Leptin、ADP水平与正常组比较,差异有统计学意义(P<0.05,P<0.01),肝组织Leptin水平与正常组差异无统计学意义(P>0.05);模型组12周血清TNF-α水平较4周、8周时明显增高(P<0.05,P<0.01),ADP水平较4周、8周明显降低(P<0.01),模型组12周肝组织TNF-α水平较4周组、8周组明显增高(P<0.05,P<0.01),见表1~2。
表1 各组大鼠血清脂肪细胞因子动态变化(±s)
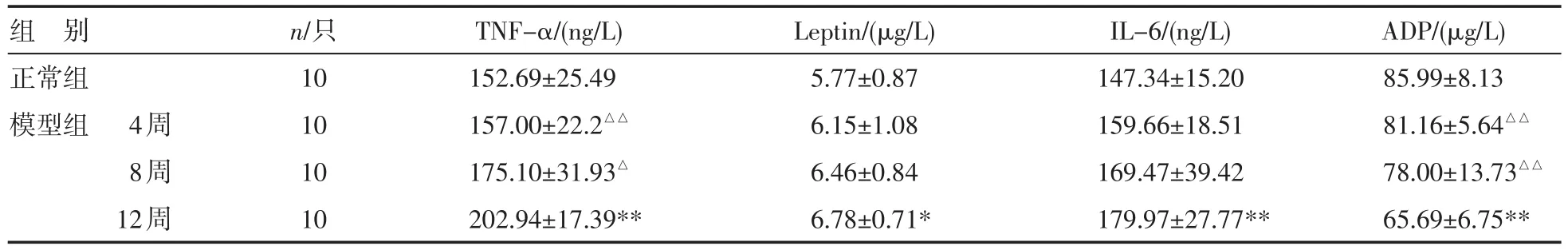
表1 各组大鼠血清脂肪细胞因子动态变化(±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组12周比较,△P<0.05,△△P<0.01
组别正常组模型组 4周8周12周n/只10 10 10 10 TNF-α/(ng/L) 152.69±25.49 157.00±22.2△△175.10±31.93△202.94±17.39** Leptin/(μg/L) 5.77±0.87 6.15±1.08 6.46±0.84 6.78±0.71* IL-6/(ng/L) 147.34±15.20 159.66±18.51 169.47±39.42 179.97±27.77** ADP/(μg/L) 85.99±8.13 81.16±5.64△△78.00±13.73△△65.69±6.75**
3 讨论
关于NASH的发病机制,目前占主导地位的为“二次打击”学说,第一次打击是指脂肪酸合成增多,导致肝细胞周围脂质沉积增多;第二次打击包括脂肪酸氧化增加、氧化应激、前炎症因子及内毒素血症[5]。其中第二次打击在NASH形成中占主导位置[6]。越来越多的研究发现脂肪细胞因子网络在NASH的形成中起着重要作用[7-8]。脂肪细胞因子是指脂肪组织分泌产生的、有致炎作用或抗炎作用的蛋白产物,包括ADP、leptin、TNF-α、IL-6、抵抗素等。
表2 各组大鼠肝组织脂肪细胞因子动态变化(±s)
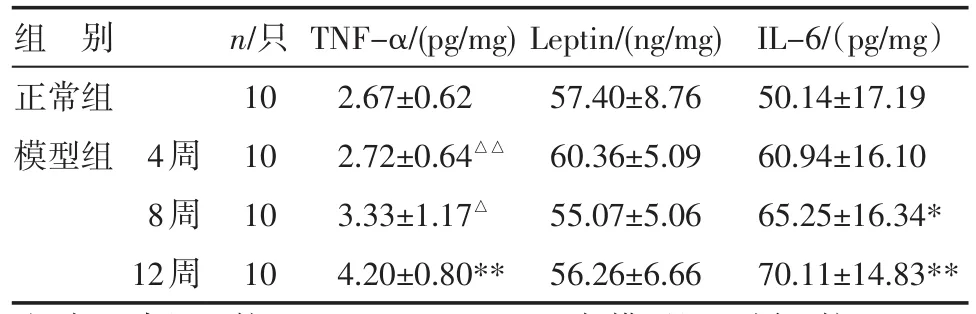
表2 各组大鼠肝组织脂肪细胞因子动态变化(±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组12周比较,△P<0.05,△△P<0.01
组别正常组模型组 4周8周12周n/只10 10 10 10 TNF-α/(pg/mg) 2.67±0.62 2.72±0.64△△3.33±1.17△4.20±0.80** Leptin/(ng/mg) 57.40±8.76 60.36±5.09 55.07±5.06 56.26±6.66 IL-6/(pg/mg)50.14±17.19 60.94±16.10 65.25±16.34* 70.11±14.83**
ADP是来源于脂肪细胞的一种主要的抗脂肪变及抗炎症反应的物质[9],脂联素通过与受体结合作用于靶细胞,参与脂肪代谢过程、周围组织对胰岛素的敏感性及炎症细胞产生等多个环节。有研究发现,肥胖者、胰岛素抵抗者、2型糖尿病患者和NASH患者血清ADP含量均下降[10],ADP可以通过抑制内皮细胞TNF-α和炎症介质来实现抗炎效应[11]。Leptin具有各种免疫、代谢功能。肥胖患者具有高Leptin血症和Leptin抵抗,高瘦素血症可以促进巨噬细胞分泌TNF-α、IL-12和IL-6等细胞因子,促进内脏脂肪积聚及肝星状细胞分化,使单纯性脂肪肝发展为脂肪性肝炎、肝纤维化[12]。TNF-α是一种具有多种生物效应的生理炎性介质,其可以通过损伤细胞线粒体功能,抑制脂肪酸β氧化,促进胰岛素抵抗的形成,从而导致肝脏脂质过氧化和炎症反应的发生[13]。IL-6是前炎症因子,可由脂肪细胞、内皮细胞和活化的白细胞等分泌。升高的IL-6可降低胰岛素受体的蛋白表达从而产生胰岛素抵抗[14];可以促进脂肪酸分解和游离脂肪酸释放,升高血脂和增加肝脏甘油三酯的积聚;可以促进巨噬细胞释放TNF-α,刺激肝脏表达纤维蛋白原、C反应蛋白等,从而加重内皮细胞的炎症反应。研究发现,NASH患者的IL-6水平较正常人和单纯脂肪肝患者明显升高,IL-6可作为NASH治疗效果的评价指标[15]。以上这些脂肪细胞因子的过度表达和异常缺失,形成紊乱的脂肪细胞因子网络,从而促进肝脏脂质过氧化和炎症反应的发生、发展,最终导致NASH形成。
本研究发现,随着高脂饮食喂养时间增加,大鼠肝组织呈现出NASH病变的渐进性发展过程。4周时病理表现为单纯性脂肪肝,8周时肝组织脂肪变进一步加重,并出现少量炎症细胞浸润;12周时,大鼠肝组织NASH形成,表现为重度脂肪变性,不同程度肝细胞气球样变,以小叶内为主的炎细胞浸润和坏死灶等。研究同时发现,在NASH形成过程中,大鼠血清和肝组织的脂肪细胞因子发生发变化,表现为从4周到8、12周血清和肝组织TNF-α、IL-6水平及血清Leptin水平逐渐增高,而血清ADP水平则逐渐减少;在4周末血及肝组织各细胞因子水平与正常组比较差异均无统计学意义(P>0.05),至12周末血和肝组织TNF-α、IL-6水平及血清Leptin、ADP水平均较正常组明显增高或降低(P<0.05,P<0.01),提示随着造模时间的延长,肝脏脂肪细胞因子过度表达或异常缺失的程度逐渐增强,与肝脏脂肪变及炎症渐进过程一致,进一步表明脂肪细胞因子可能参与了NASH的发生、发展;通过对细胞因子网络的调控有望能为非酒精性脂肪性肝病的防治提供新的作用靶点。
[1]Ong JP,Younossi ZM.Epidemiology and natural history of NAFLD and NASH[J].Clin Liver Dis,2007,11(1):1-16.
[2]Younossi ZM,Diehl AM,Ong JP.Nonalcoholic fatty liver disease:an agenda for clinical research[J].Hepatology,2002,35(4):746-752.
[3]Ong JP,Elariny H,Collantes R,etal.Predictors of nonalco⁃holic steatohepatitis and advanced fibrosis in morbidly obese patients[J].Obes Surg,2005,15(3):310-315.
[4]中华医学会肝病分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南[J].中华肝病杂志,2006,14(3):161-163.
[5]McCullough AJ.Pathogenesis of non-alcoholic steatohepati⁃tis:human data[J].Clin Liver Dis,2007,11(1):75-104.
[6]Mulhall BP,Ong JP,Younossi ZM.Non-alcoholic fatty liver disease:an overview of prevalence,diagnosis,pathogenesis and treatment considerations[J].Clin Sci,2008,115(5): 141-150.
[7]Baranova A,Gowder SJ,Schlauch K,etal.Gene expression of leptin,resistin,and adiponectin in thewhite adipose tis⁃sue of obese patients with non-alcoholic fatty liver disease and insulin resistance[J].Obes Surg,2006,16(9):1118-1125.
[8]Lutchman G,Prom rat K,Kleiner DE,et al.Changes in se⁃rum adipokine levelsduring pioglitazone treatment fornonal⁃coholic steatohepatitis:relationship to histological improve⁃ment[J].Clin Gastroenterol Hepatol,2006,4(8):1048-1052.
[9]Shetty S,Kusminski CM,Scherer PE.Adiponectin in health and disease:evaluation of adiponectin-targeted drug devel⁃opment strategies[J].Trends Pharmacol Sci,2009,30(5): 234-239.
[10]Musso G,Gambino R,BiroliG,etal.Hypoadiponectinemiapredicts the severity of hepatic fibrosis and pancreatic Be⁃ta-cell dysfunction in nondiabetic nonobese patients with nonalcoholic steatohepatitis[J].Am JGastroenterol,2005,100(11):2438-2446.
[11]Wolf AM,Wolf D,Rumpold H,etal.Adiponectin induces the anti-inflammatory cytokines IL-10 and IL-1RA in hu⁃man leukocytes[J].Biochem Biophys Res Commun,2004,323(2):630-635.
[12]Tsochatzis E,PapatheodoridisGV,Archimandritis AJ,etal. The evolving role of leptin and adiponectin in chronic liver diseases[J].Am JGastroenterol,2006,101(11):2629-2640.
[13]Crespo J,Cayon A,Fernandez-Gil P,etal.Gene expres⁃ sion of tumor necrosis factor alpha and TNF-receptors,p55 and p75,in nonalcoholic steatohepatitis patients[J]. Hepatology,2001,34(6):1158-1163.
[14]Kim HJ,Higashimori T,Park SY,etal.Differentialeffects of interleukin-6 and-10 on skeletalmuscle and liver insu⁃lin action in vivo[J].Diabetes,2004,53(4):1060-1067.
[15]Lutchman G,Promrat K,Kleiner DE,etal.Changes in se⁃rum adipokine levels during pioglitazone treatment for non⁃alcoholic steatohepatitis:relationship to histological improve⁃ment[J].Clin Gastroenterol Hepatol,2006,4(8):1048-1052.
TheDynamicChangeandSigni f icanceofAdipocytokinesintheDevelopmentofNonal cohol icSteatohepati⁃t is
CAIDanl i,CHENZhiyun,YANMaoxiang,etal.TheFi rstCl inicalMedical Col legeof Zhej iangTradi t ional Chinese Medicine University,Hangzhou(310006),China
Objective:To observe the dynamic expressions of adipocytokines in the development of nonalcoholic steatohepatitis.M ethods:Forty SD rats were random ly divided into 2 groups.The 10 rats in the control group were fed with normal diet and painlessly killed at the end of the 12th week for following detections.The 30 rats in the disease group were fed with fat-rich diet and 10 were painlessly killed at the end of the 4th,8th and 12th week,respectively.Fatty degeneration and inflammation of liver were observed with HE dyeing.The contents of serum and liver TNF-α,leptin,IL-6,and ADP were detected with ELISA.Results:Hepatic steatosis occurred in the rats from the diseases group at the end of the 4th week after fat-rich diet.At the end of the 8th,the hepatic steatosis aggravated and little inflammation occurred.At the end of the 12th,NASH occurred. The contents of serum and liver TNF-α,IL-6,and serum leptin gradually increased from the 4th to 12th week, whereas the content of serum ADP gradually decreased.At the end of the 4th week,no significant difference was noted in the contents of serum and liver TNF-α,leptin,IL-6,and ADP between the disease group and nor⁃mal group(P>0.05).At the end of the 12th week,however,the contents of serum and liver TNF-α,IL-6,and se⁃rum Leptin of the disease group were higher than those of the control group,and ADP was lower(P<0.05 or P<0.01).Conclusions:The disorder of the adipocytokines may play an important role in the development of NASH.
rats nonalcoholic steatohepatitis adipocytokines
2012-11-30
浙江省自然科学基金(No.Y2100170);浙江省实验动物科技计划(No.2009F80014)
