RON蛋白在正常胚胎食管组织发育成熟过程及肿瘤组织中的表达特征
2013-06-05黄闽杰张占春浙江省宁波市医疗中心李惠利肿瘤放化疗科宁波315000沈姚航平浙江大学医学院附属第一医院传染病诊治国家重点实验室
陆 意 黄闽杰 张占春 浙江省宁波市医疗中心李惠利肿瘤放化疗科 宁波 315000沈 玲 姚航平 浙江大学医学院附属第一医院传染病诊治国家重点实验室
·论 著·
RON蛋白在正常胚胎食管组织发育成熟过程及肿瘤组织中的表达特征
陆 意 黄闽杰 张占春 浙江省宁波市医疗中心李惠利肿瘤放化疗科 宁波 315000沈 玲 姚航平 浙江大学医学院附属第一医院传染病诊治国家重点实验室
目的:探讨原癌基因RON在正常胚胎食管组织发育成熟及肿瘤组织中的表达特征及临床意义。方法:采用高密度组织芯片和免疫组化染色方法,检测RON在正常胚胎食管组织、成人食管组织和食管肿瘤组织中的表达及分布,半定量方法计算RON表达水平,分析比较差异。通过免疫印迹Western-blot法和RT-PCR法检测食管癌与正常食管组织中RON蛋白和基因的表达水平。结果:RON在正常胚胎食管与成人食管组织中的表达和分布差异无统计学意义(P>0.05)。RON在食道癌组织中呈高表达(P<0.05),其中12.5%食管癌组织中RON呈过度表达,且主要表达在食管癌细胞膜,而正常胚胎食管组织呈极弱或低表达。结论:RON在胚胎食管组织发育和成熟过程中稳定表达;RON的异常表达与食管癌的发生、进展密切相关。
食管癌 酪氨酸激酶受体RON 病理机制 组织芯片
原癌基因RON是属于MET原癌基因家族成员之一,成熟的RON蛋白是一种跨模型蛋白受体,主要表达在上皮组织中,发挥传导细胞内外信号的生物学效用[1]。研究发现,RON的异常表达是导致胃肠道上皮细胞恶性转化的一个致病因子[2-3]。我国是食管癌的高发国家,也是死亡率最高的国家,多数患者就诊时已属中、晚期。近年来生物靶向药物逐渐应用于恶性肿瘤的治疗[4],关于原癌基因RON与食管癌的关系值得研究。为了深入、全面地研究RON在食管上皮组织生理、病理中的作用,明确RON的表达、分布及致病机理,本研究拟通过组织芯片、免疫组织化学方法定性检测正常胚胎食管组织发育成熟过程及肿瘤组织中RON的表达和分布情况,采用Western blot和RT-PCR法定量分析RON在食管癌鳞状上皮组织中的表达;探讨RON与正常食管组织、肿瘤组织的关系,揭示食管癌发生的具体分子机制,为进一步研究食管癌和临床诊断、放化疗、生物靶向治疗等提供理论基础。
1 实验材料
正常胚胎食管组织、成人食管组织的组织芯片购于CYBRDI(www.cybrdi.cn,陕西)。组织芯片中包含正常胚胎组织38例,3~8月龄;正常成人组织40例,平均年龄54.7岁,均为男性;食管癌组织80例,平均年龄57.3岁,均为男性,病理类型均为鳞癌。
食管癌组织及正常食管组织新鲜标本:食管癌组织取自2011年1月—2011年12月宁波市李惠利医院的手术切除标本,共20例,均为男性,年龄50~65岁,平均58.6岁,术前均未行辅助治疗,经病理证实为食管癌。正常食管组织取自正常人内镜活检标本,共15例,均为男性,年龄50~60岁,平均55.2岁。两组性别构成及年龄分布差别均无统计学意义(P>0.05)。上述组织均为离体后30min内取材,立即放入液氮罐,并转入-80℃冰箱保存直至检测。所有组织样本的使用均经患者同意并获伦理委员会批准。
2 实验方法
2.1 免疫组织化学染色分析食管组织RON蛋白表达 组织芯片在60℃烤箱中烤2h,然后经脱蜡、水化、抗原修复、3%BSA封闭后,加鼠抗人RON单克隆抗体Zt/g4[5](1:1000 in PBS),室温孵育2h,PBS洗片后加生物素化的二抗及SABC酶复合物(链霉亲和素-过氧化物酶复合物,武汉博士德公司产品),室温反应30min,洗片后用DAB显色,苏木素复染,经脱水、透明、封片,最后用奥林帕斯CKX41型显微镜观察组织染色情况并拍照。结果判断:阳性定位,RON蛋白主要表达于细胞膜上,呈棕黄色颗粒。定性:观察5个400×高倍视野,阳性染色的细胞数量≤5%为阴性,>5%为阳性。通过半定量方法[6],计算免疫组化评分,统计分析比较差异。
2.2 Western-blot法检测食管组织RON蛋白表达
准确称取新鲜食管组织并绞碎,使用组织裂解液(150mM NaCl,10mM Tris-HCl pH7.9,0.5%TritonX-100,0.6%NP-40,andprotease inhibitors,1μg/mL leu⁃peptin,1ug/mL pepstatin A,and 2μg/mL aprotinin)按每10mg组织加300μL裂解液冰上裂解30min后,离心取上清液,用BCA蛋白定量试剂(Bio-Rad)检测蛋白质浓度。取40μg蛋白样本加入2×SDS上样缓冲液煮沸5min,以10%的聚丙烯酰胺凝胶泳后转移至PVDF膜(Bio-Rad),用封闭液(含7.5%脱脂奶粉,2%BSA,0.1%Tween-20的PBS)封闭1h后,加入RON抗体R5029[3](1:5000)4℃过夜。用洗涤缓冲液(含0.1%Tween-20 PBS)洗膜3次,加入过氧化物酶交联的羊抗鼠IgG(Pierce,用封闭液1:10000稀释)室温下作用1h,PBS洗膜后,使用ECL化学发光试剂(美国Amersham公司)显影,全自动荧光化学发光成像仪成像。显影结束后,膜用抗体洗脱液(Re-blot,美国Chemicon公司)室温孵育20min,封闭液封闭30min后,同法用兔抗人actin抗体(美国Santa Cruz)反应作内参。
2.3 RT-PCR检测食管组织RON基因表达 收集各食管癌和正常食管组织,用Trizol(美国Gibco公司)常规提取总RNA,经核酸蛋白紫外分析仪(Beckman DU640)检测,A260与A280比值为1.75~1.80。取2μg总RNA于42℃逆转录(逆转录试剂盒为MBI Fermentas公司产品)1h后,以β-actin作为内参照,进行半定量聚合酶联反应(PCR)扩增。RON引物(扩增产物153bp)上游:5-ATCCACCCAGTGC⁃CAACCTAGTT-3,下游:5-GCAGCAGGATACCAAGG AGCGT;β-actin引物(扩增产物619 bp)上游:5-CGCTGCGCTGGTCGTCGACA-3,下游:5-GTCAC⁃GCACGATTTCCCGCT-3。引物均由上海生物工程有限公司合成。PCR反应条件:95℃预变性3min;94℃变性30s,60℃复性30s,72℃延伸1min,扩增28个循环;72℃延伸10min。取10μLPCR产物电泳,用数码凝胶图像分析系统(BioRad GelDoc)作条带密度扫描。根据目的基因RON与相应β-actin的密度比值确定基因的表达水平高低。
2.4 统计学方法 应用SPSS11.0统计软件,采用t检验,以P<0.05为差异有统计学意义。
3 实验结果
3.1 RON在正常胚胎食管组织和成人食管组织的表达 食管组织中RON以中-低水平表达为主,主要以鳞状细胞和柱状细胞为主。胚胎与成人食管组织中RON的表达非常接近。RON在胚胎与成人食管组织中表达差异无统计学意义(P>0.05)。提示RON在食管甚至整个消化系统的胚胎发育和成熟过程中稳定表达,证实RON作为原癌基因在胚胎发育中的作用,见表1,图1。
表1 RON蛋白在正常胚胎食管与成人食管组织的表达()

表1 RON蛋白在正常胚胎食管与成人食管组织的表达()
组别n/例 阳性分布 表达量 总分胚胎食管成人食管38 40 1.1±0.8 2.2±0.3 2.5±0.4 1.3±0.2 3.6±1.2 3.5±0.5

图1 正常食管组织RON蛋白免疫组织化学染色(×400)A:正常胚胎食管组织; B:正常成人食管组织
3.2 RON在食管癌组织中的表达和分布 通过免疫组化方法检测食管癌组织中RON的表达。评分>6分为过度表达,图2显示RON在食管肿瘤组织中典型的过度表达。在肿瘤细胞的胞膜和胞浆中都可见到高浓度的染色,尤以细胞膜为主。80例食管癌组织的RON蛋白阳性表达率85%,其中食道癌中RON过度表达为12.5%,相应正常食管组织阳性率<8%。食管癌组织RON蛋白阳性表达率显著高于相应正常食管组织的表达(P<0.05),提示RON与食管癌之间存在密切的关系,见表2,图2。
表2 RON蛋白在食管鳞癌和正常食管组织表达(±s) 例

表2 RON蛋白在食管鳞癌和正常食管组织表达(±s) 例
注:与正常组织比较,*P<0.05
组别鳞癌组织正常组织n 80 40阴性12 37阳性68 3阳性表达量4.4±0.5* 3.5±0.5阳性率/% 85.0 7.5强阳性10 0强阳性率/% 12.5 0

图2 食管组织RON蛋白免疫组织化学染色(×400)A:正常食管组织标本,RON呈弱表达。B:食管癌组织标本,食管癌细胞胞膜上可见大量的明显棕黄色颗粒,RON呈强阳性表达。
3.3 Western-blot检测食管癌组织与正常食管组织RON蛋白表达 第2、3、4、5列的食管癌组织样本中可见两条高密度阳性条带,一条是RON的前体蛋白(pro-RON),分子量为180kD,另一条是成熟RON的β链(RON-βchain),分子量约为160kD,与第1列阳性对照(转染了RON基因的3T3细胞)一样。第6、7、8、9列的正常食管组织中RON仅呈极低表达。证明RON蛋白表达水平在食管癌中显著高于正常组织。不同肿瘤病理类型的组织标本中RON蛋白表达水平也存在一定差异,其中第2、3、5列是食管鳞癌,第4列是食管贲门腺癌,但由于样本数少,无法做统计学分析,将做进一步研究,见图3。

图3 食管癌及正常食管组织RON蛋白表达
3.4 PT-PCR检测食管癌组织与正常食管组织RON基因表达 食管癌组织RON基因表达显著高于正常食管组织,与RON蛋白表达改变一致,见图4。
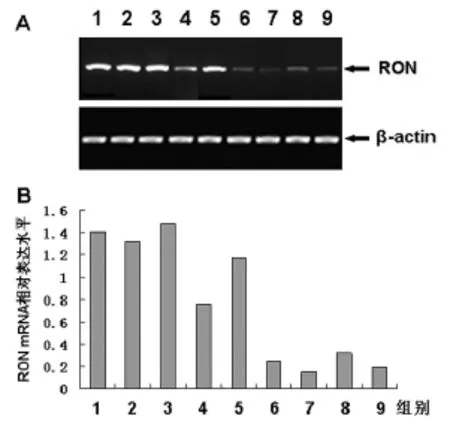
图4 食管癌及正常食管组织RON基因表达
4 讨论
受体酪氨酸激酶RON在上皮性肿瘤中的作用日益被重视。研究发现[7],RON在调节消化道上皮细胞的增殖、迁移中发挥重要作用。RON基因在正常消化道组织中的转录和表达是稳定的,也是保守的[6,8]。有研究[6]显示RON在正常食管和相应的癌症中的表达和分布情况。本研究数据亦显示RON在食管上皮细胞的胚胎发育成熟过程中都有所表达,该结果与动物研究RONmRNA的表达一致[9]。RON在胚胎发育过程中是必需的,本研究进一步证明RON作为原癌基因的生理及病理意义。如图1所示RON在胚胎食管组织黏膜表面的鳞状上皮细胞呈中等表达。细胞膜和细胞质都被染色。其中管腔隐窝底部的细胞染色相对较淡。这些表达模式与在成人组织中发现的比较类似,表明两者有类似的机制调节RON基因转录和蛋白质合成。而在食管癌组织中阳性染色主要位于细胞膜,与正常胚胎、成人组织的表达模式不同。本研究还证实了先前的结果,在胃肠道上皮细胞癌的肿瘤发展过程中存在RON异常表达[2-3,6,8]。此外,研究还发现,胃肠道肿瘤之间RON过度表达的比率有很大的不同。如本文图2和表2所示食道癌中RON过度表达的比率为12.5%。RON的异常表达往往导致侵袭活性的增加,因此RON的表达情况可能影响肿瘤的进展和预后。
免疫组织化学检测RON的结果显示,食管癌细胞胞膜上见大量的明显棕黄色颗粒;而在正常食管组织中,几乎少见明显棕黄色颗粒。食管癌组织RON蛋白阳性表达率显著高于相应正常食管组织的表达。免疫印迹Western-blot和RT-PCR法检测结果进一步显示食管癌组织RON蛋白表达水平显著高于正常食管组织。这些都表明RON在正常食管发育成熟中表达,而且与食管癌的进展存在一定的关系,但是究竟RON的表达增高参与食管癌的发生、发展,还是食管癌诱导RON表达提高,仍待研究。①RON作为原癌基因,对人体正常生长发育有不可或缺的作用,但是在某些外界因素的影响下,可以被异常激活或诱导,转变为癌基因。②RON参与炎症反应。研究表明,RON能抑制参与炎症反应的炎症因子表达。已知食管癌可能与上皮肠化生、反流性食管炎有关。当RON表达增高时,可抑制炎症因子发挥作用,从而抑制炎症反应,致使炎症得以持续感染食管上皮细胞,最终诱发癌变。③RON作为一种细胞膜受体,在某些外因作用下,能被诱导或促进RON表达增高,同时促进相关信号途径的传导,激活下游蛋白,异常活化某些基因。本研究还发现并非所有食管癌组织中RON都表达阳性,且阳性表达水平高低也不尽相同,这与食管癌的组织病理类型、肿瘤分期有着很大的关系,有待于进一步研究。因此,RON与食管炎的关系、食管癌具体病理分型与RON的关系及食管癌组织中RON变异体的表达情况等等都是今后的研究方向之一。在临床上,通过免疫组织化学法和免疫印迹法检测RON的表达可以作为食管癌诊断的手段之一。RON的生物靶向治疗也将是食管癌治疗的发展方向之一。
[1]Lu Y,Yao HP,Wang MH.Multiple variants of the RON re⁃ceptor tyrosine kinase biochemical properties,tumorigenic activities,and poteantial drug targets[J].Cancer Lett,2007,257(2):157-164.
[2]Zhou YQ,He C,Chen YQ,et al.Altered expression of the RON receptor tyrosine kinase in primary human colorectal adenocarcinomas:generation of different splicing RON vari⁃ants and their oncogenic potential[J].Oncogene,2003,22(2):186-197.
[3]Wang D,Shen Q,Xu XM,etal.Activation of the RON recep⁃tor tyrosine kinase attenuates transforming growth factor-be⁃ta1-induced apoptotic death and promotes phenotypic changes inmouse intestinalepithelial cells[J].Carcinogene⁃sis,2005,26(1):27-36.
[4]Ilson DH,Kelsen D,Shah M,et al.A phase 2 trial of erlo⁃tinib in patients with previously treated squamous cell and adenocarcinoma of the esophagus[J].Cancer,2011,117(7):1409-1414.
[5]Yao HP,Luo YL,Feng L,et al.Agonisticmonoclonal anti⁃bodies potentiate tumorigenic and invasive activities ofsplic⁃ing variant of the RON receptor tyrosine kinase[J].Cancer Biol Ther,2006,5(9):1179-1186.
[6]Wang MH,Wei L,Luo YL,et al.Altered expression of the RON receptor tyrosine kinase in various epithelial cancers and its contribution to tumourigenic phenotypes in thyroid cancer cells[J].JPathol,2007,213(4):402-411.
[7]Wang MH,Wang D,Chen YQ.Oncogenic and invasive po⁃tentials of human macrophage-stimulating protein receptor,the RON receptor tyrosine kinase[J].Carcinogenesis,2003,24(8):1291-1300.
[8]O'Toole JM,Rabenau KE,Burns K,etal.Therapeutic impli⁃cations of a human neutralizing antibody to the macro⁃phage-stimulating protein receptor tyrosine kinase(RON),a c-MET family member[J].Cancer Res,2006,66(18): 9162-9170.
[9]Gaudino G,Avantaggiato V,Follenzi A,etal.The proto-on⁃cogene RON is involved in development of epithelial,bone and neuro-endocrine tissues[J].Oncogene,1995,11(12):2627-2637
Exp r ess i ono f RONi n t heDeve l opmen t o f Emb r yon i c Esophagus Ti ssueand Esophagea l Cance r
LUYi,HUANGMinjie,ZHANGZhanchun,etal.OncogenicRadiotherapyCenter,NingboMedicalTreatmentCenter Lihuil i Hospital,Ningbo(315000),China
Objective:To investigate the expression of receptor tyrosine kinase RON in the development and pro⁃gression of esophagus tissue and its clinical significance.Methods:Tissue microarraies were used to detect the expression and location of RON in esophageal normal tissue and cancer tissue by immunohistochemical staining,western-blot,and RT-PCR.Results:No significant difference in RON protein was noted between embryonic tis⁃sue and adult tissue(P>0.05).The expression level of RON protein in esophageal cancer significantly exceeded normal tissue and RON mostly located in the membrane of esophagus cells,while normal esophagus tissue hardly or lowly expressed RON protein.Conclusion:RON expressed stably in the esophagus embryonic development and maturation process;meanwhile,RON is related with the onset and progression of esophageal cancer.
esophageal cancer receptor tyrosine kinase RON pathomechanism tissue microarray
2012-11-07
修回日期:2012-12-10
浙江省科技计划项目(No.2009C33150)
姚航平,Tel:0571-87236580;E-mail:yaohangping@126.com
