嗅味物质对铜绿微囊藻的溶藻效应
2013-06-04张可佳高乃云邵煜李聪张土乔杨玉龙
张可佳 ,高乃云,邵煜,李聪,张土乔,杨玉龙
(1. 浙江大学 建筑工程学院,浙江 杭州,310058;2. 同济大学 污染控制与资源化研究国家重点实验室,上海,200092)
由于环境污染日趋严重,许多水体富营养化而导致蓝藻水华的暴发,成为我国目前及今后长时期内的一项重大水环境问题。现有的藻类控制技术如投加化学除藻剂等存在费用高、难操作、生态危害大等缺陷。因此,探索经济有效的水华防治方法对于改善水环境、保障饮用水安全具有重大意义。其中利用生物间的化感作用来抑制藻类生长具有高效、安全、易操作等优点,是当前研究的热点之一[1]。所谓化感作用,即细胞产生自体毒性物质,对同种其他个体或亲缘种的生长产生抑制甚至破坏作用,从而有利于群体保持平衡[2]。如高浓度的微囊藻毒素 RR对水华束丝藻会产生急性致死效应[3],球等鞭金藻产生的十二烯酸异丙酯(HDMA)对自身藻细胞存在抑制效应[4]等。目前已发现的蓝藻分泌的抑制物质主要有生物碱、脂肪酸、肽类、酮醇、萜类化合物等[5]。蓝藻代谢的嗅味物质多为萜类化合物和脂肪酸,如 2-MIB、β-环柠檬醛、β-罗兰酮、庚醛等[6];而有些嗅味物质是非萜类化合物,如甲硫醚、二甲基三硫醚等。这些嗅味物质除了是造成饮用水异嗅异味的主要来源[7]之外,其特殊的化学特性也可能影响藻类自身的生长代谢。在国内外,具体哪些嗅味物质对蓝藻具有抑制效应及抑制程度尚未进行过系统研究。因此,本文作者考察不同的嗅味物质对自身藻体的溶藻效应,根据表观分析和仪器测定找出对蓝藻溶藻作用较大的嗅味物质,并确定其导致溶藻的界限浓度,从而从机理上分析蓝藻在自然环境中维持平衡的原因,为后续生物控藻技术的发展提供理论支持。
1 材料与方法
1.1 实验药剂与材料
标准品β-环柠檬醛、β-紫罗兰酮、甲硫醚、二甲基三硫醚和庚醛为色谱纯(纯度>90%),购自Sigma(美国)、Aldrich(美国)、Fluka(日本)等公司。铜绿微囊藻藻种Microcystis aeruginosa (905),购自中科院水生生物研究所,培养基为BG11,光照度为2 000 lux,光暗周期为12 h:12 h,培养温度为25 ℃。实验用水为Milli-Q超纯水(电阻率为18.2 MΩ·cm)。
1.2 试验方法
待培养的铜绿微囊藻处于稳定期,OD680为0.712,细胞密度为4.7×109L-1。分别取200 mL藻液到500 mL的玻璃三角锥瓶中,共6份,编号为0号、1号、2号、3号、4号和5号。用铝箔纸盖上瓶盖,防止外部杂质进入;并在上面扎一些小孔,以保证藻液与外界空气流通。其中 0号为空白样品,1号、2号、3号、4号和5号分别加入200 μL的嗅味物质标准品β-环柠檬醛、β-紫罗兰酮、甲硫醚、二甲基三硫醚和庚醛,浓度为1 g/L。放置培养箱中(25 ℃恒温),分别于1,3,8,18,30和92 h,测定吸光度AOD680和光能利用率α。用0.45 μm的乙酸纤维滤膜过滤藻液,用HPLC测特定时刻滤液的微囊藻毒素 LR,即得到胞外藻毒素LR的浓度变化情况。考察不同浓度的β-环柠檬醛对铜绿微囊藻的影响时,配置β-环柠檬醛的初始浓度分别为1,0.5,0.2,0.1和0.01 g/L,在不同时间测光能利用率α。
1.3 分析设备和方法
调制叶绿素荧光分析仪(PHYTO-PAM,德国Walz公司)用于测定光能利用率 α(即细胞光合活性),在室温下进行,暗适应时间不少于10 min。分光光度计(美国哈希公司,DR/2010)在680 nm波长的吸光度可反映铜绿微囊藻的个数,其相关性较好,R2可达0.99以上。高效液相色谱仪(HPLC,型号:LC-2010A HT,,Shimadzu,日本)用于测定微囊藻毒素MC-LR的浓度。色谱柱为 BDS-C18反相色谱柱,其尺寸为 150 mm(长)×4.6 mm(内径)×5 mm(膜厚度)。流动相为甲醇和pH=3的磷酸缓冲溶液,比例为57:43;检测波长为238 nm;柱温40 ℃;分析时间为15 min;MC-LR的响应时间为12.5 min。
2 结果与讨论
2.1 对藻液颜色的影响
试验向正常生长的铜绿微囊藻藻液中投加 1 g/L的不同嗅味物质,观察随着时间的推移藻液颜色的变化情况,结果如图1所示。藻液本身的颜色为绿色(由于含有叶绿素所致),藻细胞分布均匀,没有悬浮物和沉淀。经过1 h后,1号瓶中的藻液变成了蓝色,随着时间的延长,颜色越来越浅,到第8 h后,已经变成乳白色,并有悬浮物。而2号瓶的颜色自第8 h开始,由原来的绿色逐渐变成了黄绿色。4号瓶和5号瓶自第18 h开始,绿色也越来越浅,在第30 h后逐渐转变成蓝色,甚至乳白色(5号瓶,92 h时)。对于3号瓶,在整个试验过程中,同空白样品一样,颜色没有明显地变化,仍是绿色。藻液的颜色之所以发生变化,主要是由于藻细胞受到破坏后,胞内的藻蓝蛋白,溶解到水中造成的[8]。这与在实际水环境中,蓝藻衰亡时水体颜色变化特征一致。表明水体由绿色变为蓝色与水体中的嗅味物质积累到一定程度有关。Ozaki等[9]曾在研究中提到β-环柠檬醛是唯一引起藻液颜色变化的挥发性物质,但试验的时间仅有7 h,无法观测到其他嗅味物质的作用效果。在本研究中,通过对藻液颜色的观察,可以发现嗅味物质会不同程度地引起藻液颜色变化,对铜绿微囊藻细胞的影响从大到小依次是:β-环柠檬醛,β-紫罗兰酮,庚醛,二甲基三硫醚,甲硫醚。由此可见:萜类化合物和脂肪酸对藻细胞的破坏作用较大,而含硫化合物的抑制活性较小。
2.2 对藻细胞光合活性的影响

图1 嗅味物质改变藻液的颜色Fig. 1 Color variance in Microcystis aeruginosa by odorants
试验采用吸光度AOD680来反映藻细胞的数量,利用PAM仪器所测得的光能利用效率α来反映细胞的光合活性。图2所示为AOD680随时间的变化。从图2可以看出:在第1 h内,β-环柠檬醛作用下的藻液的AOD680降到0.45左右,并保持稳定,说明有些细胞已经不是完整的球形了。Ozaki等[10]加入6.5 mmol/L的β-环柠檬醛作用1 h后,经过电子显微镜观察发现藻细胞光滑的表面开始起皱,变得凹凸不平。图3所示为光合活性a随时间的关系。由图3可见:在β-环柠檬醛作用下,光合活性a直接由0.46降到了0,说明此时的藻细胞已经失去了光合活性。同理,在β-紫罗兰酮、庚醛、二甲基三硫醚的作用下,藻液的光合活性a也都有不同程度地降低,其影响的大小顺序与上节讨论相同。对于甲硫醚作用的藻液,细胞数量没有明显的降低,同时其光合活性的变化与空白样品相似。经过分析发现,β-环柠檬醛的破坏作用最大,溶藻速度最快。
β-环柠檬醛等萜类化合物之所以能影响藻细胞的变化,主要是因为一方面它们属于细胞溶解酶,能溶解细胞壁和细胞膜,造成细胞个体较大程度地收缩,从而破坏细胞结构;另一方面,它会阻碍细胞中RNA的传递或破坏 DNA的结构,通过对遗传基因造成负影响而阻碍细胞的进一步分裂[9]。而对于非萜类化合物的二甲基三硫醚对细胞的破坏作用,主要是由于酸压力,高浓度的溶液对细胞造成了高渗透压,胞外的水分经过渗透作用进入到细胞内部,造成细胞体积膨胀,破裂致死。对于甲硫醚,在该浓度下的渗透压不是足够大,因此对细胞结构不造成明显影响,不会破坏细胞的光合活性。
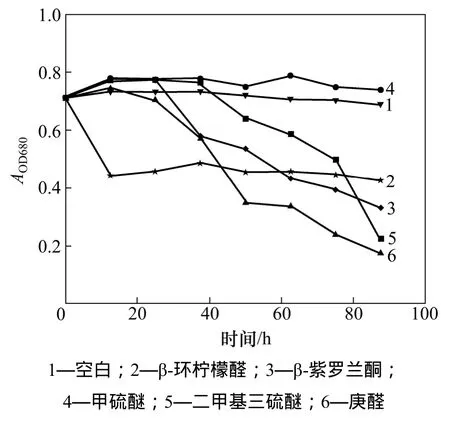
图2 AOD680随时间的变化Fig. 2 Variation of AOD680 with time
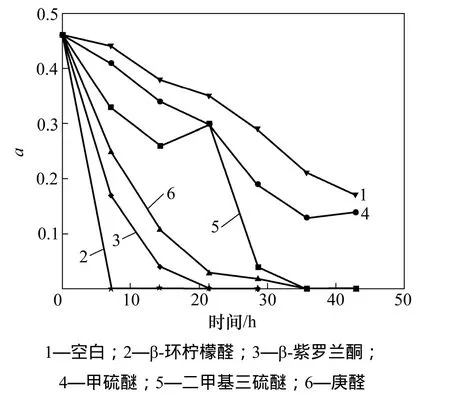
图3 光合活性a随时间的变化Fig. 3 Variations of photosynthetic activity with time
2.3 对藻细胞释放代谢物的影响
在正常的新陈代谢过程中,藻细胞会以2种方式释放胞内的代谢物:一是通过膜内外的浓度平衡,扩散到溶液中,一般是相对分子质量较小的糖醇、氨基酸等;二是细胞表面的不可逆降解,即当细胞膜遭到破坏后,胞内的代谢物会穿过裂口进入到水体[11],如藻蓝蛋白和藻毒素等。微囊藻毒素LR(MC-LR)是铜绿微囊藻代谢和分泌的主要毒素之一[12],在蓝藻水体污染中出现频率最高、产量最大、造成危害最严重。本研究考察了藻细胞中 MC-LR释放的情况,以探讨胞内分泌物受嗅味物质的影响,结果如图4所示。由图4可见:空白水样的胞外藻毒素 MC-LR维持在 230 μg/L左右。甲硫醚投加后,胞外MC-LR的质量浓度没有明显变化,说明甲硫醚对细胞没有造成额外的破坏作用。其他嗅味物质存在的条件下,胞外的MC-LR都随着时间延长有所增加。尽管β-紫罗兰酮较庚醛更早地使藻液变色,但从 MC-LR的释放程度来看,加入它们对藻细胞的破坏程度相似,最大质量浓度分别为524.10和727.33 μg/L。因此可认为利用胞外MC-LR的浓度变化来判断藻细胞的破坏程度较直接通过肉眼观察藻液颜色变化更为合理和准确。β-环柠檬醛对细胞的破坏作用最大,当到92 h后,质量浓度达到了2 628.3 μg/L,是正常情况下的10倍以上。
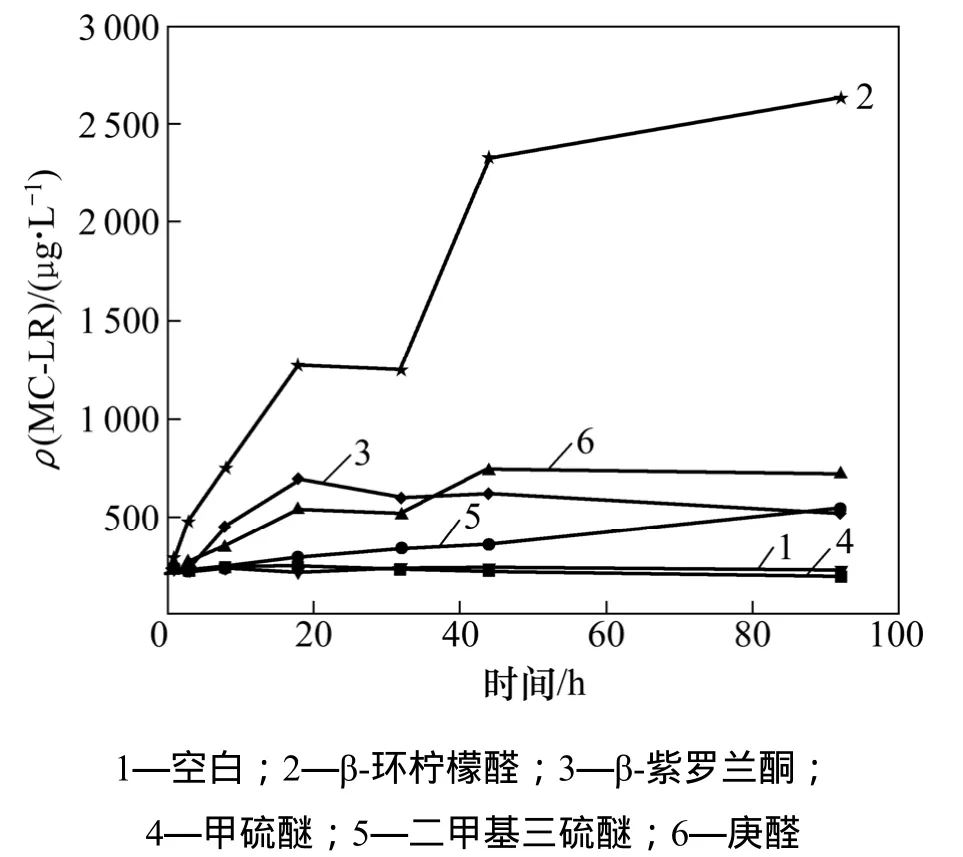
图4 微囊藻毒素-LR质量浓度随时间的变化Fig. 4 Variations of concentration of MC-LR with time
2.4 β-环柠檬醛的初始浓度的影响
针对β-环柠檬醛对铜绿微囊藻的溶藻效应最为明显,考察不同初始质量浓度的β-环柠檬醛的影响大小,从而确定β-环柠檬醛能产生抑制作用的临界浓度。β-环柠檬醛的初始质量浓度分别为 0.01,0.1,0.2,0.5和1 g/L,其光合活性a的变化如图5所示。由图5可见:随着β-环柠檬醛质量浓度的增大,光合活性a衰减得越快。当β-环柠檬醛的初始质量浓度为1 g/L时,0.5 h内的光合活性a已由0.46降为0;当初始质量浓度依次降低为0.5,0.2和0.1 g/L时,其完全失去光合活性的时间分别为1,2和4 h。当初始质量浓度为0.01 g/L时,其光合活性的变化趋势与铜绿微囊藻正常生长状态下相近,说明此浓度下的β-环柠檬醛不会对藻细胞产生溶藻效应,因此对铜绿微囊藻起到抑制作用的临界质量浓度可确定为 0.1 g/L,低于该浓度的 β-环柠檬醛不易对藻细胞的生长造成影响。通过对临界质量浓度的确定,可以明确提前打捞蓝藻的数量,再对其进行物理破坏,待产生大量嗅味物质后重新投入蓝藻暴发的水体,利用其对同类藻细胞的化感作用,对处于对数生长期的藻体进行控制,以达到生物除藻的目的。
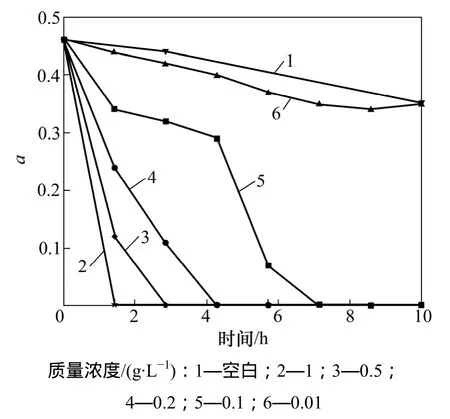
图5 β-环柠檬醛的初始质量浓度对光合活性a的影响Fig. 5 Effects of initial concentration of β-cyclocitral to photosynthetic activity
3 结论
以藻类分泌的嗅味物质为代表,考察其对铜绿微囊藻的溶藻效应。自体嗅味物质β-环柠檬醛、β-紫罗兰酮、庚醛和二甲基三硫醚对藻细胞均有不同程度地抑制和破坏作用,能降低藻细胞的光合活性,使细胞破裂,释放胞内的代谢物。甲硫醚对铜绿微囊藻的溶藻效应不明显,对藻细胞完整性的破坏能力较小。β-环柠檬醛对铜绿微囊藻表现为急剧毒性,1 g/L的质量浓度下能在1 h内迅速溶解细胞壁和细胞膜,将胞内的 MC-LR大量释放,使藻液由绿色变成蓝色,光合活性降为0。不同初始浓度的β-环柠檬醛对藻细胞的作用大小不同,0.1 g/L是起到抑制作用的临界浓度。
[1] 李锋民, 胡洪营, 门玉洁, 等. 化感物质对小球藻抗氧化体系酶活性的影响[J]. 环境科学, 2006, 27(10): 2091-2094.LI Fengmin, HU Hongying, MEN Yujie, et al. Effect of ema on activities of algal antioxidation enzymes[J]. Environmental Science, 2006, 27(10): 2091-2094.
[2] 王海燕, 蒋展鹏. 化感作用及其在环境保护中的应用[J]. 环境污染治理技术与设备, 2002, 3(6): 86-89.WANG Haiyan, JIANG Zhanpeng. Allelopathy and its use in environmental protection[J]. Technoniques and Equipment for Environmental Pollution Control, 2002, 3(6): 86-89.
[3] 胡智泉, 刘永定, 何光源. 微囊藻毒素对滇池水华束丝藻的溶藻效应研究[J]. 华中科技大学学报: 自然科学报, 2005,33(9): 128-131.HU Zhiquan, LIU Yongding, HE Guangyuan. Algae-lytic effect of microcystin-RR on Aphanizomenon flos-aquae isolated from Dianchi Lake [J]. Journal of Huazhong University of Science and Technology: Nature Science Edition, 2005, 33(9):128-131.
[4] 阎斌伦, 刘颖颖, 王长海. 球等鞭金藻生长抑制物对自身藻细胞的抑制效应[J]. 水产学报, 2009, 33(3): 456-461.YAN Binlun, SUN Yingying, WANG Changhai. Inhibitory effects of growth inhibitor isolated from isochrysis galbana on its own cells[J]. Journal of Fisheries of China, 2009, 33(3):456-461.
[5] 夏珊珊, 常学秀, 吴锋, 等. 蓝藻化感抑制作用研究进展[J].生态学报, 2008, 28(8): 3927-3936.XIA Shanshan, CHANG Xuexiu, WU Feng, et al. Advance in researches on cyanobacterium allelopathic inhibition[J]. Acta Ecologica Sinica, 2008, 28(8): 3927-3936.
[6] Harada K I, Ozaki K, Tsuzuki S, et al. Blue color formation of cyanobacteria with beta-cyclocitral[J]. Journal of Chemical Ecology, 2009, 35(11): 1295-1301.
[7] Suffet I H, Corado A, Chou D, et al. AWWA taste and odor survey[J]. Journal of the American Water Works Association,1996, 88(4): 168-180.
[8] LI Lei, GAO Naiyun, DENG Yang, et al. Characterization of intracellular & extracellular algae organic matters (AOM) of Microcystic aeruginosa and formation of AOM-associated disinfection byproducts and odor & taste compounds[J]. Water Research, 2012, 46(4): 1233-1240.
[9] Ozaki K, Ohta A, Iwata C, et al. Lysis of cyanobacteria with volatile organic compounds[J]. Chemosphere, 2008, 71(8):1531-1538.
[10] Ozaki K, Ito E, Tanabe S, et al. Electron microscopic study on lysis of a cyanobacterium microcystis[J]. Journal of Health Science, 2009, 55(4): 578-585.
[11] Watt W D. Release of dissolved organic material from the cells of phytoplankton populations[J]. Proceedings of the Royal Society (B): Biological Science, 1966, 164(997): 521-551.
[12] Hitzfeld B C, Lampert C S, Spaeth N, et al. Toxin production in cyanobacterial mats from ponds on the McMurdo ice shelf,Antarctica[J]. Toxicon, 2000, 38(12): 1731-1748.
