接触氧化-水生蔬菜湿地联合处理太湖蓝藻沼液
2013-06-04余亚琴吕锡武吴义锋徐微赵晋伟
余亚琴 ,吕锡武,吴义锋,徐微,赵晋伟
(1.东南大学 能源与环境学院,江苏 南京,210096;2. 盐城工学院 土木学院,江苏 盐城,224051;3. 安徽农业大学 资源与环境学院,安徽 合肥,230036)
湖泊富营养化和蓝藻水华发生是目前全世界共同面临的重大环境问题之一。就太湖而言,全湖的平均氮磷含量近期一直居高不下, 蓝藻水华发生已经成为常态,其污染问题难以在短期内得到根本解决。 这是因为即使在外源输入减少后,在相当长一段时间内,长期积累在湖泊底泥中的内源营养盐仍然足以支撑水华蓝藻的生长,很难杜绝蓝藻水华的发生[1]。及时打捞与收集蓝藻是迅速减少水体蓝藻浓度的常用手段,同时能将湖中氮磷去除。打捞的蓝藻需要及时有效的处理,否则会造成环境的二次污染[2]。太湖蓝藻含有大量的高浓度有机物,利用厌氧发酵技术虽能使其得到有效的降解,同时获得生物质能,但出水难以达到直接排放要求[3-4]。如果大量未经后续处理的沼液排向周围水体,必然对太湖水环境造成巨大污染,同时造成沼液中大量有机质、及氮磷等营养元素的浪费。本文作者针对太湖蓝藻厌氧发酵沼液高有机物高氮磷的特点,采用接触氧化-水生蔬菜湿地联合处理太湖蓝藻厌氧发酵沼液,研究该组合工艺对污染物的去除特性及处理效果,并对污染物的去除机理进行分析,为太湖蓝藻无害化处理与资源化利用提供技术支撑。
1 实验
1.1 实验水质
实验废水取自于江苏省宜兴市周铁镇东南大学太湖蓝藻研究基地太湖富藻水厌氧发酵反应器的沼液。其主要水质指标见表 1。太湖蓝藻沼液中ρ(BOD5)/ρ(COD)为 0.33~0.47,说明太湖蓝藻沼液具有较好的可生化性,同时沼液中蛋白质大量存在,纤维素的含量较大,为沼液后续处理提供难题。
1.2 实验装置与方法
实验装置如图1所示。太湖蓝藻厌氧发酵沼液经过沉淀后通过蠕动泵进入接触氧化池,出水经过沉淀池沉淀后进入水生蔬菜湿地,最终通过出水渠排入附近池塘。2011年6月上旬进行系统启动。接触污泥取自宜兴市清源污水处理厂活性污泥,水生蔬菜湿地移栽宜兴当地的空心菜。

表1 太湖蓝藻厌氧发酵沼液水质Table 1 Composition of anaerobically digested effluent of algae from taihu lake
生物接触氧化池采用PVC板材制成,池体尺寸(长×宽×深)为0.4 m×0.3 m×0.65 m,有效容积为60 L,采用蠕动泵进水。生物接触氧化池内装组合填料,填料填充体积分数约为15%。接触氧化池使用电磁式空气泵曝气充氧,设转子流量计控制曝气量使DO(质量浓度)处于3~4 mg/L,水力停留时间控制为8 h左右。正常运行两套生物接触氧化池出水经过沉淀池沉淀后进入水生蔬菜湿地。
水生蔬菜湿地采用水生植物床,用砖石混凝土建造,内部不填充任何基质。首端为进水配水渠,末端为出水集水渠,中部是植物栽培区。栽培区有1条水槽,为矩形浅池,长、宽、深分别为10,1和0.3 m,池底坡度为1%,水力负荷0.05 m3/(m-2·d) 左右,水深可通过活动堰板调节。
1.3 分析方法

图1 实验流程图Fig. 1 Flow chart of treatment process
水质分析方法采用《水和废水监测分析方法》[5],其中,COD:重铬酸钾法;BOD5:稀释接种法;pH:玻璃电极法;采用物料平衡方法计算水生蔬菜湿地不同途径对磷的去除效果[6];藻毒素采用高效液相色谱(HPLC)法测定总微囊藻毒素(TMC-LR)、胞外微囊藻毒素(EMC-LR)[7];难降解有机物采用 GC-MS分析法[8]。
2 结果与分析
中试自2011-06上旬启动,经过半月接触氧化池活性污泥驯化和水生蔬菜湿地空心菜的生长。从2011-06下旬开始进行为期45 d夏季的中试实验,进行过程中系统运行稳定,其中,于 2011-07-20对空心菜收割一次。
2.1 接触氧化-水生蔬菜湿地组合工艺去除有机物的效能
2.1.1 接触氧化-水生蔬菜湿地组合工艺对沼液COD去除效果
接触氧化-水生蔬菜湿地对沼液中COD去除效果如图2所示。可见:沼液中ρ(COD)为174~428 mg/L,经过接触氧化池出水一般在110 mg/L以下,通过水生蔬菜湿地太湖富藻水沼液出水一般保持在50 mg/L以下,COD 去除率在80%以上,出水COD达到《城镇污水处理厂污染物排放标准》(GB 18918—2002)一级排放标准。
2.1.2 接触氧化-水生蔬菜湿地组合工艺对沼液难降解有机物去除效果
太湖富藻水沼液含有大量难降解微量有机物,通过 GC-MS定性分析沼液、接触氧化池出水难降解微量有机物组分,分析接触氧化池对其去除效果。结果如表2和3所示。
分析结果表明:从太湖富藻水厌氧发酵沼液中检测出相似度50%以上的主要有机污染物有 42种。其中有芳烃类、烃烯烃类、酸、醇、酚,酮、醛、酞胺类。其中已被确认为致癌物1种,促癌物、辅致癌物4种,致突变物1种[9-10],被列入我国环境优先污染物“黑名单”的有8种,属于美国环保局公布的优先污染物中的有机物有4种[11]。酰胺、吡啶、硝基苯等化合物在水样中均有发现。这说明太湖富藻水经过厌氧发酵后沼液所含有机物的复杂性。一方面太湖水体受污染,另一方面水体中的植物、微生物等生物体也会释放有机物[12]。
沼液经过接触氧化池后,出水所含有机物种类明显下降。相似度 50%以上的主要有机污染物只有 16种。出水中有15种有机物在进水中未检出,这些有可能是某种大分子物质的中间产物或者是微生物合成代谢产物,有待进一步研究。接触氧化池添加组合填料,易于微生物挂膜,由于生物膜自身的结构特点以及氧扩散的限制,生物膜由外向内,可以形成好氧区-缺氧区-厌氧区[13]。接触氧化池富集大量的微生物群落,微生物群落中不同基因拥有者之间能发生基因交换与基因重组,导致新的降解途径的进化,从而对难降解有机物产生协调降解的能力[14],消除单一菌种不具备完整的降解难降解有机物的酶系或基因成分的弊端。接触氧化池中菌胶团能够产生生物絮凝作用吸附沼液中的有机污染物,从而加快污染物的去除。反应器中轮虫、纤毛虫等原生动物吞食水中游离细菌和微小的污泥质点,降低沼液的浊度,并直接代谢水中一些溶解的有机化合物。

图2 接触氧化-水生蔬菜湿地对沼液中COD去除效果Fig. 2 Effect of contact oxidation and aquatic vegetable wetland process on COD removal rate in effluent

表3 接触氧化池出水有机物Table 3 Organic pollutants in effluent of contact oxidation tank
2.2 接触氧化-水生蔬菜湿地组合工艺去除沼液氮的效能
本研究采用的接触氧化-水生蔬菜湿地组合工艺对太湖富藻水厌氧发酵沼液TN和NH3-N去除效果见图 3和 4。系统中沼液 TN 质量浓度一般为 32~84 mg/L,接触氧化池出水TN质量浓度为27~66 mg/L,水生蔬菜湿地出水降低至0.1~5.9 mg/L。水生蔬菜湿地的脱氮效果要大于接触氧化池。系统对TN的去除率在90%以上。从图4可以看出:接触氧化池对NH3-N去除效果较强,经过接触氧化池,沼液中的NH3-N质量浓度一般降至30~40 mg/L,通过水生蔬菜湿地出水NH3-N平均质量浓度在1.5 mg/L以下。系统对沼液中NH3-N去除率平均达到98%以上。
在接触氧化池内部设有组合填料,为微生物提供富集的场所。沼液通过反应器底部进水管进入,空气通过曝气头在底部进入反应器,因此反应器在整体上形成基质和溶解氧的梯度分布。太湖富藻水经过厌氧消化后沼液中氮元素主要以氨氮的形式存在,在接触氧化池中氨氮主要转化为硝态氮和亚硝态氮,说明脱氮主要是好氧环境下的硝化反应完成。

图3 接触氧化-水生蔬菜湿地对沼液中TN去除效果Fig. 3 Effect of contact oxidation and aquatic vegetable wetland process on TN removal rate in effluent

图4 接触氧化-水生蔬菜湿地对沼液中NH3-N去除效果Fig. 4 Effect of contact oxidation and aquatic vegetable wetland process on NH3-N removal rate in fffluent
水生蔬菜湿地是由植物-微生物形成的复合生态系统,通过植物根系的过滤拦截、植物吸收和微生物分解等协同作用实现对沼液中氮元素的去除。植物生长季节,绿色植物吸收和微生物反硝化是其脱氮的主要途径。沼液中部分无机氮可以被空心菜生长所吸收,并随着空心菜的收割而去除;在 2011-07-30采用电镜观察空心菜的根系,发现空心菜庞大发达的根系为微生物的栖息提供巨大的物理表面,同时植物根系表面也是一些有机物沉淀的场所,图5所示为扫描电镜观察空心菜根系。Hansen等[15]进行的实验表明:水生植物系统的内部拥有大量硝化细菌,其氧化还原电位及硝化的速率均高于未生长水生植物的湖泊沉淀区。水生植物自生的通气系统有利于 O2在体内传输并送至根部,这不仅满足水生植物在水下无氧环境中的呼吸作用,而且在植物根系周围形成连续的好氧、缺氧、缺氧微环境,创造出许多串联或并联的“A/A/O”微处理单元,为异氧菌、自养菌和反硝化细菌等微生物分别占据的优势生态位提供条件,通过硝化和反硝化大大提高氮的去除效果。
2.3 接触氧化-水生蔬菜湿地组合工艺去除沼液总磷的效能
图6所示为接触氧化-水生蔬菜湿地对沼液中TP去除效果。从图6可以看出:系统对太湖富藻水沼液TP去除率在90%以上。沼液经过接触氧化池后,通过沉淀池排放剩余污泥,对TP的去除率在20%左右;最终经过水生蔬菜湿地后沼液 TP质量浓度在 0.5 mg/L以下,完全达到《城镇污水处理厂污染物排放标准》(GB 18918—2002)一级A排放标准。
接触氧化池对磷的去除主要通过聚磷菌好氧聚磷,在沉淀池以排除剩余污泥的形式而排出。人工湿地对磷的去除是通过植物的吸收及拦截、微生物作用及湿地床的物理化学作用等方式共同作用完成的。太湖富藻水厌氧发酵沼液中无机磷在植物吸收及同化作用下可变成植物的ATP(三磷酸腺苷)、DNA(脱氧核糖核酸)及RNA(核糖核酸)等有机成分,通过空心菜被收割而去除磷。经过实验分析,空心菜吸收磷占磷总量20%左右。微生物除磷主要是通过聚磷菌的过量摄磷而实现,由于水生蔬菜湿地中存在氧的梯度分布,致使系统中交替出现好氧和厌氧状态,获得有利于聚磷菌的生境。水生蔬菜湿地中空心菜发达的根系交织成毯状的垫层为其拦截颗粒态的磷提供便利。实验结束后,通过截留沉积作用形成底泥而去除的磷占磷总量的73%左右。同时水生蔬菜湿地植物床采用砖石混凝土建造,其中的钙离子与磷发生反应对磷的去除也起到一部分作用[16]。
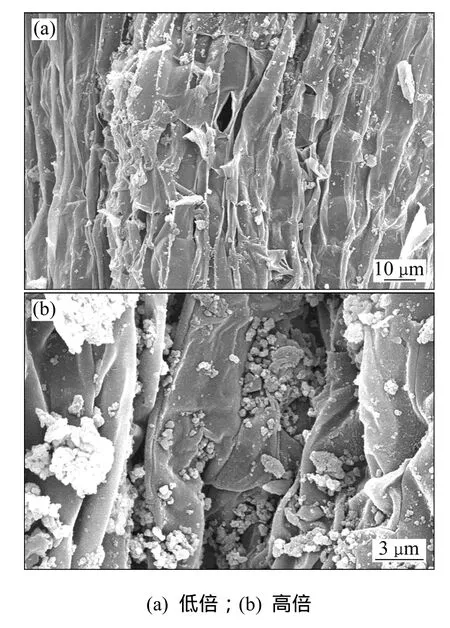
图5 扫描电镜观察空心菜根系Fig. 5 SEM images of ipomoea aquatica roots

图6 接触氧化-水生蔬菜湿地对沼液中TP去除效果Fig. 6 Effect of contact oxidation and aquatic vegetable wetland process on TP removal rate in effluent
2.4 接触氧化-水生蔬菜湿地组合工艺去除沼液中藻毒素的效能
太湖富藻水经过厌氧发酵,沼液中藻毒素含量会降低,但沼液中依然含有藻毒素[17],太湖蓝藻经过厌氧发酵沼液中EMC-LR和TMC-LR质量浓度分别为15.82 μg/L和9.05 μg/L。沼液经过接触氧化-水生蔬菜湿地组合工艺后藻毒素的变化见表 4。蓝藻沼液经过接触氧化池后,TMC-LR去除率平均为79%,EMC-LR去除率平均为86%,藻毒素的质量浓度大大降低,水生蔬菜湿地出水中藻毒素基本低于0.3 μg/L。

表4 组合工艺对沼液中藻毒素去除效果Table 4 Effect of combined process on algal toxins removal rate in effluent
接触氧化池对沼液中藻毒素的去除途径主要包括以下几个方面:首先接触氧化池填充比表面积较大的组合填料,其对沼液中未降解的藻类吸附,降低沼液中蓝藻的含量;同时接触氧化池填料中驯化富集大量溶藻菌,附着在填料生物膜表面的藻类进一步被填料中溶藻菌进行溶藻, 释放出藻细胞内的毒素,再通过藻毒素降解菌进行降解。接触氧化池在好氧状态下有利于藻毒素的去除[18]。此外富集在生物膜表面的藻毒素随着生物膜的脱落通过沉淀池排除接触氧化池剩余污泥时,会一起排出系统外。水生蔬菜人工湿地为植物、微生物和水中浮游的原生动物和后生动物等共生系统,空心菜庞大根系富集的微生物有利于对胞外藻毒素的降解,植物根系的截留与浮游动物的吞噬,进一步降低胞内藻毒素的含量[19-20]。
3 结论
(1) 太湖富藻水厌氧发酵沼液经过接触氧化池的处理后,减少污染物的负荷,降低由于高浊度进水对水生蔬菜湿地所造成的堵塞。水生蔬菜发达的根系具有强大的表面积,为拦截颗粒物和微生物的富集提供场所。沼液经过接触氧化-水生蔬菜湿地处理后,化学需氧量ρ(COD)<50 mg/L、氨氮质量浓度ρ(NH3-N)<1.5 mg/L、总氮质量浓度ρ(TN)<5.9 mg/L、总磷质量浓度ρ(TP)<0.5 mg/L,可满足《城镇污水处理厂污染物排放标准》(GB 18918—2002)一级A排放标准。
(2) 接触氧化池能够有效去除太湖富藻水厌氧发酵沼液中烷烃类污染物、芳烃及杂环类难降有机物。接触氧化-水生蔬菜湿地组合工艺对沼液COD去除率可以达到80%以上。
(3) 接触氧化-水生蔬菜湿地组合工艺能够有效地降解太湖富藻水厌氧发酵沼液中的微囊藻毒素,系统出水中藻毒素基本低于0.3 μg/L。接触氧化池填料与水生蔬菜根系的有效截留及富集的大量微生物是藻毒素有效降解的主要因素。
[1] 孔繁翔, 马荣华, 高俊峰, 等. 太湖蓝藻水华的预防、预测和预警的理论与实践[J]. 湖泊科学, 2009, 21(3): 314-328.KONG Fanxiang, MA Ronghua, GAO Junfeng, et al. The theory and practice of prevention, forecast and warning on cyanobacteria bloom in Lake Taihu[J]. Journal of Lake Sciences, 2009, 21(3): 314-328.
[2] 程真文. 巢湖藻类污染的研究和对策[J]. 水处理技术,2003, 29(4): 247-248.PENG Zhenweng. Research and countermeasures of algae pollution algae pollution in Chaohu Lake [J].Technology of water treatment, 2003, 29(4): 247-248.
[3] 胡萍. 蓝藻厌氧发酵产沼气的研究[D]. 无锡: 江南大学环境与土木工程学院, 2009: 1-2.HU Ping. Study on anaerobic fermentation with blue algae to produce methane[D]. Wuxi: School of Environmental and Civil Engineering, Jiangnan University, 2009: 1-2.
[4] 杜静, 严少华, 常志州, 等. 太湖蓝藻产沼气潜力及复合折流板反应器(ABR)工艺中试[J]. 江苏农业学报, 2008,24(6): 948-953.DU Jing, YAN Shaohua, CHANG Zhizhou, et al. Potential of methane production of blue algae and its feasibility of fermen- tation with anaerobic baffled reactor[J]. Jiangsu Journal of Agricultural Sciences, 2008, 24(6): 948-953.
[5] 国家环境保护总局. 水和废水监测分析方法[M]. 第 4版.北京: 中国环境科学出版社, 2004: 210-284.State Environmental Protection Administration of China.National standard methods for water and wastewater quality analysis[M]. 4th eds. Beijing: China Environmental Science Press, 2004: 210-284.
[6] 宋海亮. 水生植物滤床技术改善富营养化水体水质的研究[D]. 南京: 东南大学环境工程与工程系, 2005: 56-57.SONG Hailiang. Study on aquatic plant filter bed system for eutrophicated water quality improvement[D]. Nanjing:Southeast University. Department of Environmental Science and Engineering, 2005: 56-57.
[7] 张立将, 尹立红, 浦跃朴, 等. 水中微囊藻毒素高效液相色谱检测与前处理条件优化[J]. 东南大学学报: 自然科学版, 2005, 35(3): 446-451.ZHANG Lijiang, YIN Lihong, PU Yuepu, et al. Optimization in analysis and sample preparation of microcystins in water with high-performance liquid chromatography[J]. Journal of Southeast University: Natural Science Edition, 2005, 35(3):446-451.
[8] 沈幸, 刘云, 鲜啟鸣, 等. 太湖水源地水体中半挥发性有机物的监测[J]. 环境污染与防治, 2006, 28(5): 396-398.SHEN Xing, LIU Yun, XIAN Qiming, et al. Monitoring of semivolatile organic compounds in source water of Taihu Lake[J]. Environmental Pollution & Control, 2006, 28(5):396-398.
[9] 朱惠冈, 俞顺章. 饮水中致癌、致突变物(上)[J]. 环境保护,1985(3): 28-30.ZHU Huigang, YU Shunzhang. Carcinogens and matagenicity in drinking water(Ⅰ)[J]. Environmental Protection, 1985(3): 28-30.
[10] 朱惠冈, 俞顺章. 饮水中致癌、致突变物(下)[J]. 环境保护,1985(4): 21-23.ZHU Huigang, YU Shunzhang. Carcinogens and matagenicity in drinking water(Ⅱ)[J]. Environmental Protection, 1985(4): 21-23.
[11] 任南琪, 李建政. 环境污染防治中的生物技术[M]. 北京:化学工业出版社, 2004: 127-128.REN Nanqi, LI Jianzheng. Biological technology in the treatment of environmental pollution[M]. Beijing: Chemical Industry Press, 2004: 127-128.
[12] Marona H R N, Schenkel E P, Bergonci J I. Phytotoxic activity of ateleia glazioviana baill, extracts on lettuce seeds[J]. Acta Fram Bonaerense, 2003, 22: 17-20.
[13] 方芳, 王淑梅, 冯翠杰, 等. 好养条件下复合生物膜-活性污泥反应器中的反硝化菌群结[J]. 生态学杂志, 2011,30(3): 430-437.FANG Fang, WANG Shumei, FENG Cuijie, et al.Community structure of denitrifying bacteria in a hybrid AS-biofilm process under aerobic condition[J]. Chinese Journal of Ecology, 2011, 30(3): 430-437.
[14] 董春娟, 吕炳南, 马立, 等. 微生物群落在难降解物质生物降解中的作用[J]. 哈尔滨工业大学学报, 2003, 35(7):893-896.DONG Chunjuan, LÜ Bingnan, MA Li, et al. Importance of microorganism community for degradation of refractory compounds[J]. Journal of Harbin Institute of Technology,2003, 35(7): 893-896.
[15] Hansen J I, Andersen F O. Effects of phragmites roots and rhizomes on nitrification and bacterial numbers in the ediments[C]//Proceedings of the 9th Nordic Symposium on Ediments. Norr Malmo, Weden, 1981: 68-71.
[16] US Environment Protection Agency. Manual-constructed wetlands treatment of municipal wastewaters(EPA/625/R-99/010)[R]. Cincinnati, Ohio: Office of Research and Development, National Risk Management Research Laboratory, 1999: 35-36.
[17] 薛延丰, 李慧明, 石志琦. 蓝藻发酵沼液对青菜生物学特性和品质影响初探[J]. 江西农业学报, 2009, 21(10): 59-62.XUE Yanfeng, LI Huiming, SHI Zhiqi. Effects of biogas slurry of blue-green algae on biologica1 characteristics and quality of chinese cabbage[J]. Acta Agriculturae Jiangxi,2009, 21(10): 59-62.
[18] 吕锡武, 稻森悠平, 丁国际. 有毒蓝藻及微囊藻毒素生物降解的初步研究[J]. 中国环境科学, 1999, 19(2): 138-140.LU Xiwu, YUHEI Inarnori, DING Guoji. Degradation of microcystis viridis and microcystins with biological reacroes[J]. China Environmental Science, 1999, 19(2):138-140.
[19] Cousins I T, Bealing D J, Janmes H A, et al. Biodegradation of microcystin-LR by indigenous mixed bacterial populations[J]. Water Research, 1996, 30(2): 481-485
[20] Iwami N, Inamori Y. Predation and degradation characteristics of microcystis forming water bloom by combination of functional micro-animals[J]. Japanese Journal Water Treatment Biology,1999, 35(4): 225-233.
