陶瓷微滤膜微生物污染的实验研究
2013-05-29钱玲
钱 玲
(盐城消防技术服务事务所,江苏 盐城 224001)
0 引言
陶瓷微滤膜过滤过程中除大量有机和无机污染物堵塞在膜表面及孔道外,滋生的一些微生物会附着在膜表面和孔道内,并且在膜表面和孔道内繁殖,分泌大量的胞外聚合物堵塞膜孔通道,使膜过滤的阻力增加,过滤通量迅速下降,而进入到滤液里的大量胞外聚合物则会影响过滤后流体的质量。[1]由此可见,在陶瓷膜的应用过程中,微生物及胞外聚合物在膜表面和孔道内的滋生和黏附严重影响了陶瓷膜的使用效果和使用寿命,造成二次污染。因此陶瓷膜生物污染的研究具有重要的实用价值。文章通过实验研究了受污染陶瓷膜的微生物污染情况,观察微生物对膜污染的影响,找出造成微生物污染的主要成分,优化陶瓷膜间歇运行的间歇周期,并对减轻微生物污染进行了一些探索。
1 实验部分
1.1 实验装置及器材
实验采用死端过滤方式,陶瓷膜过滤装置由南京慧城水处理设备有限公司生产,设备实物如图1,工艺流程图如图2。
在恒压下进行过滤试验,压力由压缩氮气提供,透过液体积用电子秤通过测量重量计算,根据渗透速率取样间隔5 min变化,温度用电子恒温水浴锅控制。实验所用陶瓷膜管为HCCM—200型和HCCM—800型,膜孔径分别为200 nm和800 nm。图3为实验所用陶瓷膜管的实物图,表1为陶瓷膜管的规格参数。

图1 陶瓷膜过滤装置实图
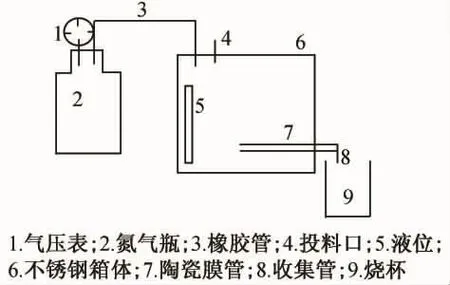
图2 陶瓷膜过滤装置工艺流程图

图3 实验所用陶瓷膜管实物图
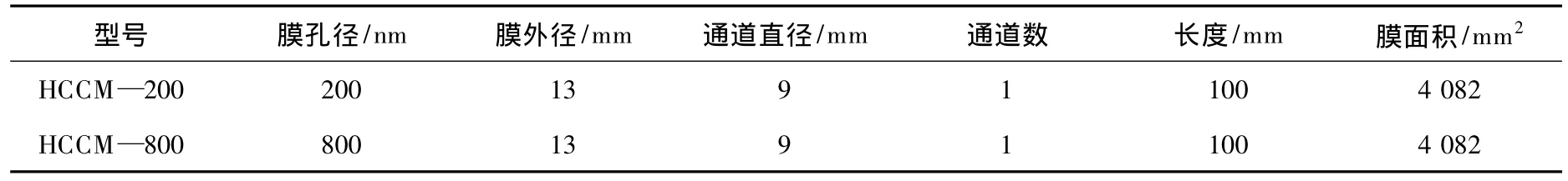
表1 陶瓷膜管的规格参数
1.2 实验所需模拟液的配制
自然水体中有机物的主要成分为腐殖酸、蛋白质、多糖等,其中腐殖酸约占45%,蛋白质、多糖约占60%。[2]实验所配制的模拟体系中蛋白质(大豆蛋白粉替代)的质量占55%,腐殖酸的质量占45%。根据国家环境保护部数据统计,我国自然水体TOC值为1.5~40 mg/L(包括我国主要水系)。因此,实验所配制的模拟体系TOC值选择为1.5~40 mg/L,以符合工程的实际应用。
1.3 实验目的及内容
研究自然水体中有机物对微滤陶瓷膜污染特性是实验研究的部分内容,通过实验观察微生物对膜污染的影响,找出造成微生物污染的主要成分,并对如何减轻微生物污染进行了一些探索。
实验主要分3步进行:
1)孔径为200 nm和800 nm陶瓷微滤膜的微生物生长实验,研究膜运行过程中运行时间与微生物生长的关系和环境温度与陶瓷膜运行间歇期微生物生长的关系。
2)主要成分的微生物生长实验,确定引起微生物污染的主要成分。
3)投加次氯酸钠陶瓷微滤膜过滤研究,验证投加次氯酸钠对减轻陶瓷膜的微生物污染有较好的效果。
2 结果与讨论
2.1 陶瓷微滤膜间歇运行过程中运行时间与微生物生长的关系
根据文献报道[3-4],微生物在膜上形成污染的过程主要分为3个阶段:第一阶段,原料液中的腐殖酸、蛋白质、多糖、微生物以及微生物的代谢产物等,向膜面沉积并积累,逐渐形成一层适合微生物生长、繁殖的生物膜;第二阶段,微生物在生物膜表面生长、繁殖产生代谢产物(细胞外聚合物),这些物质包裹住细胞体形成具有很高黏度的水合凝胶层,使污染物与膜表面之间的结合力更强,更加难于清洗;第三阶段,大量的微生物及其代谢产物在膜表面形成黏泥,结果导致阻力急剧升高,通量迅速下降,出水水质严重恶化,且膜的清洗困难较大。因此,陶瓷膜在受到微生物污染的情况下,应及时进行冲洗,以免污染恶化。
实验采用的膜管为南京慧城水处理设备有限公司生产的HCCM—200的陶瓷膜管,在操作压力为0.1 MP,温度为20℃的条件下,以死端过滤的形式对TOC值为30 mg/L的模拟液进行过滤,由于实验所用过滤方式与实际应用不同(给水车采用错流过滤形式),故实验以通量下降的比例参照陶瓷膜管与微生物生长的关系,实验选择在上述条件下运行,通量下降为60%、50%、40%、30%的膜管在温度为25~30℃(夏季)的环境中保存,定时进行纯水通量测试,观察其通量的变化情况。
表2所示为膜管运行前55 min的通量情况,分别取运行点 15 min、20 min、35 min、55 min 的膜管在温度为30℃的环境中存放,分别测试其纯水通量。
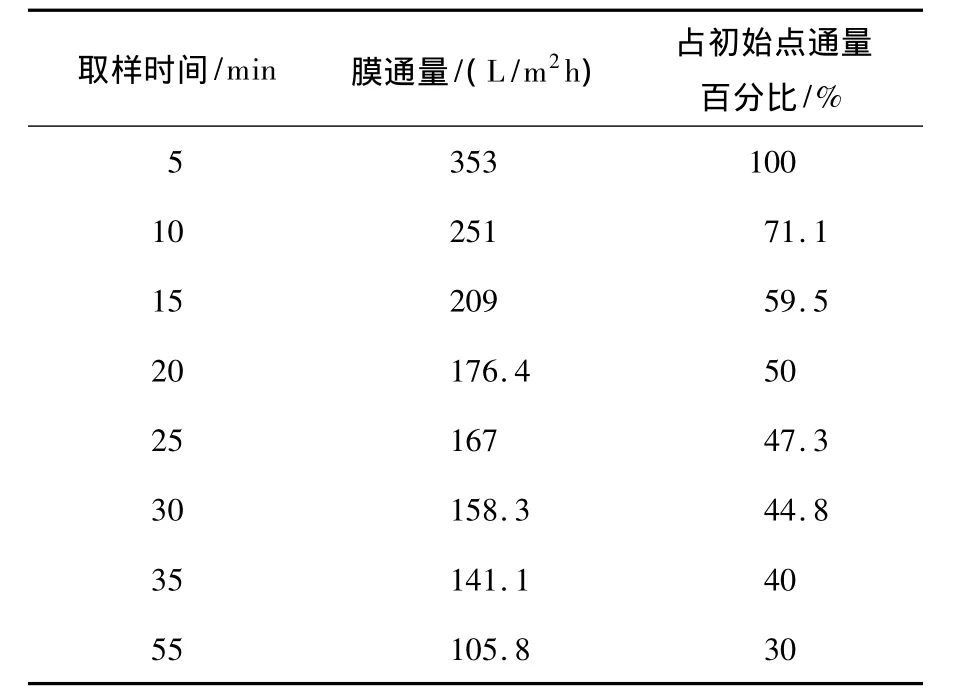
表2 膜通量随时间的衰减情况
图4~图7为通量衰减分别为60%、50%、40%和30%的膜管纯水通量的变化情况,由图3~图6可以看出,膜通量衰减为50%和60%的膜管通量变化缓慢,在160 h左右开始急剧衰减;膜通量衰减为30%和40%的膜管通量在前10 h内变化较缓慢,但约在24 h后通量急剧衰减,120 h左右膜管严重堵塞(实验中发现出水呈黑褐色)。说明在陶瓷膜运行过程中,膜通量下降为初始计数点(5 min)通量的40%左右停止使用,需进行反冲洗,陶瓷膜停止使用7 d以上未进行冲洗的无法直接使用,需进行进一步处理。
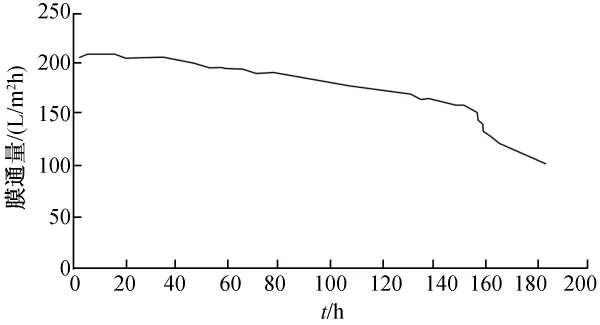
图4 通量衰减为60%的膜管通量变化情况
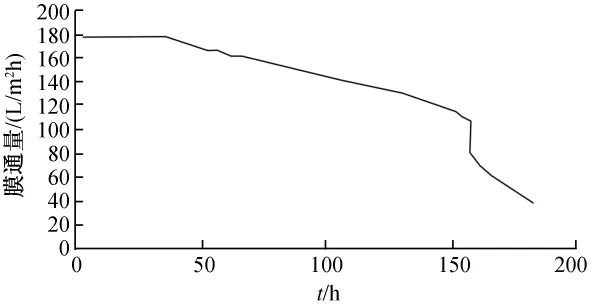
图5 通量衰减为50%的膜管通量变化情况
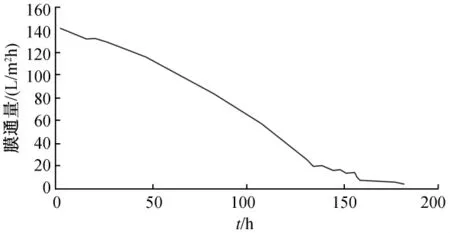
图6 通量衰减为40%的膜管通量变化情况
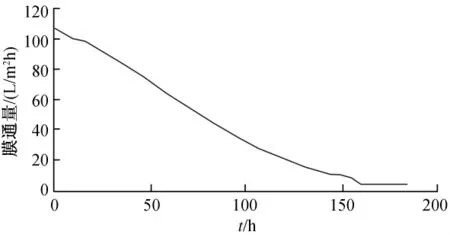
图7 通量衰减为30%的膜管通量变化情况
2.2 环境温度与陶瓷膜运行间歇期微生物生长的关系
文献[5]显示,温度对膜上微生物生长的影响较大,因此为结合实际应用过程中温度的变化情况,实验选择在15℃以下的冬季、15~25℃的4—5月份、25~30℃的夏季3个温度段进行。实验采用的膜管为南京慧城水处理设备有限公司生产的HCCM—200的陶瓷膜管,在操作压力为0.1 MP,模拟液温度为20℃的条件下,以死端过滤的形式对TOC值为30 mg/L的模拟液进行过滤,待膜通量衰减为40%附近取下膜管保存,定时进行纯水通量测试。
图8为不同温度下膜通量随时间的变化情况。由图8可以看出,25~30℃温度段通量衰减速度最快;15℃以下通量变化很小,趋于平稳;15~25℃温度段通量也迅速衰减,但其衰减速度及程度均较25~30℃温度段低。可见,膜通量衰减速度随温度升高而升高,随温度降低而降低,夏季膜通量衰减速度明显高于冬季,在温度为15℃以下的冬季使用,受污染膜表面的微生物生长不明显,陶瓷膜可连续间歇运行,无需过多地冲洗。
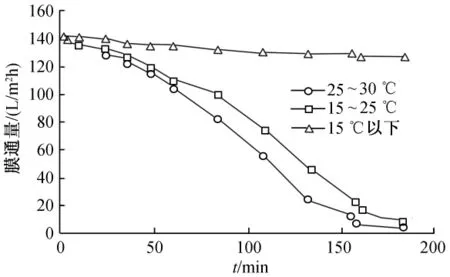
图8 不同环境温度下膜通量随时间的变化关系
2.3 确定引起微生物污染的主要成分
做对比试验,确定引起微生物污染的主要成分,以及堵塞情况的变化。在压力为0.05 MP,温度为20℃的条件下,利用孔径为200 nm的陶瓷膜,采用死端过滤的形式,过滤TOC值为30 mg/L的模拟液3 h,得到稳定通量的膜管,进行间歇运行试验观察微生物的生长对陶瓷膜堵塞的情况。在低压0.05 MP(防止压力过大将膜内截留的有机物冲刷掉),温度为30℃的条件下,测试被污染膜管纯水通量的变化。
由图9可以看出,单纯被腐殖酸污染的陶瓷微滤膜通量随时间的变化与被混合模拟液污染的陶瓷微滤膜基本相同,大约36 h后,通量开始迅速下降,90 h左右趋于平稳。由图10可以看出,两种有机物通量衰减情况对比,单纯被蛋白质污染的陶瓷微滤膜管的通量在200 h内无明显变化,说明腐殖酸能够为滋生的微生物提供生长、繁殖的条件,导致受其污染的膜管滋生大量微生物,使污染程度加重。

图9 被腐殖酸污染的陶瓷微滤膜通量随时间衰减曲线
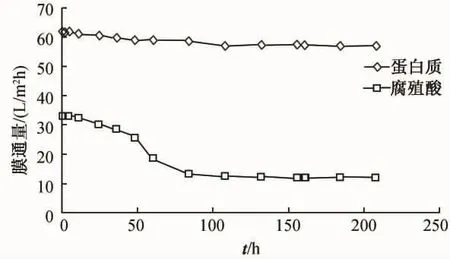
图10 被两种物质污染的陶瓷微滤膜随时间衰减曲线
2.4 减轻陶瓷微滤膜微生物污染的方法探索
陶瓷微滤膜过滤过程中在膜表面及孔道内,滋生的一些微生物会附着在膜表面和孔道内,并且在膜表面和孔道内繁殖,分泌大量的胞外聚合物堵塞膜孔通道,使膜过滤的阻力增加,过滤通量迅速下降,且进入到滤液里的大量胞外聚合物则会影响过滤后流体的质量。
次氯酸钠作为饮用水的消毒剂之一,经常被用作自来水的消毒处理,同时次氯酸也可用作水处理的源水进行处理消毒。由于次氯自身的强氧化性,可抑制水中细菌和病毒等微生物的生长、繁殖,因而可减轻膜的生物污染。实验采用向待过滤模拟液中投加次氯酸钠的方法验证该方法对降低膜污染的效果。
配制有机物浓度为74.6 mg/L,分别加入次氯酸钠,使其浓度分别为0 mg/L、3 mg/L、6 mg/L、10 mg/L、15 mg/L的溶液,在操作压力为 0.1 MP,温度为20℃的条件下用孔径为800 nm和200 nm的陶瓷微滤膜过滤,观察其通量衰减情况,结果如图11、图12所示。
由图11和图12可以看出,投加次氯酸钠对孔径为800 nm和200 nm的陶瓷微滤膜通量的影响,总体趋势基本相同。随着次氯酸钠投加量的增大,稳定通量逐渐升高,但达到稳定通量所需时间的增加。由此可见,投加次氯酸钠后,减轻了膜管的微生物污染,达到了改善通量的效果。
3 结论
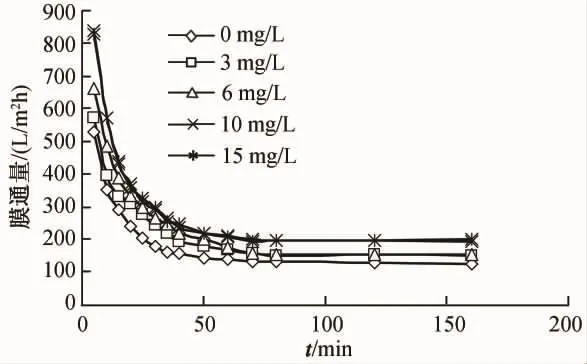
图11 孔径800 nm陶瓷膜通量变化情况
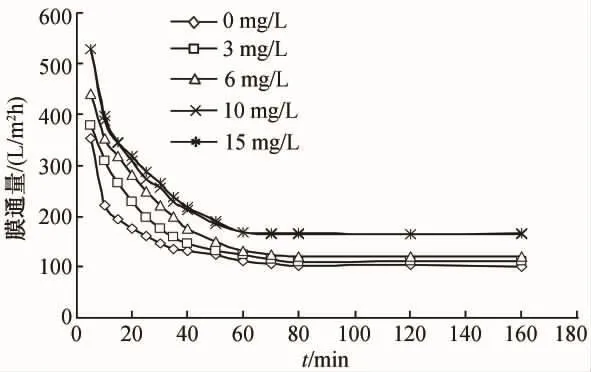
图12 孔径200 nm陶瓷膜通量变化情况
1)陶瓷微滤膜在间歇运行过程中,温度超过15℃,膜通量衰减为40%以下时,膜管易滋生微生物,造成严重的生物污染,需在使用完毕后进行水力清洗。膜通量衰减速度随温度升高而升高,夏季明显快于冬季。在温度为15℃以下的冬季使用,受污染膜表面的微生物生长不明显,陶瓷膜可连续间歇运行,无需过多的水力冲洗。
2)腐殖酸能够为滋生的微生物提供生长、繁殖的条件,是引起微生物污染的主要原因。向模拟液中投加适量的次氯酸钠,是控制膜管微生物污染的有效方法。
[1]Flemning H C.Bio-fouling on Membranes[J].Microbiologi Calapproach.Desalination,1998,20:95 -199.
[2]周兰.水中天然有机物的混凝特性研究[D].西安:西安建筑科技大学,2001.
[3]薛德明,王炳南,陈益棠,等.膜集成技术制取甘露醇的工业运转报告[C]//第四届全国膜和膜过程学术报告会论文集.南京:南京工业大学膜科学技术研究所,2002:684-689.
[4]McDonogh R,Schaule G,Flemming H C.The Permeability of Biofouling Layers on Membranes[J].J Membr Sci,1994,87:199-217.
[5]Conmittee R.The States of Direct Filtration JAWWA[J].Microbiological Approach Desalination,1980,72(7):405.
