Frankia菌侵染木麻黄与其共生结瘤程序
2013-05-29沈爱华林永敬王秋芹林海萍
张 昕,沈爱华,林永敬,王秋芹,林海萍
(1.浙江农林大学 林业与生物技术学院,浙江 临安 311300;2.浙江省林业科学研究院,浙江 杭州 310023)
木麻黄Casuarina spp.作为重要的共生营养型树种,在防风固沙、防海浪侵蚀以及海岸带生态系统的恢复中发挥重要的作用[1-2]。放线菌Frankia属是木麻黄重要的共生固氮菌,因它在固定氮素、培肥地力、提高植物生长势和土壤生态修复等方面的独特优势,自从分离、获得纯培养以来一直是人们研究的目标之一[3-5]。目前,Frankia菌的分离和纯培养技术已较为成熟,并成功地建立起基因组提取和目标基因扩增的分子技术体系[6-8]。近年来结瘤基因和结瘤程序逐渐成为研究热点。如Oureye等[9]将组培技术引入到Frankia菌结瘤的研究中,利用室内组织培养研究了木麻黄在不同基质培养基中的长势和结瘤数量。McEwan[10]利用荧光显微镜观察了Frankia菌侵染欧洲桤木Alnus glutinosa根部的早期过程。Liu等[11]利用超薄切片技术研究了Ceanothu spp.与Frankia菌的早期互作和侵染过程。张小民等[12]报道了Frankia菌-沙棘Hippophae rhamnoides共生体系的侵染和结瘤过程。但迄今为止关于自然条件下Frankia菌在木麻黄根部共生结瘤程序一直未有报道。浙江省岛屿星罗棋布,海岸线漫长,拥有丰富的木麻黄和Frankia菌资源。作者于2008-2010年就省内丰富的木麻黄共生固氮Frankia菌进行广泛的收集,选取其中固氮效果较好的2株作为供试菌株,通过定期制作根瘤切片和显微观察还原了外界环境下Frankia菌在木麻黄根部的侵染、结瘤过程,以期为菌株的实际开发利用提供理论依据。
1 材料与方法
1.1 供试菌株和苗木
供试2个Frankia菌株为作者2008-2010年分离自浙江省短枝木麻黄Casuarina equisetifolia上的根瘤,经验证具有良好的固氮活性,分别编号为 ZCN113和 ZCN192[13-14]。供试苗木为短枝木麻黄,购自浙江宁波永丰园林绿化公司,苗高15 cm。
1.2 回接结瘤
实验于2011年3-6月在浙江农林大学生物测试中心温室内进行。把供试幼苗移栽至直径20 cm的塑料营养钵中,营养钵中混配体积比1∶1的沙土和基质,浇水以使幼苗及时复壮,1周后待幼苗成功定植后用于后续试验。供试2株Frankia菌株经BAP培养基[15]28℃静置培养4周后用于回接接种试验。菌液离心后收集沉淀,轻微匀浆后以蒸馏水制备成菌悬液,用无菌注射器吸5 mL菌悬液注射到苗木根系周围土壤,1株Frankia菌接60株苗,以无菌蒸馏水为对照,该试验隔 20 d重复1次,共3次,以验证其重复性。接种后隔3 d随机选取木麻黄幼苗,以流水轻轻冲洗取其完整幼根观察结瘤情况,并就结瘤部位、结瘤数量进行统计,将已产生的根瘤分别制作超薄和半薄切片,进行电镜和光镜观察。温室环境控制为白天28℃,夜晚25℃,光周期14 h/10 h,空气相对湿度70%。
1.3 显微观察
将上述根瘤用无菌去离子水冲洗干净后切成大小为1.0 mm3的样品,立即放入40.0 g·kg-1戊二醛固定液(用 0.2 mol·L-1磷酸缓冲液配制,pH 7.2)中 12 h,磷酸缓冲液清洗 3 次(20 min·次-1),再经 20.0 g·kg-1饿酸固定4 h,然后用蒸馏水冲洗3次(20 min·次-1),用乙醇逐级脱水并用环氧丙烷过渡2次,然后用环氧树脂包埋,超薄切片机切片,切片厚度约90 nm,铅盐染色,JEM-1230型生物用透射电子显微镜观察、摄影。半薄切片的制作是将包埋好的样品切成0.6 μm半薄切片,在万能显微镜下观察拍片。
2 结果与分析
2.1 根部的结瘤情况
接种Frankia菌的木麻黄根部根毛与未接菌的对照相比未发现肉眼可见的变化。接种24 d后,根部开始出现近球形根瘤,根瘤较小,随着时间延长,根瘤逐渐增大、数量逐步增加,到45 d左右根瘤数目达到最大,并不再增加。此时整个根系的根瘤大小不一,较大根瘤直径为4 mm,小的1 mm左右。根瘤主要集中在由主根发起的新鲜、细小侧根上。侧根呈毛发状,多在毛发状的侧根中间形成根瘤,初期根瘤极小,在侧根中央略突起,逐渐成近球形,透明,后随着根瘤长大,逐渐成白色根瘤,接着颜色加深,略呈褐色。此外,根部的根瘤常可聚集生长,使得结瘤处根部呈念珠状,少数在端部产生根瘤,使得根端部呈球形,或者明显加粗,根瘤表面光滑,与其他部位相比根毛稀少,如图1。
2.2 Frankia菌的侵染过程

图1 木麻黄根瘤 (A:早期幼嫩根瘤;B:呈念珠状根瘤)Figure1 Root nodules produced by Casuarina equisetifolia(A:baby nodules;B:bead-shape nodules)

图2 接种6 d后根组织纵截面超薄切片(黑色为侵染细胞)400×Figure2 Longitudinal section of root of Casuarina equisetifolia 6 d after inoculation(the darken cells were infected,400×)
接种3 d后,不同菌株接种的木麻黄根部细胞的正常结构都没有发生改变。接种6 d后,光学显微镜观察显示Frankia菌已开始侵染根部细胞(图2),被侵染的根毛代谢十分活跃,胞质内含有丰富的核糖体、高尔基体、线粒体、质体、内质网、微管等以及酚类物质,并被侵染的根毛发生了代谢方向上的改变,从侵染位点2侧可以看到,根毛初生壁内侧迅速增厚,形成了很多不规则的电子密度中等的沉积物(图3)。在电镜切片上可以明显看到,由于内生壁的局部加厚而形成一个管状结构,这个管状结构将菌体包裹起来,形成 “侵染线”。随着菌体在侵染线内的继续侵入,在菌体黏液层外很快又被这些新形成的沉积物所包裹,这些沉积物形成了菌体最外层新的保护结构,而且随菌体继续侵染,沉积物在菌体外进一步加厚。这层菌体外的特殊保护结构,就是 “界面质”(interfacial matrix,图4)。当侵染菌体接触并进入根毛皮层细胞前,侵染线前方的皮层细胞早已开始膨大,转变为传递细胞。传递细胞极度增大,并在侵染点2侧细胞内壁增生,沉积物增多(图6)。接种12 d后从透射电镜切片还可以看到,中柱形成层细胞形成了根瘤原基。15 d后根瘤原基部分薄壁细胞被Frankia菌侵染后,转变为前根瘤(图7),薄壁细胞中可见明显的菌丝、泡囊和孢子(图8)。前根瘤进一步生长发育伸长,突出皮层后形成新根瘤并最终发育成成熟瘤(接种24 d后)。Frankia菌整个侵染过程可总结为:Frankia菌侵染→侵染线→形成“界面质”→穿壁→繁殖→泡囊→孢子。根瘤中的整个生活史为:根瘤原基→前根瘤→成熟瘤。且在根瘤由小及大的过程中,切片组织发现木麻黄根系细胞壁出现沉积物,且有逐步增多的趋势,细胞壁随之加厚(图 9)。

图3 Frankia菌侵入根毛后,根毛细胞内形成大量不规则、电子密度中等的沉积物(3000×)Figure3 Roothaircellsproducedabundant irregular electron dense deposit afterinfectedbyFrankia(3000×)

图4 菌体外的特殊保护结构——“界面质”(20000×)Figure4 Especial protection structure:“interfacial matrix” packaging Frankia strains(20000×)
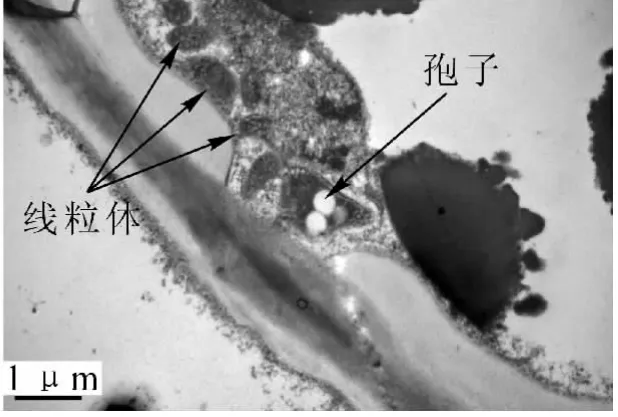
图5 根毛细胞内大量的线粒体及菌体的孢子Figure5 Abundant mitochondrias and Frankia spores in root hair cells
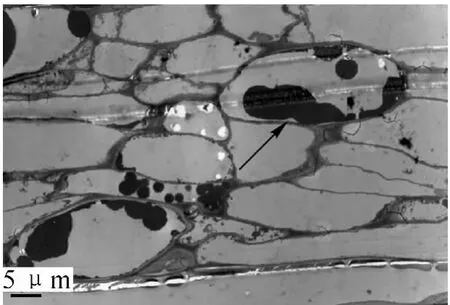
图6 体积增大,沉积物增多的传递细胞Figure6 Enlarging transfer cells with more deposit
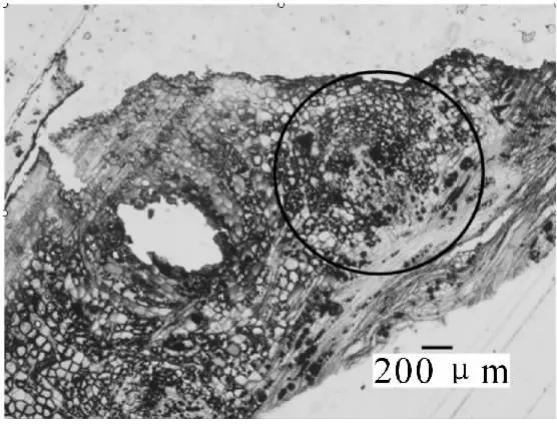
图7 已被Frankia菌侵染的前根瘤(接种15 d后,100×)Figure 7 Prenodule infected by Frankia 15 d after inoculation(100×)
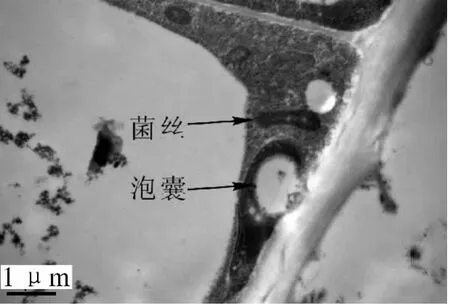
图8 根瘤细胞内Frankia菌的菌丝和泡囊 (图中白色圆形区域,20000×)Figure8 Hypha and vesicles of Frankia inside nodule cell 20000×)

图9 随着Frankia菌侵入根系细胞壁出现沉积物并有加厚趋势 (A:早期细胞壁;B:中期细胞壁;C:晚期细胞壁,4000×)Figure9 Cell wall exhibited pigementation and becoming thickening with the proceeding intracellularly of Frankia (A∶early cell wall;B:interim cell wall;C:terminal cell wall,4000×)
3 讨论
Frankia菌与木本植物共生结瘤后产生裂瓣状根瘤,有时数个根瘤同时发生,从而最终形成成熟的瘤簇。在本研究中木麻黄形成的根瘤均为圆形,根瘤较小,有时呈串珠状,结果证实了土质不同形成的根瘤的形态和数量不同的报道。例如,刘强等[16]发现土壤的比重、容量、孔隙影响木麻黄的结瘤数量、分布和形态。土壤颗粒越细、质地越硬,孔隙就越小,通气性就越差,根系难以延伸,不利于根瘤形成且根瘤较小。在本实验中因混配了大量的沙土,最终多数根瘤产生在土壤 5~10 cm的土层中,且呈串珠状,个体小,数量多,2个菌株表现出一致性。研究还发现,根瘤产生的时间不具有同一性,第1个真正根瘤产生于接种后第24天,在第36天的追踪取样时发现,同一根系出现发育程度不同的根瘤,且新出现根瘤多数出现在幼嫩新发出侧根上。可推断,利用土壤根圈接种,与Frankia菌最先接触的根系最易早期发生应答反应继而结瘤,而后,新产生的根系在延伸的过程中与存在于土壤中的菌丝再行接触形成次期根瘤。此外,本实验中在盆钵的固定空间根瘤到达一定数量后不再增加,或增加缓慢。原因可能是根瘤数目在一定空间达到饱和,或者所产生根瘤已帮助宿主获得足够氮源从而抑制了新的根瘤产生。
Frankia菌侵染木麻黄是从根毛开始的,通过化学的信号传导造成根毛变形然后进入表皮和皮层细胞[17-19]。但在本研究中,因木麻黄产生的根毛稀少且在根表生长不连续,未观察到有明显的根毛变形现象,究其原因也可能是本研究以3 d为固定时间间隔取样错过根毛变形观察的最佳时期。Valverde和Wall[20]也通过定期制作超薄切片对Frankia-Discaria trinervis的结瘤进行了监测,但其结瘤的进程提前于我们的研究结果。这或许暗示Frankia菌与不同的寄主结瘤的时间程序不同,除了寄主的因素外,菌株的结瘤特性,土壤的质地、肥力条件可能都将是影响结瘤进程的因素,有待进一步研究。我们的研究发现,在Frankia菌还在木麻黄根部皮层细胞侵染繁殖时,内部中柱鞘就受到刺激开始定向地快速分裂,最终形成根瘤原基,与前人的研究具有一致性。据此可推测,在Frankia菌与宿主的共生关系中存在着某种信号转导,但至今对于信号转导的机制没有相关报道,这将是Frankia菌结瘤的另一研究热点。
[1]BAKER D D,MULLIN B C.Actinorhizal symbioses [G]//STACEY G,BURNS R H,EVANS H J.Biological Nitrogen Fixation.New York∶Academic Press,1992∶259 - 292.
[2]LECHEVALIER M P.Taxonomy of the genus Frankia(Actinomycetales)[J].Inter J System Bacter,1994,44∶1 - 8.
[3]LALONDE M,CALVERTH E,PINE S.Isolation and use of Frankia strains in actinorhizae formation[G]//GIBSON A H,NEWTON W E.Current Perspectives in Nitrogen Fixation.Canberra∶Australian Academy of Science,1981:296-299.
[4]LECHVALIER M P,BAKER D,HORRIERE F.Physiology,chemistry,serology and infectivity of two Frankia isolates from Alnus incana subsp.rugosa [J].Can J Bot,1983,61∶2826 - 2833.
[5]吴建峰,林先贵.土壤微生物在促进植物生长方面的作用 [J].土壤,2003,35(1):18-21.WU Jianfeng,LIN Xiangui.Growth promoting function of soil microorganisms on plants [J].Soil,2003,35(1)∶18-21.
[6]HILGER A B,MYROLD D D.Method for extraction of Frankia DNA from soil[J].Agri Ecosyst&Environ,1991,34(1/4)∶107 - 113.
[7]OAKLEY B,NORTH M,FRANKLIN J F,et al.Diversity and distribution of Frankia strains symbiotic with Ceanothus in California [J].Appl Environ Microbiol,2004,70(11)∶6444 - 6452.
[8]CLAWSONA M L,BOURRET A,BENSONA D R.Assessing the phylogeny of Frankia-actinorhizal plant nitrogen-fixing root nodule symbioses with Frankia 16S rRNA and glutamine synthetase gene sequences [J].Mole Phylogen Evol,2004,31:131 - 138.
[9]OUREYE M,SAGNA M,DIEDHIOU S,et al.Devising an in vitro nodulation system for two actinorhizal plants∶Allocasuarina verticillata (LAM.) L.Joneson and Casuarina glauca Sibe.ex Spreing (Casuarinaceae) [J].In Vitro Cell Bio Plant,2003,39∶545 - 550.
[10]MCEWAN N R.Autofluorescence as a diagnostic tool for the infection of alder by Frankia[J].Sci Soil,2000,5∶3-8.
[11]LIU Qinqin,BERRY A M.The infection process and nodule initiation in the Frankia-Ceanothus root nodule symbiosis [J].Protoplasma,1991,163∶82 - 92.
[12]张小民,王岚,林美珍,等.论沙棘根系与功能——Frankia菌侵染和结瘤[J].沙棘,2006,19(1):1-10.ZHANG Xiaomin,WANG Lan,LIN Meizhen,et al.Disscussion on roots and function of Hippophae rhamnoides L.:Infection and nodulation of Frankia [J].Hippophae Rhamnoides,2006,19(1)∶1 - 10.
[13]ZHANG Xin,SHEN Aihua,WANG Qiuqin,et al.Identification and nitrogen fixation effects of symbiotic Frankia isolated from Casuarina spp.in Zhejiang,China [J].Afric J Biotech,2012,11(17)∶4022 - 4029.
[14]张昕,马新颖,王秋芹,等.浙江省木麻黄共生固氮菌Frankia的分离鉴定及固氮效应[J].生态学杂志,2011,30(9):126 - 131.ZHANG Xin,MA Xinyin,WANG Qiuqin,et al.Identification and nitrogen fixation effects of symbiotic Frankia isolated from Casuarina spp.in Zhejiang [J].J Ecol,2011,30(9):126 - 131.
[15]BENSON D R,SILVESTER W B.Biology of Frankia strains actinomycete symbionts of actinorhizal plants [J].Micro Rev,1993,57∶293 - 319.
[16]刘强,张亚辉.海口地区木麻黄林根瘤调查及影响结瘤的因子探讨[J].林业科学,2002,38(5):175-180.LIU Qiang,ZHANG Yahui.Invertigation of root nodules and disscussion of the factors which affect nodulation in Casuarina equsetifolia plantations in Haikou [J].Sci Silv Sin,2002,38(5):175 - 180.
[17]CALLAHAM D,TREDIC P D,TORREY J D.Isolation and cultivation in vitro of the actinomycete causing root nodulation incomptonia [J].Science,1978,199∶899 - 902.
[18]BERRY A M.The actinorhizal infection process∶review of recent research[G]//KLUSG M,REDDY C.Current perspectives in Microbial Ecology.Washington D C∶American Society of Microbiology,1984∶222 - 229.
[19]OBERTELLO M,OUREYE M,LAURENT L,et al.Actinorhizal nitrogen fixing nodules∶infection process,molecular biology and genomics [J].Afric J Biotech,2003,2(12)∶528 - 538.
[20]VALVERDE C,WALL L G.Time course of nodule development in the Discaria trinervis(Rhamnaceae)-Frankia symbiosis [J].New Phytol,1999,141∶345 - 354.
