温度和食物密度对裂足臂尾轮虫(Brachionus diversicornis)生命表统计学参数的影响*
2013-05-28宁乐锋席贻龙
宁乐锋,席贻龙,孙 强,周 澳
(安徽师范大学生命科学学院,安徽省高校生物环境与生态安全省级重点实验室,芜湖 241000)
温度和食物密度是影响轮虫生活史特征的两个重要的生态因子[1].有关温度或食物密度对轮虫存活、生殖和种群增长等的影响研究,已有较多的报道;在自然水体中,温度和食物密度通常是同时起作用的.因此,研究温度和食物密度对轮虫生活史特征的复合作用具有重要意义.遗憾的是,有关上述两个生态因子复合作用的研究则相对较少[2-4].已有的研究结果表明,温度和食物密度以及两者间的交互作用对轮虫生命表统计学参数的影响常因轮虫种类的不同而异[2,4].
裂足臂尾轮虫是典型的、栖息于浅水湖泊和池塘中的浮游性轮虫.马杰等[5]曾分别就温度和藻类食物密度对不等棘刺型和等棘刺型裂足臂尾轮虫的生活史特征和后代形态型的影响进行研究;但有关温度和食物密度对该种轮虫生命表统计学参数的复合作用研究至今未见报道.因此,本文运用单个体培养方法,研究了温度和食物密度对裂足臂尾轮虫生命表统计学参数的影响.
1 材料与方法
1.1 轮虫的来源
实验所用裂足臂尾轮虫于2010年8月中旬采自芜湖市汀棠湖.采样后,随机挑取轮虫非混交雌体(忽略形态型的区分),于25 ±1℃、自然光照(光照强度约130 lx)条件下进行克隆培养.轮虫培养液采用Gilbert配方[6](pH=7.3),所用的饵料为HB-4 培养基[7]培养的、处于指数增长期的斜生栅藻.
1.2 轮虫的预培养
实验前,将裂足臂尾轮虫分别置于温度为 15、20、25 和 30℃,斜生栅藻密度为 1.0×106、3.0×106和5.0×106cells/ml 的条件下进行为期1 周的预培养.预培养过程中,每12 h 悬浮沉积于试管底部的藻类食物;每24 h 更换轮虫培养液并投喂饵料1 次,同时通过去除一部分个体使得轮虫种群始终处于指数增长期.
1.3 单个体培养实验
将携带非混交卵的轮虫单个培养于带凹穴的塑料板中,培养液体积为0.5 ml.之后,每间隔4 h 在解剖镜下检查轮虫卵的孵化情况,取刚孵化出的幼体开始实验.实验过程中,每间隔12 h 观察1 次(30℃下每8 h观察一次),记录轮虫所产的幼体数及母体的存活情况;并移出所产幼体,在相同的条件下继续培养待其产卵后确定雌体类型;每间隔24 h 更换1 次培养液并投喂藻类食物.每个温度和食物密度组合下使用轮虫个体15 个,实验设置4 个重复.实验条件与预培养时相同,实验至全部母体死亡为止.
1.4 生活史参数的定义和计算方法
生活史参数的定义和计算参照胡柯等的方法[8].
(1)特定年龄存活率:x年龄组开始时存活个体百分数,lx;
(2)特定年龄繁殖率:x年龄组平均每个个体所产的雌性后代数,mx=后代数/(母体数×24 h);
(3)出生时的生命期望:每个个体出生时能活多久的估计值;
(4)平均寿命:所有个体平均能活多久的观察值;
(5)总生殖率:每个个体一生所产的雌性后代数,G0=∑mx;
(6)净生殖率:种群经过一个世代后的净增长率,R0=∑lxmx;
(7)世代时间:完成一个世代所需要的时间,T=∑lxmxx/R0;
(8)种群内禀增长率:种群在特定试验条件下的最大增长率;根据方程r =lnR0/T 在粗略计算的基础上,再根据方程在Excel 中试算求得种群内禀增长率的精确值.
(9)后代混交率:所有雌性后代中混交雌体所占的比率.
1.5 数据的处理和分析
采用SPSS 统计分析软件对上述数据进行统计分析.对所得的各生活史参数进行正态分布检验后,对符合正态分布的数据进行方差分析以揭示温度、食物密度以及两者间的交互作用对轮虫各生命表统计学参数的影响,采用多重比较(SNK-q 检验法)对同一温度各食物密度间、同一食物密度下各温度间轮虫的各生活史参数的差异显著性进行分析,运用生存分析中的Kaplan-Meier 分析同一温度各食物密度间、同一食物密度下各温度间轮虫的生存时间的差异显著性.
2 结果与分析
2.1 轮虫的存活率和繁殖率
各食物密度下,轮虫的存活率均随着温度的升高而显著降低(P <0.01);但各温度下,食物密度对轮虫的存活时间无显著影响(P >0.05)(图1).各食物密度下,轮虫的繁殖率高峰值随着温度的升高而增大,但繁殖时间却逐渐缩短.各温度下,轮虫的繁殖率在3 个食物密度间无显著差异(P >0.05)(图1).
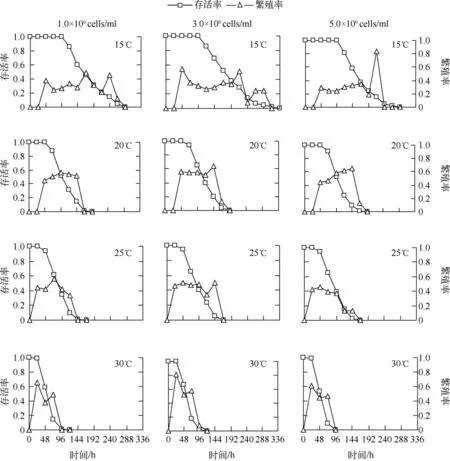
图1 不同温度和食物密度下裂足臂尾轮虫的存活率和繁殖率Fig.1 Survivorship and fecundity of B.diversicornis cultured under four temperatures and three food levels
2.2 轮虫的生命表统计学参数
双因素方差分析结果表明,温度对轮虫出生时的生命期望、世代时间、净生殖率和总生殖率均有显著影响(P <0.05),但对种群内禀增长率和后代混交率无显著影响(P >0.05);食物密度对轮虫的净生殖率和总生殖率均有显著影响(P <0.05),但对轮虫出生时的生命期望、世代时间、种群内禀增长率和后代混交率均无显著影响(P >0.05);食物密度与温度之间的交互作用对轮虫出生时的生命期望、世代时间、净生殖率、总生殖率、种群内禀增长率和后代混交率均无显著影响(P >0.05).多重比较结果显示,轮虫出生时的生命期望和世代时间均随着温度的升高而逐渐显著缩短.轮虫的净生殖率在15℃下最低,30℃下最高,20、25℃间无显著差异;轮虫的总生殖率在15℃下较低,20、25 和30℃下较高且三者间无显著差异;轮虫的净生殖率和总生殖率均在3.0×106cells/ml 食物密度下较高,1.0×106和5.0×106cells/ml 食物密度下较低且两者间无显著差异(表1).
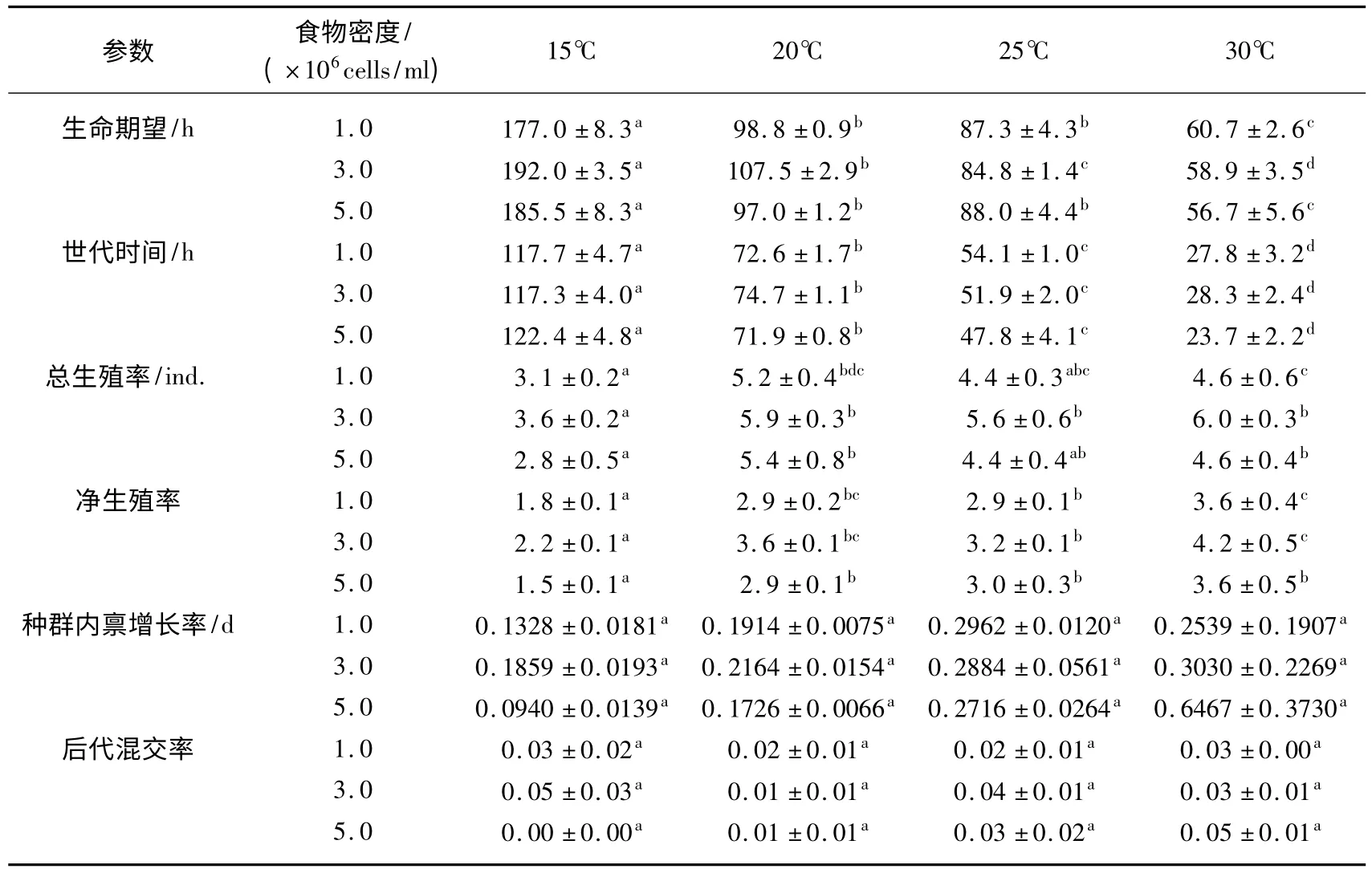
表1 不同温度和食物密度下裂足臂尾轮虫的生命表统计学参数*Tab.1 Life demographic parameters of B.diversicornis cultured under four temperatures and three food levels
回归分析显示,3 个食物密度下轮虫出生时的生命期望、世代时间、平均寿命和净生殖率以及3.0×106cells/ml食物密度下的总生殖率与温度间显著相关(表2).
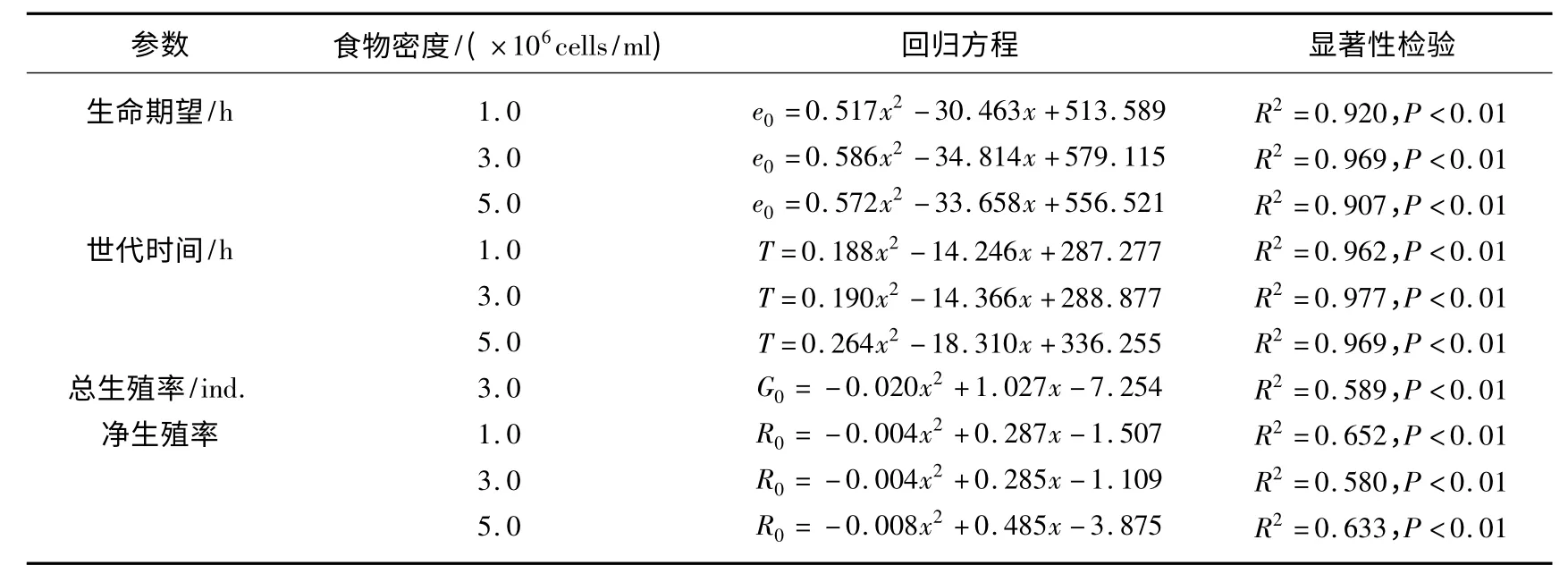
表2 3 个食物密度下裂足臂尾轮虫出生时的生命期望、世代时间、总生殖率和净生殖率与温度的关系Tab.2 Relationships between life expectancy at hatching,generation time,gross reproductive and net reproductive rate of B.diversicornis cultured under three food levels and four temperatures (n=4)
3 讨论
3.1 温度和食物密度对轮虫存活和发育的影响
25℃下,较高或较低的食物密度均显著缩短萼花臂尾轮虫(B.calyciflorus)的平均寿命和世代时间[9];25℃下,变形臂尾轮虫(B.variabilis)的平均寿命和出生时的生命期望均在1.0×106cells/ml 的小球藻(Chlorella vulgaris)密度下最长,高于或低于该密度则显著缩短;世代时间在0.5×106cells/ml 的小球藻密度下最长,高于或低于该密度也显著缩短[10];22℃下,食物密度对方形臂尾轮虫(B.quadridentatus)的平均寿命无显著影响,但较高(>8.0×106cells/ml)或较低(<1.0×106cells/ml)的食物密度均使其世代时间显著延长[11];而22℃下,斜生栅藻密度对两种形态型裂足臂尾轮虫出生时的生命期望和世代时间均无显著的影响[5].本研究结果表明,15、25 和30℃下,食物密度对裂足臂尾轮虫出生时的生命期望均无显著的影响;但20℃下,裂足臂尾轮虫出生时的生命期望在3.0×106cells/ml 下较长,在1.0×106和5.0×106cells/ml 下较短.各温度下,食物密度对裂足臂尾轮虫的世代时间均无显著的影响.可见,食物密度对轮虫存活和发育的影响常因轮虫种类和温度的不同而异.
在所研究的食物密度下,十指臂尾轮虫(B.patulus)和哈瓦那臂尾轮虫(B.havanaensis)孵化时的生命期望和世代时间均随着温度的升高而逐渐显著缩短[2,4].与其不尽相同的是,尽管在1.0×106和10.0×106cells/ml 的微绿球藻(Nannochloris oculata)密度下,月形腔轮虫(Lecane luna)和四齿腔轮虫(L.quadridentata)的平均寿命和世代时间均随着温度的升高而逐渐显著缩短;但在5.0×106cells/ml 的微绿球藻密度下,两种轮虫的平均寿命和世代时间均在20 和25℃之间无显著差异[3].本研究中,尽管在3.0×106cells/ml 的斜生栅藻密度下裂足臂尾轮虫出生时的生命期望以及3 个食物密度下轮虫的世代时间均随着温度的升高而逐渐显著地缩短;但在1.0×106和5.0×106cells/ml 的斜生栅藻密度下其出生时的生命期望均在15℃下最长,30℃下最短,而20 和25℃间无显著差异.由此可见,尽管轮虫的存活和发育时间总体上随着温度的升高而缩短,但它们对逐步升高的温度的反应却因轮虫种类和食物密度的不同而异.
3.2 温度和食物密度对轮虫生殖的影响
25℃下,萼花臂尾轮虫的净生殖率在3.0×106cells/ml 的小球藻密度下最高,高于或低于该密度则显著降低[9];25℃下,变形臂尾轮虫的净生殖率在1.0×106cells/ml 的小球藻密度下最高,高于或低于该密度则显著降低[10];22℃下,方形臂尾轮虫的净生殖率在2.0×106~8.0×106cells/ml 的小球藻密度范围内较高,低于或高于该密度范围则显著降低[11].22℃下,斜生栅藻密度对不等棘刺型裂足臂尾轮虫的净生殖率无显著影响,但对等棘刺型裂足臂尾轮虫的净生殖率有显著影响;等棘刺型轮虫的净生殖率在6.0×106cells/ml食物密度下显著小于0.75×106和3.0×106cells/ml 食物密度下,1.5×106cells/ml 食物密度下与上述3 种食物密度间均无显著差异[5].本研究结果表明,15 和20℃下,裂足臂尾轮虫的净生殖率均在3.0×106cells/ml 下较高,1.0×106和5.0×106cells/ml 下较低且两者间无显著差异;但在25 和30℃下,食物密度对裂足臂尾轮虫的净生殖率均无显著影响.
Fanestil 等[12]和Meadow 等[13]认为,理论上,变温动物的净生殖率应该不随着温度的变化而发生显著变化.但事实上,十指臂尾轮虫、哈瓦那臂尾轮虫、月形腔轮虫、四齿腔轮虫、壶状臂尾轮虫(B.urceolaris)、红臂尾轮虫(B.rubens)、剪形臂尾轮虫(B.forcatus)、尾突臂尾轮虫(B.caudatus)以及萼花臂尾轮虫的3 个姐妹种等的净生殖率均受温度的显著影响[2-4,14-16].本研究结果表明,3 个食物密度下,温度对裂足臂尾轮虫的净生殖率均有显著影响;但裂足臂尾轮虫的净生殖率对温度升高的响应因食物密度的不同而存在差异.在1.0×106和3.0×106cells/ml 的斜生栅藻密度下,裂足臂尾轮虫在20℃下的净生殖率与25 和30℃下的净生殖率无显著差异;但在5.0×106cells/ml 的斜生栅藻密度下,裂足臂尾轮虫在20、25 和30℃下的净生殖率无显著差异.
由上述结果可知,轮虫的生殖常受温度和食物密度的显著影响.本研究中,双因素方差分析结果也证实了上述结论.
3.3 温度和食物密度对轮虫种群增长的影响
25℃下,萼花臂尾轮虫的种群内禀增长率在3.0×106cells/ml 的小球藻密度下最高,高于或低于该密度则显著降低[9];25℃下,变形臂尾轮虫的种群内禀增长率在1.0×106cells/ml 的小球藻密度下最高,高于或低于该密度则显著降低[10];22℃下,方形臂尾轮虫的种群内禀增长率在2.0×106~8.0×106cells/ml 的小球藻密度范围内较高,低于或高于该密度范围则显著降低[11].22℃下,斜生栅藻密度对不等棘刺型裂足臂尾轮虫的种群内禀增长率无显著影响,但对等棘刺型裂足臂尾轮虫的种群内禀增长率有显著的影响;种群内禀增长率在6.0×106cells/ml 食物密度下显著小于3.0×106cells/ml 食物密度下,但两者均与 0.75×106和1.5×106cells/ml 食物密度下无显著的差异[5].本研究结果表明,15 和 20℃下,3.0×106cells/ml 下裂足臂尾轮虫的种群内禀增长率均显著高于5.0×106cells/ml 下,但两者均与1.0×106cells/ml 下的种群内禀增长率间无显著差异;25 和30℃下,食物密度对裂足臂尾轮虫的种群内禀增长率均无显著影响.
种群内禀增长率综合了特定年龄存活率和繁殖率、首次生殖年龄和生殖间隔等,因此,温度常对其具有显著的影响[2,4,14-16].已有的结果表明,种群内禀增长率对温度升高的反应因轮虫种类的不同而异.哈瓦那臂尾轮虫、壶状臂尾轮虫、红臂尾轮虫、剪形臂尾轮虫和尾突臂尾轮虫的种群内禀增长率均随着温度的升高而显著升高[4,14-15];但萼花臂尾轮虫种复合体内姐妹种LE9 的种群内禀增长率在28℃下最高,13 和18℃下最低且两者间无显著差异;姐妹种HE1 的种群内禀增长率在13、18 和28℃间无显著差异;姐妹种HE3 的种群内禀增长率在23 和28℃下最高且两者间无显著差异[16].与上述研究结果不同,本研究中,3 个食物密度下,温度对裂足臂尾轮虫的种群内禀增长率均无显著的影响.在较高温度(30℃)下,裂足臂尾轮虫个体间在存活和生殖等方面的较大差异所导致的种群内禀增长率的较大差异,这可能是其种群内禀增长率对变化的温度无敏感反应的重要原因.
上述结果表明,轮虫种群增长所需的最适温度和食物密度常因轮虫种类的不同而异.
3.4 温度和食物密度及其交互作用对轮虫生命表统计学参数的影响
温度、食物密度以及两者间的交互作用对十指臂尾轮虫的平均寿命、出生时的生命期望、世代时间、总生殖率、净生殖率和种群内禀增长率均有显著的影响[2].温度和食物密度均对哈瓦那臂尾轮虫的所有生命表统计学参数有显著的影响,但温度和食物密度间的交互作用对其却无显著的影响[4].与上述研究结果不同,本研究中,温度仅对裂足臂尾轮虫出生时的生命期望、世代时间、净生殖率和总生殖率有显著影响,食物密度仅对轮虫的净生殖率和总生殖率有显著影响,而食物密度与温度之间的交互作用对轮虫所有的生命表统计学参数均无显著影响.可见,温度、食物密度以及两者间的交互作用对轮虫生命表统计学参数的影响因种类不同而异.
3.5 温度和食物密度对轮虫后代混交率的影响
混交雌体产生是休眠卵形成的前提条件,受一些内源性和外源性因素的调节[17-23].22℃下,斜生栅藻密度对不等棘刺型和等棘刺型裂足臂尾轮虫的后代混交率均无显著影响[5].本研究结果表明,3 种食物密度下,温度对裂足臂尾轮虫的后代混交率均无显著影响;各温度下,食物密度对其也均无显著影响.裂足臂尾轮虫较低的后代混交率可能是其后代混交率对温度和食物密度的变化无敏感反应的主要原因.
[1]Edmondson WT.Reproductive rate of planktonic rotifers as related to food and temperature.Ecological Monographs,1965,35:61-111.
[2]Sarma SSS,Rao TR.The combined effects of food and temperature on the life history parameters of Brachionus patulus Müller (Rotifera).International Review of Hydrobiology,1991,76:225-239.
[3]Pérez-Legaspi IA,Rico-Martínez R.Effect of temperature and food concentration in two species of littoral rotifers.Hydrobiologia,1998,387/388:341-348.
[4]Pavón-Meza EL,Sarma SSS,Nandini S.Combined effects of algal (Chlorella vulgaris)food level and temperature on the demography of Brachionus havanaensis (Rotifera):a life table study.Hydrobiologia,2005,546:353-360.
[5]马 杰,席贻龙,许丹丹等.温度和食物密度对两种形态型裂足臂尾轮虫生活史特征和后代形态型的影响.湖泊科学,2011,23(4):597-604.
[6]Gilbert JJ.Mictic female production in the rotifer Brachionus calyciflorus.Journal of Experimental Zoology,1963,153:113-124.
[7]黎尚豪,朱 蕙,夏宜铮等.单细胞绿藻的大量培养实验.水生生物学集刊,1959,4:462-472.
[8]胡 柯,席贻龙,王金霞.不同地理区域湖泊中萼花臂尾轮虫的生活史特征.湖泊科学,2010,22(4):585-590.
[9]席贻龙,黄祥飞.食物种类和浓度对壶状臂尾轮虫实验种群动态的影响.水生生物学报,1999,23(3):227-234.
[10]Sarma SSS,Nandini S.Life table demography and population growth of Brachionus variabilis Hempel,1896 in relation to Chlorella vulgaris densities.Hydrobiologia,2001,446/447:75-83.
[11]马 蕊,牛翠娟,鲍 蕾等.食物浓度对方形臂尾轮虫发育历期与实验种群增长参数的影响.动物学报,2004,50(5):753-758.
[12]Fanestil DD,Barrows CH.Aging in the rotifer.Journal of Gerontology,1965,20(4):462-469.
[13]Maedow ND,Barrows CH.Studies on aging in a bdelloid rotifer.II.The effects of various environmental conditions and maternal age on longevity and fecundity.Journal of Gerontology,1971,26:302-309.
[14]胡存兵,席贻龙,陶李祥.红臂尾轮虫和壶状臂尾轮虫生活史特征比较.生态学报,2008,28(12):5957-5963.
[15]陶李祥,席贻龙,胡存兵.镰形臂尾轮虫和尾突臂尾轮虫生活史特征的比较研究.应用生态学报,2008,19(5):1104-1109.
[16]李化炳,席贻龙,程新峰.萼花臂尾轮虫(Brachionus calyciflorus)种复合体内三个姐妹种生活史特征比较.生态学报,2009,29(2):581-588.
[17]Gilbert JJ.Population density,sexual reproduction and diapause in monogonont rotifers:new data for Brachionus and a review.Journal of Limnology,2004,63(Suppl.1):32-36.
[18]Xi YL,Dong LL,Ge YL et al.Resting egg production of Brachionus calyciflorus (Rotifera)at different water temperatures.Journal of Freshwater Ecology,2004,19:567-573.
[19]Stelzer CP,Snell TW.Specificity of the crowding response in the Brachionus plicatilis species complex.Limnology and Oceanography,2006,51:125-130.
[20]Timmeremeyer N,Stelzer CP.Chemical induction of mixis in the rotifer Synchaeta tremula.Journal of Plankton Research,2006,28:1233-1239.
[21]Fussmann GF,Gregory K.Incomplete induction of mixis in Brachionus calyciflorus:patterns of reproduction at the individual level.Hydrobiologia,2007,593:111-119.
[22]Gilbert JJ,Schröder T.Intraclonal variation in propensity for mixis in several rotifers:variation among females and with maternal age.Hydrobiologia,2007,593:121-128.
[23]Ma Q,Xi YL,Zhang JY et al.Differences in life table demography among eight geographic populations of Brachionus calyciflorus (Rotifera)from China.Limnologica,2010,40:16-22.
