不同水生植物对富营养化水体无机氮吸收动力学特征*
2013-05-28张贵龙赵建宁刘红梅吴钰明杨殿林
张贵龙,赵建宁,刘红梅,秦 伟,吴钰明,杨殿林
(1:农业部环境保护科研监测所,天津 300191)
(2:苏州市农业委员会,苏州 215128)
(3:苏州市相城区虞河蔬菜产销专业合作社,苏州 215155)
水生植物具有发达的通气组织,能够在水中完成对氮素的吸收、转化和富集,可有效去除水体中的氮素养分.研究和揭示水生植物的氮素营养盐吸收特性,对于筛选氮高效吸附植物品种,实现水体的生态净化具有积极意义.水生植物去除氮素的机理主要包括吸收同化、微生物降解、微环境的硝化和反硝化作用等,其中,依靠植物体直接吸收利用被认为是氮素去除的重要机制,研究表明单位面积(1 m2)垂花水竹芋(Thalia dealbata)一个生长季节可吸收60.9 g 氮[1],水罂粟、黄花水龙和大聚藻等[2]水生植物对水质氮的去除率达36.3% ~91.8%,氮的吸收贡献率分别占水质氮去除率的46.3% ~77.3%.植株对氮素的吸收能力与氮素形态、植物遗传特性、生长季节及水体氮负荷等有关,另有研究发现水葱(Schoenopl ectus validus)对NH4+-N最大吸收速率(623 mmol/(g(DW)·h))显著高于对NO3--N 的最大吸收速率(338 mmol/(g(DW)·h))[3].凤眼莲对NO3--N、NH4+-N 的吸收速率显著高于狐尾藻,凤眼莲对NO3--N 有较高的Imax(最大吸收速率)值和亲和力,而狐尾藻对NH4+-N 有较高的 Imax值和亲和力[4].雷泽湘等[5]研究发现荇菜 5月份(Nymphoides peltatum)N 含量为14.363 mg/g,9月份 N 含量为17.245 mg/g,且沉水和浮叶植物 N、P 含量与水体 N、P 浓度显著相关.
植物离子吸收动力学的发展为分析和阐明植物对营养物质吸收特性提供了量化参数,普遍认为离子主动吸收符合米氏(Michaelis-Menten)动力学方程:V=VmaxS/(Km+S),Vmax为载体饱和时最大吸收速率,与载体的数目和载体的运转效率有关,Km是吸收速率为1/2 Vmax时外界离子浓度,取决于载体的特性与外液离子浓度([S])无关,1/Km表征吸收系统的亲合力,Km值小,说明根系吸收系统对该离子的亲合能力大.当[S]<0.01Km时,吸收速率与外液离子浓度成正比,反应为一级反应.当[S]>100Km时,吸收速度与外液离子浓度无关,反应为零级反应.当0.01Km<[S]<100Km时,反应处于零级反应和一级反应之间,为混合级反应.目前应用米氏方程解释植物对介质中离子吸收动态过程的研究见于水稻[6]、小麦[7]、烤烟[8]等作物,针对水生植物的研究也有所报道,但在富营养化水质净化中对植物氮素吸收特点要求存在多面性,尤其是水体中氮负荷和形态不同时,需要对更多植物进行氮素吸收特征研究,以便丰富适宜生态净化工程的植物品种.本研究以苏南太湖流域新引进的水生植物鸢尾及常见水生植物狐尾藻、茭白和水芹为对象,监测4 种水生植物的氮素吸收动力学参数,比较其对不同态氮素养分吸收特性,以期进一步探索水生植物的氮素吸收利用机制,为筛选高效水质生态净化的植物品种提供理论依据.
1 材料与方法
1.1 试验材料
2011年6月在苏州市相城区望亭镇新埂村水生植物圃选取植株长势一致(新鲜营养体的质量数相等)的鸢尾(Iris louisiana)、狐尾藻(Myriophyllum verticillatum)、茭白(Zizania latifolia)和水芹(Oenanthe clecumbens)健壮幼苗,用去离子水清洗后,将幼苗在Hogland 营养液中培养15 d,人工气候室条件为:每天光照10 h,光强5000 lx,温度25℃,相对湿度70%.每3 d 更换一次营养液,间歇通气20 min/h.每天用pH 计测定营养液pH 值,用0.1 mol/L NaOH 溶液或0.1 mol/L HCl 溶液调节营养液pH 值至7.0.试验前将植物用去离子水冲洗干净,转入0.1 mmol/L 的硫酸钙溶液中,预培养24 h,以排除自由空间中残留氮素的影响.
1.2 试验方法
吸收动力学试验采用浓度梯度法[7],以0.1 mmol/L 的硫酸钙为支持液,配制铵态氮(NH4+-N)、硝态氮(NO3--N)浓度系列分别为 0.05、0.10、0.25、0.50、0.75、1.00、1.25、1.50、2.00 mmol/L 的溶液,重复 3 次,吸取不同浓度的含氮溶液800 ml,置于1000 ml 的容器中,加入氨苄青霉素钠(C16H18NaN3O4S)100 mg/L 抑制微生物,然后分别放入吸干表面附着水分的4 种水生植物(鸢尾、茭白和水芹各3 株,狐尾藻需称取与前3种植物相同质量的营养体),调节pH 值为7.0.在1.1 所述人工气候室中进行吸收试验,持续6 h,立即取出植株,分别测定植株鲜重和干重.用连续流动分析仪(AutoAnalyzer3)测定营养液中的NH4+-N、NO3--N 的含量,根据吸收前后N 浓度的变化量,计算单位干质量在单位时间内的N 净吸收速率.
1.3 数据处理
采用Michaelis-Menten 动力学方程的作图法[6]处理数据,求出吸收动力学参数Vmax(最大吸收速率)和Km(表观米氏常数).试验数据处理和图表制作均用Excel 软件.多重比较采用新复极差法(Duncan 法)[9].
2 结果与分析
2.1 水生植物对水体NO3--N吸收动力学特征
4 种水生植物对不同浓度氮溶液中NO3--N 的吸收曲线符合Michaelis-Menten 酶动力学方程(图1),且吸收曲线变化趋势类似,随溶液中NO3--N 浓度增加,植物对NO3--N 吸收速率升高,当溶液中NO3--N 浓度低于1.5 mmol/L 时,植株吸收速率上升的较快,当NO3--N 浓度接近于2.0 mmol/L,吸收速率趋缓.通过作图法得到4 种水生植物对NO3--N 吸收的最大速率(Vmax)和米氏常数(Km)(表1),不同植物Vmax值差异显著(P <0.05),Vmax值大小顺序为水芹>茭白>鸢尾>狐尾藻,其中水芹的Vmax值分别是茭白、鸢尾和狐尾藻的2.48、9.33、27.91 倍,说明水芹对 NO3--N 吸收潜力最大.水芹的Km值分别显著高于茭白、鸢尾和狐尾藻,茭白、鸢尾和狐尾藻Km值无显著差异,说明茭白、鸢尾和狐尾藻对NO3--N 的亲和力高于水芹,较适合于低NO3--N 浓度水体.4 种水生植物Km值变化范围为0.69 ~1.61 mmol/L,经计算溶液NO3--N 浓度处于0.01Km和100Km之间,由此判断吸收反应为既有零级也有一级的混合级反应.

图1 水生植物吸收NO 3--N 动力学曲线Fig.1 Kinetics curve of NO 3--N uptake of hydrophytes
2.2 水生植物对水体NH4+-N的吸收动力学特征
随溶液NH4+-N 浓度增加,水生植物NH4+-N 吸收速率逐渐增加,总体变化趋势与NO3--N 相似,即在溶液NH4+-N 浓度低于1.5 mmol/L 时,吸收速率显著增加,当NH4+-N 浓度接近于2.0 mmol/L,对NH4+-N 吸收趋于饱和,当NH4+-N 浓度到1.5 mmol/L 时鸢尾的吸收速率最大(图2).4 种水生植物对NH4+-N 吸收曲线均可由Michaelis-Menten 酶动力学方程描述,NH4+-N 吸收动力学参数如表2,4 种水生植物Vmax值差异显著,水芹Vmax值最大,其次是茭白,狐尾藻的Vmax值最小,说明水芹较其他3 种水生植物对NH4+-N 吸收潜力大;Km值大小顺序为水芹>狐尾藻>茭白>鸢尾,但茭白和鸢尾的Km没有达到统计学上的显著差异(P >0.05),说明茭白和鸢尾对水体NH4+-N 亲和力较高.根据4 种水生植物Km与溶液NH4+-N 浓度梯度判断,系统吸收反应处于零级和一级之间,为混合级反应.

表1 水生植物吸收NO 3--N 动力学参数Tab.1 Kinetics parameters of NO 3--N uptake of hydrophytes
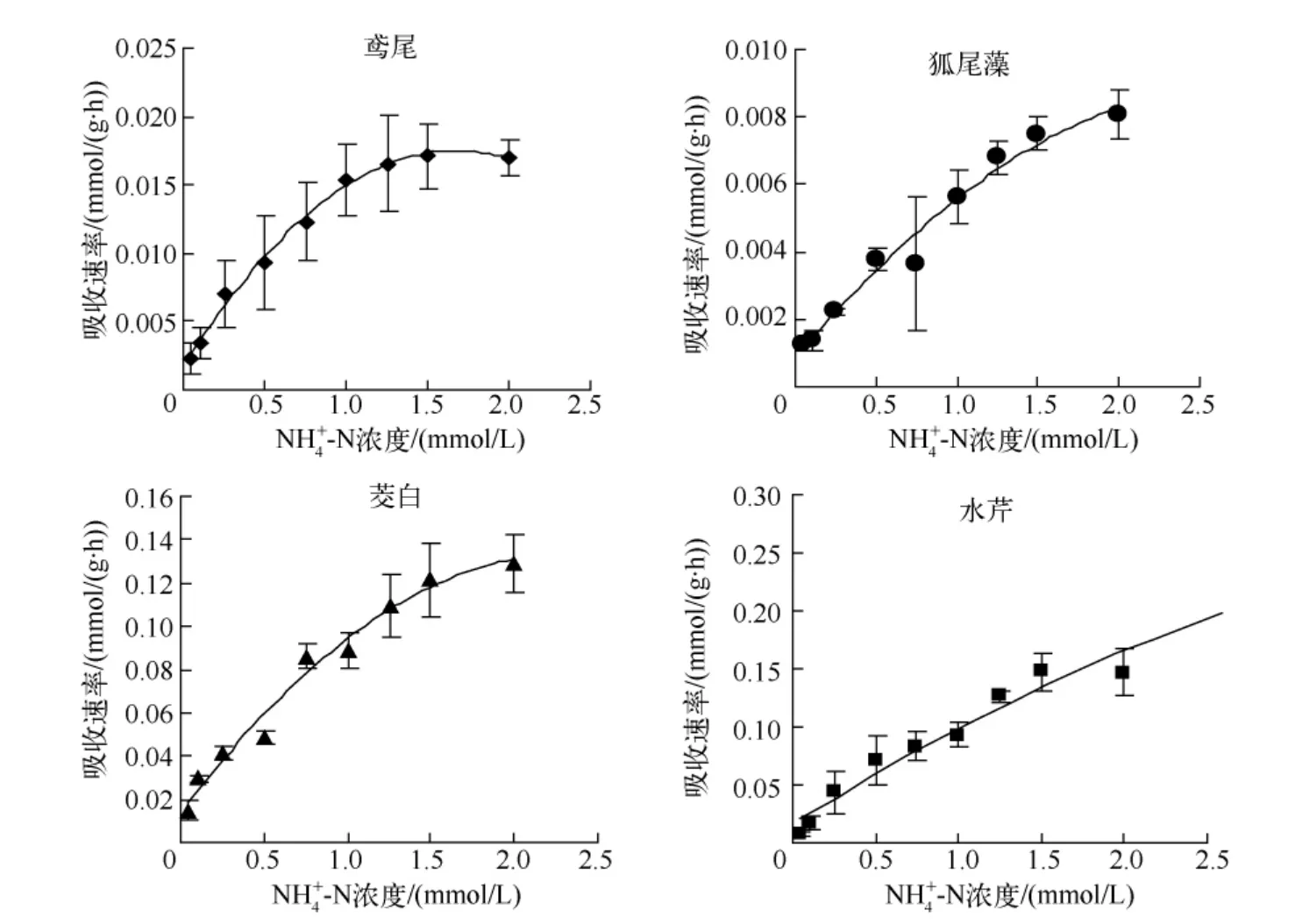
图2 水生植物吸收NH +4-N 动力学曲线Fig.2 Kinetics curve of NH +4-N uptake of hydrophytes

表2 水生植物吸收NH +4-N 动力学参数Tab.2 Kinetics parameters of NH +4-N uptake of hydrophytes
2.3 水生植物对不同态氮素的吸收特征分析
通过比较4 种水生植物的NO3--N和NH4+-N 吸收动力学参数可以看出(表 3),鸢尾的 NO3--N Vmax值和 Km值分别是 NH4+-N 的 1.413、1.550 倍,表明鸢尾对 NO3--N 吸收潜力大于对NH4+-N 的吸收,但植株对NH4+-N 的亲和力要大于NO3--N,说明在 NO3--N 浓度较高环境中鸢尾更偏好于吸收NH4+-N.狐尾藻和水芹对 NO3--N 和NH4+-N 的吸收动力学参数彼此之间无显著差异,暗示对水体NO3--N 和NH4+-N 均衡吸收,无明显偏好.茭白吸收NH4+-N 的Vmax值显著大于吸收NO3--N 的Vmax值,而Km值恰好相反,表明茭白对NH4+-N 具有较高吸收潜力,且亲和力较强,更利于水体NH4+-N的吸附.

表3 水生植物吸收NO 3--N 和NH 4+-N 动力学参数的比值Tab.3 The ratio of kinetics parameters of NO 3--N and NH 4+-N uptake of hydrophytes
3 讨论
植物体内NO3--N 和NH4+-N 运输系统存在高亲和、低亲和以及双亲和等类型[10],这些系统与外界的NO3--N 和NH4+-N 浓度有关[11],且 NO3--N 和NH4+-N 转运体基因家族的表达显著受外界NO3--N 和NH4+-N调控[12],植株对 NO3--N 和NH4+-N 的吸收受最大吸收阀值限制,即当外界NO3--N 和NH4+-N 浓度超出最大吸收时,吸收趋于饱和[13-14].本文研究结果显示当溶液NO3--N 和NH4+-N 低于 1.5 mmol/L 时,4 种水生植物对NO3--N 和NH4+-N 吸收速率随溶液NO3--N 和NH4+-N 增加快速升高,当溶液NO3--N 和NH4+-N 接近或高于2.0 mmol/L 时,吸收速率增加幅度减小甚至停止增加,这与常会庆等[15]的研究结果相似.
不同水生植物对无机氮吸收的亲和力常数Km和最大吸收速率Vmax存在差异,在4 种参试的植物中,水芹吸收NO3--N 和NH4+-N 的Vmax值和Km最高,研究认为这种具有高Vmax和高Km特性的植物适于高浓度的养分条件[16].洪春来等[17]研究了水葫芦、菖蒲、空心菜和金鱼藻对水体无机氮的吸收特征,结果表明4 种植物对NH4+-N 的最大吸收速率(Vmax)大小顺序为水葫芦>空心菜>菖蒲>金鱼藻,对NO3--N 的最大吸收速率表现为水葫芦>空心菜>金鱼藻>菖蒲,而4 种植物对水体中氮吸收的Km呈现出与最大吸收速率相反的趋势,这种Km的变化趋势与本文研究结果不一致,这可能与植物所处环境[18]、根系发育程度[7]以及植物对营养吸收能力[19-20]不同有关,另外,Michaelis-Menten 方程数据处理方式的不同也可能给动力学参数的计算带来一定偏差[6].
Nishikawa 等[21]认为Vmax/ Km值较高的植物对氮素养分吸收竞争能力强,通常指示植物对NO3--N 和NH4+-N 吸收的偏好.张亚娟等[22]研究表明蕹菜对铵态氮的吸收速率和亲和力高于硝酸盐氮.周晓红等[23]研究表明空心菜对铵态氮的亲和力大于对硝态氮的亲和力(Km铵态氮<Km硝态氮),有优先吸收溶液铵态氮的趋势.本文研究认为鸢尾和茭白偏好于吸收NH4+-N,狐尾藻和水芹对NO3--N 和NH4+-N 能够实现均衡吸收.研究认为植物吸收NO3--N 存在高亲和吸收系统(HATS)和低亲和吸收系统(LATS)[24],对NH4+-N 吸收存在低亲和的非饱和吸收和高亲和的饱和吸收[25],其中吸收NO3--N 的HATS 可再分为诱导型和组成型,当环境中少量存在NO3--N 存在时,高亲和NO3--N 吸收行为主要由组成型来实现.当环境中大量存在NO3--N时,诱导型在较短时间内就可实现诱导吸收[26].Kaiser 等[27]研究表明 NH4+-N 只有一个 HATS,但这一系统是否可以被诱导仍需要深入研究.
吸收动力学研究认为,当溶液离子与细胞膜上运输载体的结合位点饱和或通道的流量达最大时,吸收速率接近Vmax.较低的Km值表明运输活性位点和被吸收离子的亲和性高,较高的Km值则表明运输活性位点和被吸收离子的亲和性低.从理论上讲,高Vmax、低Km利于高效率的吸收[28].需要说明的是,本文试验中的Vmax和Km值是在较短时间内和相对均一的溶液中获得的,与实际水体环境有一定差距,试验的结果只能在一定程度上反映4 种水生植物对NH4+-N 和NO3--N 的吸收特征.另外,植物对元素的吸收效率不单受动力学参数调控,植物根系形态、生物量、pH 值、温度等因素也显著影响植物对养分离子的吸收,因此,本研究中植物吸收氮的动力学特性参数(Vmax、Km)只能作为筛选目标植物的理论依据,实际应用仍需要系统性验证.
[1]Zhao FL,Xi S,Yang X et al.Purifying eutrophic river waters with integrated floating island systems.Ecological Engineering,2012,40:53-60.
[2]金树权,周金波,朱晓丽等.10 种水生植物的氮、磷吸收和水质净化能力比较研究.农业环境科学学报,2010,29(8):1571-1575.
[3]Zhenhua Z,Zed R,Kathy M.Kinetics of ammonium,nitrate and phosphorus uptake by Canna indica and Schoenoplectus validus.Aquatic Botany,2009,91:71-74.
[4]金春华,陆开宏,胡智勇等.粉绿狐尾藻和凤眼莲对不同形态氮吸收动力学研究.水生生物学报,2011,35(1):75-79.
[5]雷泽湘,徐德兰,谢贻发等.太湖水生植物氮磷与湖水和沉积物氮磷含量的关系.植物生态学报,2008,32(2):402-407.
[6]华海霞,梁永超,娄运生等.水稻硅吸收动力学参数固定方法的研究.植物营养与肥料学报,2006,12(3):358-362.
[7]汪晓丽,陶玥玥,盛海君等.硝态氮供应对小麦根系形态发育和氮吸收动力学的影响.麦类作物学报,2010,30(1):129-134.
[8]李中民,杨铁钊,段旺军等.不同基因型烟草苗期对硝态氮和铵态氮吸收动力学特征研究.江苏农业科学,2011,39(2):155-157.
[9]盖钧镒.试验统计方法.北京:中国农业出版社,2000:371.
[10]Forde BG,Clarkson DT.Nitrate and ammonium nutrition of plants:Physiological molecular perspectives.Adv Botl Res,1999,30:1-90.
[11]Aslam M,Travis R,Huffaker R.Comparative kinetics and reciprocal inhibition of nitrate and nitrite uptake in roots of uninduced and induced barley (Hordeum vulgare L.)seedlings.Plant Physiol,1992,99:1124-1133.
[12]Kronzucker HJ,Britto DT,Davenport RJ et al.Ammonium toxicity and the real cost of transport.Trends Plant Sci,2001,6:335-337.
[13]温珊珊,张寒野,何文辉等.真江蓠对氨氮去除效率与吸收动力学研究.水产学报,2008,32(5):794-803.
[14]包苑榆,钟 萍,韦桂峰等.基于15N 稳定同位素技术的斜生栅藻对硝氮和氨氮吸收研究.水生态学杂志,2011,32(3):16-20.
[15]常会庆,李 娜,徐晓峰.三种水生植物对不同形态氮素吸收动力学研究.生态环境,2008,17(2):511-514.
[16]Yao F,Sun JB,Tang CQ et al.Kinetics of ammonium,nitrate and phosphate uptake by candidate blants used in constructed wetlands.Procedia Environmental Sciences,2011,10:1854-1861.
[17]洪春来,王卫平,朱凤香等.不同湿地植物对污水中氮和磷的吸收动力学特性.浙江农业学报,2011,23(1):122-126.
[18]Brix H,Dyhr-Jensen K,Lorenzen B.Root-zone acidity and nitrogen source affects Typha latifolia L.growth and uptake kinetics of ammonium and nitrate.Journal of Experimental Botany,2002,53:2441-2450.
[19]万晓红,李旭东,王雨春等.不同水生植物对湿地无机氮素去除效果的模拟.湖泊科学,2008,20(3):327-333.
[20]Zhou XH,Wang GX,Yang F.Characteristics of growth,nutrient uptake,purification effect of Ipomoea aquatica,Lolium multiflorum,and Sorghum sudanense grown under different nitrogen levels.Desalination,2011,273:366-374.
[21]Nishikawa T,Tarutani K,Yamamoto T.Nitrate and phosphate uptake kinetics of the harmful diatom Coscinodiscus wailesii,a causative organism in the bleaching of aquacultured Porphyra thalli.Harmful Algae,2010,9(6):563-567.
[22]张亚娟,刘存歧,李洪波等.蕹菜对富营养化水体的氮磷去除及吸收动力学研究.环境工程学报,2011,5(5):1057-1061.
[23]周晓红,王国祥,杨飞等.空心菜对不同形态氮吸收动力学特性研究.水土保持研究,2008,15(5):84-87.
[24]Lee RB,Clarkson DT.Nitrogen-13 studies of nitrate fluxes in barley roots.I.Compartmental analysis from measurements of13N efflux.The EMBO Journal,1986,(5):1753-1767.
[25]Ullrich WR,Larsson M,Larsson CM et al.Ammonium uptake in Lemna gibba G1,related membrane potential changes,and inhibition of anion uptake.Plant Physiology,1984,61:369-376.
[26]Ninnemann O,Jauniaux JC,Frommer WB.Identification of a high affinity ammonium transporter from plants.The EMBO Journal,1994,13:3464-3471.
[27]Kaiser BN,Rawat SR,Siddiqi MY et al.Functional analysis of an Arabidopsis T-DNA“knockout”of the high affinity NH4+transporter At AM T11.Plant Physiology,2002,130:1263-1275.
[28]Jampeetong A,Brix H.Nitrogen nutrition of Salvinia natans:Effects of inorganic nitrogen form on growth,morphology,nitrate reductase activity and uptake kinetics of ammonium and nitrate.Aquatic Botany,2009,90:67-73.
