豚鼠肾小管上皮原代细胞的培养
2013-05-24孙玉竹刘迪文吴旧生
孙玉竹,刘迪文,吴旧生
(浙江大学动物科学学院,浙江大学实验动物中心,杭州 310058)
目前在分子生物学、免疫学和病理学等实验中,普遍采用各类细胞株作为试验载体,但由于细胞株部分基因已经变异或者缺失,因此变得和机体正常细胞的性状存在很大差异,而原代细胞比细胞株能更接近地反映机体正常细胞的生理状态。如果能克服原代细胞培养难度较大,纯化和传代较为困难的缺点,其应用前景将大为增加。相对其他啮齿类动物,豚鼠的生物学及遗传特性更接近于人类,是一种常用的实验动物。豚鼠肾小管上皮细胞是培养病毒、研发相关疫苗及免疫学和肾病研究等较理想的材料,然而目前有关豚鼠肾细胞培养的完整资料鲜有报道。因此本文探讨了有关豚鼠肾小管上皮原代细胞的培养技术,并成功建立了培养肾小管上皮原代细胞的实验方法。
1 材料方法
1.1 实验动物
出生一周以内的 Zmu-1:DHP品系豚鼠一只,3日龄,雄性,普通级,来自于浙江大学实验动物中心【SCXK(浙)2007-0030】,实验在浙江大学实验动物中心进行【SYXK(浙)2007-0099】。
1.2 主要试剂、器材及仪器
DMEM:F12(含1%双抗)细胞培养液,0.25%胰酶(Gibco),0.1%胶原酶,多聚赖氨酸(10×),胎牛血清(四季青),小鼠抗CK18抗体及同型小鼠血清(博士德),兔抗小鼠 FITC二抗(碧云天),灭菌PBS液;细胞培养板(12孔),筛网(100目和 150目),研磨器;离心机(Eppendorf),生物安全柜(Thermo),荧光倒置显微镜(Leica),普通光学显微镜(Olympus),CO2培养箱(Thermo)等。
1.3 肾小管节段的提取
豚鼠腹腔麻醉后股动脉放血处死,然后浸入酒精体外消毒,转移至生物安全柜中。无菌摘取豚鼠两侧肾脏,置于灭菌平皿内。生理盐水洗涤2次,用镊子剥除肾脏外的脂肪及包膜,剪刀纵向剪开肾脏,去除髓质部,收集皮质部。用剪刀将皮质组织充分剪碎至1 mm3左右,放入研磨器中轻轻研磨,并加PBS冲洗。研磨至糊状后,转移至100目不锈钢筛网上,用注射器内芯在网上轻轻研磨,同时加 PBS冲洗,收集网下过滤的组织匀浆,将其再加至150目筛网上[1],用注射器内芯继续研磨,加 PBS冲洗,收集网上组织物,然后再用PBS反向冲洗筛网,收集冲洗下来的组织物即为肾小管节段,合并置于离心管内。
1.4 肾小管上皮细胞的培养
将离心管内组织物离心去除上清,加入DMEM:F12培养液进行重悬,充分混匀,等量分为5份,分别为A、B、C、D、E组,进行下列不同处理及培养。
A组:直接选取形态较长,缠绕较多的肾小管节段,放入涂有胶原蛋白的12孔细胞培养板中,每孔加入含5%胎牛血清的DMEM:F12培养液1 mL,置于 CO2孵箱,经 5%CO2、37℃ 培养。
B组:在细胞液中加入0.25%胰酶进行37℃消化,时间为8 min,镜下观察,肾小管节段大多消化成小节段[2]。加血清终止消化后,离心去除胰酶,用含5%胎牛血清的DMEM:F12重悬培养物,同A组方法培养。
C组:加入0.1%的I型胶原酶37℃消化,时间为8 min。镜下观察,经消化的节段比胰酶消化更小,离心去除I型胶原酶,同上方法培养。
D组:加入 0.25%胰酶 37℃消化,时间为 20 min,收集上清液,1000 r/min离心得到细胞沉淀。在原有的节段中再加入胰酶,重复消化一次,收集上清液,离心得到细胞沉淀。将所得细胞沉淀合并,重悬混匀计数,同上方法培养。
E组:加入0.1%Ⅰ型胶原酶,37℃消化20 min,收集上清液,剩余节段再加入胶原酶消化,重复消化2次收集的上清液,直到完全消化为止。将所得的细胞上清液经1000 r/min离心得到细胞沉淀,计数后同上培养。
1.5 细胞传代培养
在肾小管上皮细胞长满培养皿后,用0.25%胰酶消化,然后传代。吸净培养液,用无血清培养基润洗两次,加入100 μL胰酶,镜下观察,待大部分细胞收缩后,加入含血清培养基终止消化。吸弃胰酶,加入无血清培养液轻轻吹打,收集上清液至离心管内。润洗培养板内细胞数次,继续加入胰酶消化,当镜下观察剩余的贴壁细胞松动后,加入含血清培养液吹打数次,终止消化。收集细胞,经1500 r/min离心10 min,收集细胞沉淀,重悬计数后培养。
1.6 细胞鉴定
洗去培养皿中传代细胞的培养液,用固定液固定20 min。洗去固定液,用封闭液封闭60 min。吸弃封闭液,每孔加入1∶1000稀释的小鼠抗CK18抗体 100 μL,对照孔加同型小鼠血清 100 μL,4℃ 过夜。洗去一抗和同型血清后,加入兔抗小鼠FITC二抗,避光孵育1 h,在荧光显微镜下观察并照相。
2 结果
2.1 肾小管节段提取及其细胞生长
图1显示,从肾脏皮质部初步分离的肾小管清晰可见。经过酶短暂消化后的肾小管节段变短,透明度增加,管中颗粒清晰(图2)。经培养后上皮细胞从肾小管节段的缺口部分生长出来,向外蔓延(图3)。上皮细胞从肾小管节段周围快速增长,使得肾小管节段逐渐变短,最后消失(图4)。迅速增殖的肾小管上皮细胞,已经平铺于培养皿底部(图5)。典型的肾小管上皮细胞呈铺路石形状,细胞边缘清晰,折光性强,原代细胞大小均匀饱满。成片培养的细胞纯度较高,不含其他杂细胞。图1~5见封底。
2.2 不同培养条件下细胞的培养效果
A组肾小管节段大部分在24~48 h内贴壁,且节段周围有少量的上皮样细胞长出。将细胞换成含10%胎牛血清的DMEM:F12培养液,在72 h后快速增殖,至第4~7天内细胞数目呈指数式增长,第9天左右长满80%。
B组在48 h后观察,肾小管节段贴壁数量明显比A组少,且贴壁节段周围未长出上皮样细胞,换液后,于第4天可以看见少量的细胞在节段周围增殖,第6天左右进入指数增长期,之后每24 h换一次液,第12天左右长满。
C组肾小管节段基本都在36 h左右贴壁,且能看到明显的上皮样细胞在节段周围长出,第3天左右细胞进入指数增长期,每隔24 h换一次液,7 d左右长满。
D组细胞于48 h左右在镜下观察,仍然处于漂浮状态,基本没有贴壁。72 h左右仍然没有细胞贴壁增长的迹象,台盼蓝染色,显示大多数细胞已经死亡。
E组细胞48 h左右观察大多数贴壁,但仍然有部分细胞悬浮,换液后明显增殖,第4天左右进入指数增长期,第8天左右长满。
2.3 传代细胞的培养
第2代肾小管传代上皮细胞。可见细胞生长迅速,大多数上皮样细胞维持铺路石形状,但少量细胞出现形态变小、折光暗淡及不规则形状,失去凹凸感。图6见封底。
2.4 培养细胞的鉴定
通过以上图片可见,小管上皮细胞从肾小管组织中向外延伸增殖;平铺细胞呈现与其他动物和人肾小管上皮细胞类似的铺路鹅卵石形状;另外,用CK18抗体染色鉴定肾小管上皮细胞,可见荧光染色后细胞表面呈现绿色荧光[3](图7见封底)。这些结果充分证明本研究分离培养的是肾小管上皮细胞,并且纯度较高。
3 讨论
虽然豚鼠肾小管上皮细胞的应用和培养在多处论文和资料上提及,但都没有完整和具体方法介绍。本实验通过五种方法的尝试,得到了一种比较行之有效的肾小管上皮细胞培养方法,即C组方案。利用胶原酶短时间内消化提取的肾小管节段,得到较小节段,然后贴壁培养,可以得到较为纯净的肾小管上皮细胞,且增殖较快。其次,也可以使用胰酶消化,但效果较胶原酶稍差。原因可能是胰酶对于肾小管上皮有一定的伤害作用,影响其正常的生理功能。长时间胰酶消化得到的细胞悬液,基本没有贴壁增殖的可能。肾小管上皮细胞对于胰酶较为敏感,所以在传代的过程中,要在镜下观察消化的状况,控制消化终止时间是能否成功传代的关键,时间过长则细胞状态很差,难以增殖[4]。本实验所得到的传代细胞折光性较强,形态结构为一致的铺路石形状,效果较好。
本实验的方案通过筛网过滤,能得到非常纯净的肾小管节段,基本不含其他组织结构,所以得到的肾小管上皮细胞纯度很高,没有明显的杂细胞。在传代过程中,利用上皮细胞贴壁能力强的特点,吸弃最先脱落的细胞,这样可以进一步纯化肾小管上皮细胞。
本实验建立了比较完备的制备豚鼠肾小管上皮细胞的方法,获得了细胞培养各阶段的直接图片证据,且方法简便易行,没有复杂昂贵的操作步骤,这为进一步研究工作提供了可行的实验平台。

图1 分离所得的肾小管节段Fig.1 Separated tubular segments
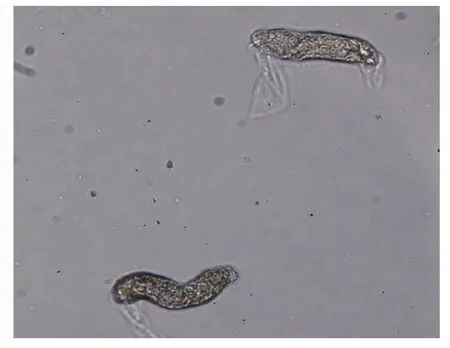
图2 消化后肾小管节段Fig.2 Tubular segments, after digestion
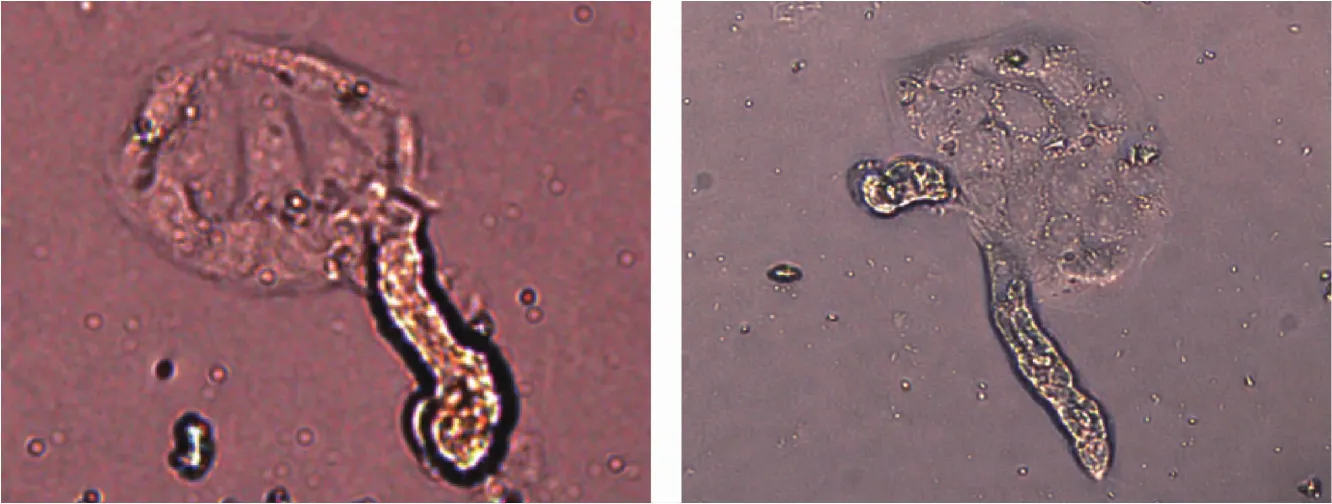
图3 贴壁后细胞在肾小管节段周围长出Fig.3 Outgrowth of epithelial cells from tubular segments

图4 肾小管节段周围细胞快速增殖、节段缩小Fig.4 Rapid proliferation of cells around the diminishing tubular segment

图5 迅速增殖的肾小管上皮细胞、节段消失Fig.5 Rapidly proliferating epithelial cells. The segment was no longer seen

图6 传代后的肾小管上皮细胞Fig.6 Renal tubular epithelial cells cultured after passages

图7 加CK18后的荧光染色(A)及同型小鼠血清染色(B)Fig.7 Tubular epithelial cells after fluorescence staining for CK18 (A) and after the same type serum staining (B)
[1]吴国娟,杨明,王典仁.小鼠肾小管上皮细胞的原代培养及鉴定[J].解剖学报,2007,38(6):765-757.
[2]王林,卓丽玲,顾建红.SD大鼠肾小管上皮细胞的原代培养及鉴定[J].中国兽医学报,2008,25(12):1445-1448.
[3]Lieske JC,Toback FG.Regulation of renal epithelial cell endocytosis of calcium oxalate monohydrate crystals[J].Am J Physiol,1993,264:F800- F808.
[4]Lash LH.In vitro methods of assessing renal damage[J].Toxicol Pathol,1998,26(1):33 - 42.
