青海湖裸鲤三磷酸甘油醛脱氢酶基因的克隆和表达特性
2013-02-06卫福磊李长忠史建全祁得林梁健谢保胜赵兰英祁洪芳
卫福磊,李长忠,史建全,祁得林,梁健,谢保胜,赵兰英,祁洪芳
(1.青海大学生态环境工程学院,西宁 810016;2.青海湖裸鲤救护中心,西宁 810016;3.青海大学农牧学院,西宁 810016)
青海湖裸鲤(Gymnocypris przewalskii)俗称湟鱼,属鲤形目(Cypriniformes),鲤科(Cyprinidae),裂腹鱼亚科(Schizothoracinae),裸鲤属,是青海湖中唯一的水生经济动物,处于青海湖整个生态系统的核心地位。青海湖地处海拔三千多米的高原上,水温低,饵料生物贫乏,故此鱼生长缓慢,生长300~500 g 平均需要7~10 年时间。它是国家二级保护鱼类,1998 年被《中国濒危动物红皮书》列为濒危物种[1]。青海湖裸鲤属于洄游产卵型鱼类,每年从青海湖洄游至淡水河流中产卵繁殖,环境的改变促使洄游的青海湖裸鲤也发生一系列适应性的变化[2,3]。在过去的50 年里,由于青海湖盐度的增加[4]、人工过度捕捞以及生长缓慢等原因,野生青海湖裸鲤存储量从1960 年的20 ×104吨[5]减少到了现在不足0.5 ×104吨[6]。实践证明,青海湖裸鲤的人工增殖、放流是一种保护和恢复青海湖裸鲤资源的有效方法。积极开展青海湖裸鲤基础生物学特征和对低氧、低温、盐碱环境适应的分子机理的研究,有助于揭示青海湖裸鲤的基本生命活动规律,为该鱼种的资源保护和人工、增殖放流提供理论依据。
3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)是糖酵解途径中的一个关键酶,是一种多功能性蛋白。在大部分物种中由于GAPDH 具有高度种属保守序列,在很多组织中都高水平表达,且表达量一般相对恒定,故常被用作RT-PCR、Western blot 等实验操作的内源参照基因[7]。但是,近年来的研究也发现GAPDH 的表达水平并不稳定,在不同动物中利用它作为内标来进行半定量分析受到质疑[8-10]。因此,进行青海湖裸鲤生理适应的分子机理的研究,有必要了解GAPDH作为内标的可靠性。
GAPDH 参与多种细胞功能的调节,例如DNA修复[11]、tRNA 出核过程[12]、膜融合与运输作用[13,14]以及细胞凋亡等。根据Hara 的研究,GAPDH 参与的细胞凋亡涉及NO-巯基亚硝基化-GAPDH-Siah 途径,即经巯基亚硝基化的GAPDH 可以特异的与E3-泛素连接酶Siah 形成复合体进入细胞核,进入细胞核后的Siah 使细胞核蛋白质降解,促进了细胞凋亡作用[15,16]。另一方面,蛋白激酶B 可以对GAPDH 蛋白237 位苏氨酸磷酸化而抑制其向细胞核转移,阻止GAPDH 介导的细胞凋亡作用[17]。此外还发现GAPDH 能够特异地与肌醇1,4,5-三磷酸受体结合,并且在代谢过程中产生的NADH 能够进一步调节内质网中Ca2+的释放[18],通过钙离子信号通路对于细胞增殖、分化、凋亡进行调控。尽管对于GAPDH 结构和分子催化基本特征方面取得了一定进展,但是对于其功能调节的机制却知之甚少。掌握青海湖裸鲤GAPDH 分子的序列和结构特征,有助于全面了解GAPDH 在青海湖裸鲤环境适应方面的作用机制。
本研究利用RT-PCR 和RACE 方法得到了青海湖裸鲤3-磷酸甘油醛脱氢酶旁系同源体基因(Gp-GAPDHα、Gp-GAPDHβ)cDNA 全长序列,通过序列特征分析及其在不同组织和受精卵不同发育阶段表达水平研究,初步掌握了GAPDH 作为内标的可靠性,并为GAPDH 在青海湖裸鲤适应性调节机制的进一步研究奠定基础。
1 材料与方法
1.1 实验材料
青海湖裸鲤取自青海湖裸鲤救护中心原种培育基地养殖场(青海,西宁),均为淡水池塘养殖的2+龄雌鱼,体重300~500 g,体长27~35 cm。试验用鱼运回实验室后暂养于装满淡水养殖箱中。随机选取健康的青海湖裸鲤3 条以上个体用于实验,取青海湖裸鲤不同组织于液氮中保存。青海湖裸鲤胚胎发育不同阶段取自青海湖裸鲤救护中心刚察孵化站,青海湖裸鲤卵细胞人工受精后于淡水中孵化,孵化用水引自沙柳河(青海,西宁),为地表径流水,水温保持在13~17℃,溶氧量>5.0 mg/L。
主要试剂:Ex Taq 酶、pMD19-T 载体、RNA 提取试剂RNAiso Plus reagent、PrimeScript RTase Kit、5‘Full RACE Kit 和3′Full RACE Core Set Ver.2.0 购自宝生物工程有限公司(大连),琼脂糖凝胶回收试剂盒、DNA marker 购自生工生物工程有限公司(上海)。
1.2 实验方法
1.2.1 总RNA 的提取和GAPDH 基因快速扩增(RACE)cDNAs 末端模板制备
取于液氮中保存的鳃组织液氮研磨,加入RNAiso Plus reagent 中提取RNA。对于提取的总RNA 样品进行定量并电泳检测后,依照PrimeScript RTase Kit、5′ Full RACE Kit 和3′ Full RACE Core Set Ver.2.0 分别制备RT-PCR 和RACE 扩增模板。
1.2.2 Gp-GAPDH 基因特异性片段的扩增
根据斑马鱼、大西洋鲑鱼等已知的GAPDH 基因保守cDNA 序列设计引物GAPDHF1 和GAPDHR1(表1),以青海湖裸鲤第一链cDNA 为模板,扩增得到Gp-GAPDHα 基因特异性片段。使用GAPDHF1 和GAPDHR1 为RACE 引物进行Gp-GAPDH基因末端扩增,却同时得到两种碱基存在明显差异的基因序列,分别命名为 Gp-GAPDHα 和 Gp-GAPDHβ。
1.2.3 Gp-GAPDHα 基因全长扩增
依照5′ Full RACE Kit 说明,使用引物Gp-GAPDHαR1(表1)与5′ RACE inner primer(Takara,Kyoto,Japan)为扩增引物,5′ RACE 产物为模板,进行PCR 扩增得到5′端非编码区。同时,以3′ RACE产物为模板,使用引物Gp-GAPDHαF1(表1)与3′RACE inner primer(Takara,Kyoto,Japan)进行PCR扩增得到Gp-GAPDHα 基因3′端非编码区。对上述获得的序列进行拼接,根据拼接序列在基因序列3′端非编码区与 5′ 端非编码区设计引物 GPGAPDHαF2 和GP-GAPDHαR2(表1)进行验证PCR反应。
1.2.4 Gp-GAPDH β 基因全长扩增
设计用于Gp-GAPDH β 基因5′ RACE 扩增的特异引物Gp-GAPDHβR1(表1)与3′ RACE 扩增的特异引物Gp-GAPDHβF1(表1)分别与5′ RACE Inner Primer 和3′ RACE inner Primer 进行PCR 扩增得到5′端非编码区及3′端非编码区。对上述获得的序列进行拼接得到Gp-GAPDHβ 基因全长序列,根据拼接序列在基因序列3′端非编码区与5′端非编码区设计引物GP-GAPDHβF2 和GP-GAPDHβR2(表1)进行验证PCR 反应。

表1 PCR 所使用的引物名称与引物序列Tab.1 Primer names and sequences used in the PCR

1.2.5 Gp-GAPDH 基因序列分析
利用在线工具ExPaSy(http://www.expasy.ch/tools/dna.html)进行蛋白质序列基本性质预测。使用在线工具Intropro 进行蛋白质结构域预测。不同物种的GAPDH 氨基酸序列下载于GenBank 数据库,通过分析软件Vector NTI(Infor-Max,Frederick,USA)进行同源性比较及系统进化树(NJ 法)的构建。
1.2.6 Gp-GAPDHα 与Gp-GAPDHβ 基因在青海湖裸鲤不同组织中的表达水平检测
提取青海湖裸鲤心脏、脑、鳃、肌肉、肾脏和卵巢6 种组织总RNA。由于Gp-GAPDHα 与Gp-GAPDHβ编码区相似度较高,为避免引物非特异性结合,根据各自3′端非编码区设计Gp-GAPDHα 基因半定量RT-PCR 特 异 引 物: semi-GAPDHαF1、 semi-GAPDHαR1、semi-GAPDHβF1 和 semi-GAPDHβR1(表1)。以青海湖裸鲤β-actin 为参照,先后进行3次RT-PCR 实验。Gp-GAPDHα 与Gp-GAPDHβ 基因PCR 扩增条件为:预变性94℃ 3 min;94℃ 45 s,56℃30 s,72℃25 s,30 循环;72℃10 min。通过1.5%琼脂糖凝胶电泳和生物图形软件Gel-Pro analyzer 分别检测其在不同组织中的转录水平差异。
1.2.7 Gp-GAPDHα 与Gp-GAPDHβ 基因在青海湖裸鲤受精卵不同发育阶段的表达水平检测
青海湖裸鲤产沉粘性卵,人工脱粘之后,调控水温和水流量于溶氧大于5.0 mg/L 流动淡水中孵化,全部仔鱼出膜约7 d 左右。于液氮中保存未发育成熟Ⅳ期卵母细胞、发育至多细胞期、囊胚期、原肠中期、原肠晚期、神经胚期和器官形成期胚胎,提取各发育阶段总 RNA,使用 RT-PCR 分别检测 Gp-GAPDHα 与Gp-GAPDHβ 在受精卵不同发育阶段转录水平的变化,方法同1.2.3。
1.2.8 统计分析与绘图
根据Gel-Pro analyzer 对表达条带密度进行扫描,表达量以均值± 标准误(mean ± SE)表示,同时使用Minitab(Minitab,USA)统计分析软件进行方差分析(P<0.05)。通过Origin 7(OriginLab,USA)绘制柱形图。
2 结果
2.1 Gp-GAPDHα 与Gp-GAPDHβ 的克隆与序列分析
使用引物GAPDHF1(表1)和GAPDHR1(表1)进行PCR 扩增得到特异性条带,经测序为Gp-GAPDHα 片段,使用此对引物分别进行5′与3′端RACE 反应,却得到了序列存在明显差异的Gp-GAPDHα 与Gp-GAPDHβ 基因3′与5′末端序列。根据已得到末端序列分别设计相应5′与3′端RACE引物,进行末端扩增、序列拼接和验证PCR,得到Gp-GAPDHα 与Gp-GAPDHβ 基因全长序列。
2.1.1 Gp-GAPDHα 基因克隆
利用引物 Gp-GAPDHαR1 与 5′-RACE inner primer 进行PCR 扩增,得到Gp-GAPDHα 基因526 bp 的5′端序列。利用引物Gp-GAPDHαF1 与3′RACE inner primer 进行PCR 扩增得到长度为854 bp 的3′端序列,序列拼接得到Gp-GAPDHα 基因全长序列共1302 bp。使用 GP-GAPDHαF2 和 GPGAPDHαR2 进行验证性PCR 扩增获得包含Gp-GAPDHα 编码区全长的基因序列共1070 bp(图1),GenBank 注册号为:JX287372。
2.1.2 Gp-GAPDHβ 基因克隆
使用引物 Gp-GAPDHβR1 与5′ RACE Inner Primer 进行PCR 扩增得到5′端序列458 bp,引物Gp-GAPDHβF1 与3′ RACE inner Primer 进行PCR扩增得到3′端序列1203 bp。序列拼接得到Gp-GAPDHβ 基因全长序列共1403 bp,根据拼接序列在基因序列3′端非编码区与5′端非编码区设计引物GP-GAPDHβF2 和GP-GAPDHβR2 进行验证PCR 反应,获得包括Gp-GAPDHβ 编码区全长基因序列共1167 bp(图2)。GenBank 注册号为:JX287373。

图1 Gp-GAPDHα 基因的克隆Note:M.Marker;1.PCR product of 5′RACE;2.PCR product of 3′RACE;3.PCR product of confirming PCR.Fig.1 Gene clones of Gp-GAPDHα.

图2 Gp-GAPDHβ 基因的克隆Note:M.Marker;1.PCR product of 5′RACE;2.PCR product of 3′RACE;3.PCR product of confirming PCRFig.2 Gene clones of Gp-GAPDHβ
2.2 序列分析
如图3A,Gp-GAPDHα 基因全长序列由70 bp 的5′端非编码区、1002 bp编码区和230 bp 的3′端非编码区序列构成。Gp-GAPDHα 基因开放性读码框包含1002 bp核苷酸序列,编码333 个氨基酸,该蛋白分子量为35.7 ×103,等电点为8.73,不含信号肽序列。Gp-GAPDHα 蛋白序列与硬骨鱼GAPDH 蛋白序列同源性分别为:斑马鱼95%(Dr-GAPDH1)和74%(Dr-GAPDH2);石鲷鱼91%(Rb-GAPDH1)和73%(Rb-GAPDH2)。与人类GAPDH 蛋白序列同源性为84%(Hs-GAPDH1)和74%(Hs-GAPDH2)(表2)。
如图3B,Gp-GAPDHβ 基因全长序列由67 bp 的5′端非编码区、1008 bp编码区和328 bp 的3′端非编码区序列构成。Gp-GAPDHβ 基因开放性读码框包含100 bp 核苷酸序列,其编码335 个氨基酸,该蛋白分子量为36.0 kDa,等电点为6.58,不含信号肽序列。Gp-GAPDHβ 蛋白序列与硬骨鱼GAPDH 蛋白序列同源性分别为:斑马鱼73%(Dr-GAPDH1)和97%(Dr-GAPDH2);石鲷鱼73%(Rb-GAPDH1)和92%(Rb-GAPDH2)。与人类GAPDH 蛋白序列同源性为73%(Hs-GAPDH1)和66%(Hs-GAPDH2)(表2)。

图3 (A)青海湖裸鲤GAPDH 旁系同源体编码基因Gp-GAPDHα 及氨基酸序列Note:Gp-GAPDH has a putative NAD + binding domain(shaded),a conserved catalytic domain(underlined)and GAPDH active site(bold and italic).Fig.3 (A)cDNA sequences and deduced amino acid sequences of G.przewalskii glyceraldehyde 3-phosphate dehydrogenase paralogue isoforms:Gp-GAPDHα.

图3 (B)青海湖裸鲤GAPDH 旁系同源体编码基因Gp-GAPDHβ 及氨基酸序列Note:Gp-GAPDH has a putative NAD + binding domain(shaded),a conserved catalytic domain(underlined)and GAPDH active site(bold and italic).Fig.3 (B)cDNA sequences and deduced amino acid sequences of G.przewalskii glyceraldehyde 3-phosphate dehydrogenase paralogue isoforms:Gp-GAPDHβ.
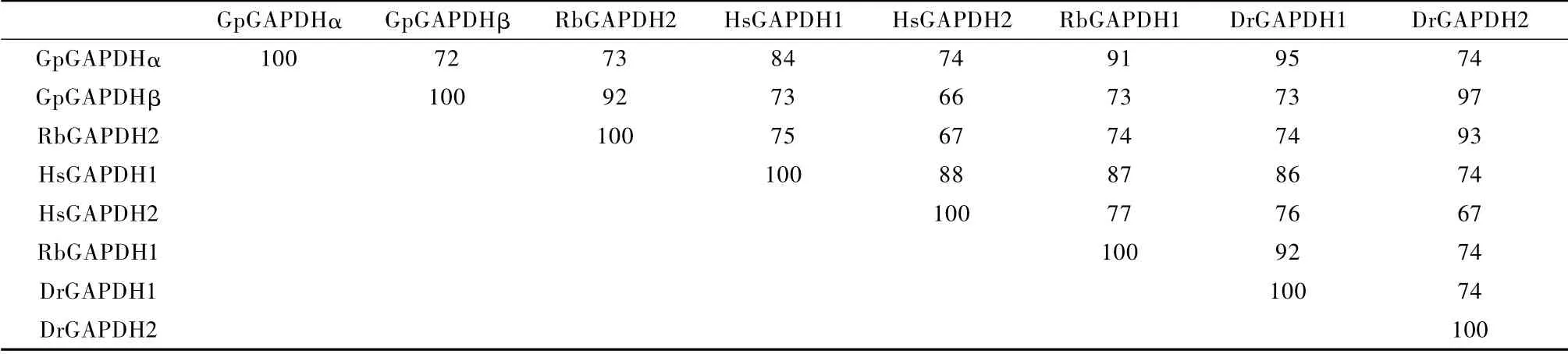
表2 不同物种GAPDH 氨基酸序列比对及NJ 法构建进化树Tab.2 Phylogenetic reconstruction using Neighbor-joining(NJ)method with G.przewalskii glyceraldehyde 3-phosphate dehydrogenase isoform α(Gp-GAPDHα)and isoform β(Gp-GAPDHβ)with those of other species
注:GenBank 登录号:GpGAPDHα,GAPDH[青海湖裸鲤](JX287372);GpGAPDHβ,GAPDH[青海湖裸鲤](JX287373);DrGAPDH1,GAPDH[斑马鱼](NP_001108586.1);DrGAPDH2,GAPDH[斑马鱼睾丸型](NP_998259.1);RbGAPDH1,GAPDH[石鲷1](ACF35052.1);RbGAPDH2,GAPDH[石鲷2](ACF35053.1);HsGAPDH1,GAPDH[人类1](NP_002037.2);HsGAPDH2,GAPDH[人类2](NP_001243728.1)。Note:GenBank accession numbers are as follows:GpGAPDHα,GAPDH[Gymnocypris przewalskii](JX287372);GpGAPDHβ,GAPDH[Gymnocypris przewalskii](JX287373);DrGAPDH1,GAPDH[Danio rerio](NP_001108586.1);DrGAPDH2,GAPDH[Danio rerio](NP_998259.1);Rb-GAPDH1,GAPDH[Oplegnathus fasciatu](ACF35052.1);RbGAPDH2,GAPDH[Oplegnathus fasciatus](ACF35053.1);HsGAPDH1,GAPDH[Homo sapiens1](NP_002037.2);HsGAPDH2,GAPDH[Homo sapiens](NP_001243728.1).
2.3 Gp-GAPDHα 与Gp-GAPDHβ 表达模式的研究
2.3.1 Gp-GAPDHα 与Gp-GAPDHβ 在青海湖裸鲤不同组织中表达量分析

图4 不同组织中Gp-GAPDH 表达模式Note:1.Heart;2.Brain;3.Gill;4.Muscle;5.Kidney;6.OvaryFig.4 Expression pattern of Gp-GAPDH in different tissues
以β-actin 基因的表达作参比,转录水平用三次Gp-GAPDHα 与Gp-GAPDHβ 分别对参比基因密度的比值所得的(±s)表示。如图4,图的上部为三次电泳结果之一,不同组织中Gp-GAPDHα 与Gp-GAPDHβ的表达量方差分析结果表明,Gp-GAPDHα 在心脏和脑组织中表达量最高且表达量相似,鳃、肌肉、肾脏中表达量相似但相对较低,在卵巢中表达量适中(P<0.05)。Gp-GAPDHβ 在鳃组织中的表达量最多,在心脏、肌肉、肾脏和卵巢组织中表达量差异不大,在脑组织中表达量最少(P<0.05)。
2.3.2 青海湖裸鲤胚胎发育不同阶段Gp-GAPDHα与Gp-GAPDHβ 表达量的分析
以青海湖裸鲤β-actin 为参照,对Gp-GAPDHα 与Gp-GAPDHβ 在青海湖裸鲤胚胎发育不同阶段的表达量变化进行分析。如图5,方差分析结果表明,Gp-GAPDHα 在4 期卵母细胞、多细胞期、原肠中期、原肠晚期、神经胚期和器官形成期表达水平差异不显著,但在囊胚期表达量最高(P<0.05)。Gp-GAPDHβ在青海湖裸鲤胚胎不同发育阶段表达量的差异较大,即在未成熟的卵细胞和器官形成期表达量最高,从卵细胞受精至神经胚期之间表达量很小(P<0.05)。
3 讨论
本研究报道了青海湖裸鲤3-磷酸甘油醛脱氢酶两种旁系同源体基因Gp-GAPDHα 和Gp-GAPDHβ 的全长cDNA 序列,两者的氨基酸序列与其他物种存在广泛的同源性。通过对两种基因在不同组织和受胚胎不同发育阶段中转录水平的研究,初步分析其作为参照基因的可靠性。
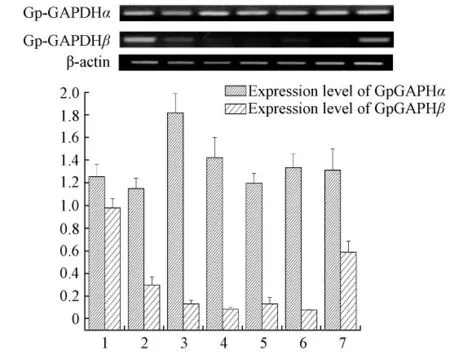
图5 胚胎发育不同阶段Gp-GAPDH 表达模式Note:1.Oocytes of phase 4;2.Multicellular stage;3.Blastula stage;4.Middle gastrula stage;5.Late gastrula stage;6.Neurula stage;7.Period of organogenesis.Fig.5 Expression pattern of Gp-GAPDH at different stages of embryogenesis
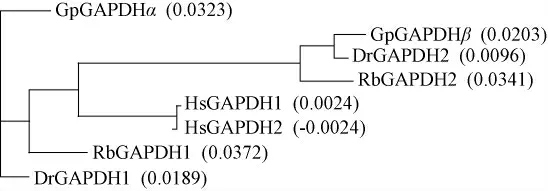
人体存在两种相似的GAPDH 基因,分别为Hs-GAPDH1 和Hs-GAPDH2,其中Hs-GAPDH1 广泛分布与不同组织中,而Hs-GAPDH2 为睾丸组织特异性表达。在石鲷鱼中同样发现GAPDH 存在两种旁系同源体,Rb-GAPDH1 和Rb-GAPDH2,分别编码333和335 个氨基酸序列,普遍分布于不同组织中,两者的相似性为74%[19]。本次实验克隆得到的Gp-GAPDHα 和 Gp-GAPDHβ 与 Rb-GAPDH1 和 Rb-GAPDH2 相似度分别为91%和92%,这说明硬骨鱼中两种GAPDH 旁系同源体是普遍存在的,而与哺乳动物存在一定差异。进一步对Gp-GAPDHα 和Gp-GAPDHβ 与斑马鱼三磷酸甘油醛脱氢酶序列Dr-GAPDH1 和Dr-GAPDH2 进行相似性比较,发现Gp-GAPDHβ 与斑马鱼睾丸型Dr-GAPDH2 更加相似(97%)。已有的研究表明,GAPDH 旁系同源体在脊索动物早期进化中通过基因复制而出现,GAPDH2在大部分物种进化中丢失,仅存在于蜥蜴类、哺乳动物和鱼类,在鱼类不同组织都有分布[20]。
通过蛋白质结构域预测分析表明,Gp-GAPDHα、Gp-GAPDHβ 蛋白具有GAPDH 蛋白基本结构域:NAD+结合结构域和保守的催化结构,同时还包括一个保守的GAPDH 活性位点(图3)。所得到的两种Gp-GAPDH 旁系同源体基因存在明显差异,虽然两种推测编码蛋白都具有3-磷酸甘油醛脱氢酶特征性催化结构域和NAD+结合结构,但是同源性却只为74%,等电点差异更大,分别为:Ip(Gp-GAPDHα):8.73,Ip(Gp-GAPDHβ):6.58。在青海湖裸鲤同时存在这两种Gp-GAPDH 旁系同源体,它们的功能及其差异需要进一步研究。
β-actin 经常作为参照基因对目的基因表达量进行校正,根据对于硬骨鱼的研究中发现,β-actin 更适合作为参照基因使用,在牙鲆不同发育阶段的内参基因选择过程中发现,GAPDH 的表达差异相当显著,而β-actin 基因相对较稳定[10]。通过黄花鱼的研究发现,β-actin 是在免疫反应中表达量比较稳定的基因,可以作为对照基因[21]。通过RT-PCR 检测半滑舌鳎在内毒素物质刺激条件下β-actin 在不同组织中表达量,并未发现明显差别,认为其可作为可靠的参照基因使用[22]。因此,本研究以β-actin 为参照基因对于Gp-GAPDHα 与Gp-GAPDHβ 表达水平进行分析,结果显示,Gp-GAPDHα 与Gp-GAPDHβ 在青海湖裸鲤不同组织和受精卵发育不同阶段表达量存在较大差异,尤其Gp-GAPDHβ 在胚胎发育不同阶段差异显著。初步断定Gp-GAPDHβ 不适合作为参照基因,而Gp-GAPDHα 表达稳定性需要进一步研究,选择其作为参照基因需谨慎。
鱼类胚胎发育通常需经历卵裂期、囊胚期、原肠胚期、神经胚器和器官形成期后进入孵化阶段,当鱼类受精卵细胞发育至器官形成期,细胞进入分化与凋亡活动更加活跃的阶段。在以小鼠为模式动物的研究中,Schlisser 发现在小鼠胚胎器官形成期,GAPDH 介导致畸剂Teratogen 产生的氧化胁迫从而导致小鼠畸形[23],我们推测GAPDH 在鱼类受精卵的正常发育过程中起着重要的作用,两种异形体的功能需要做进一步研究。
[1]Xiong F,Chen DQ,Duan XB.Threatened fishes of the world:(Gymnocypris przewalskii)(Kessler, 1876 )(Cyprinidae:Schizothoracinae)[J].Environ Biol Fishes,2010,87(4):351-352.
[2]Wang YS,Gonzalez RJ,Patrick,ML,et al.Unusual physiology of scale-less carp,Gymnocypris przewalskii,in Lake Qinghai:a high altitude alkaline saline lake[J].Comp Biochem Physiol A Mol Integr Physiol,2003,134(2):409-421.
[3]Wood CM,Du J,Rogers J,et al.Przewalski′s naked carp(Gymnocypris przewalskii):an endangered species taking a metabolic holiday in Lake Qinghai,China[J].Physiol Biochem Zool,2007,80(1):59-77.
[4]Walker KI,Dunn I,Edwards D,et al.A fishery in a changing lake environment:The naked carp(Gymnocypris przewalskii)(Kessler)(Cyprinidae:schizothoracinae)in Qinghai Hu,China[J].Int J Salt Lake Res,1995,4(3):169-222.
[5]史建全,祁洪芳,杨建新,等.青海湖裸鲤资源评析[J].淡水渔业,2000,30(11):38-40.
[6]Chen D,Zhang X,Tan X,et al.Hydroacoustic study of spatial and temporal distribution of Gymnocypris przewalskii(Kessler,1876)in Qinghai Lake,China[J].Environ Biol Fishes,2009,84(2):231-239.
[7]Li CZ,Huang J,Li S,et al.Cloning,characterization and immunolocalization of two subunits of calcineurin from pearl oyster(Pinctada fucata)[J].Comp Biochem Physiol B Biochem Mol Biol,2009,153(1):43-53.
[8]Della Beffa C,Klawonn F,Menetski,JP,et al.Evaluation of glyceraldehyde-3-phosphate,prolylpeptidyl isomerase A,and a set of stably expressed genes as reference mRNAs in urate crystal inflammation[J].BMC Res Notes,2011.4:443.
[9]Uddin MJ,Cinar MU,Tesfaye D,et al.,Age-related changes in relative expression stability of commonly used housekeeping genes in selected porcine tissues[J].BMC Res Notes,2011.4:441.
[10]杨桂梅,鲍宝龙,任大明,3-磷酸甘油醛脱氢酶、β-肌动蛋白和18SrRNA 作为相对定量的内标在牙鲆发育阶段的稳定性比较.上海水产大学学报,2005,01:84-88.
[11]Meyer-Siegler K,Mauro DJ,Seal G,et al.A human nuclear uracil DNA glycosylase is the 37-kDa subunit of glyceraldehyde-3-phosphate dehydrogenase[J].Proc Nat Acad Sci U S A,1991,88(19):8460-8464.
[12]Singh R,Green M.Sequence-specific binding of transfer RNA by glyceraldehyde-3-phosphate dehydrogenase[J].Science,1993,259(5093):365-368.
[13]Tisdale EJ.Glyceraldehyde-3-phosphate dehydrogenase is required for vesicular transport in the early secretory pathway[J].J Biol Chem,2001,276(4):2480-2486.
[14]Tisdale EJ,Kelly C,Artalejo CR.Glyceraldehyde-3-phosphate dehydrogenase interacts with Rab2 and plays an essential role in endoplasmic reticulum to Golgi transport exclusive of its glycolytic activity[J].J Biol Chem.2004,279(52):54046-54052.
[15]Hara MR,Agrawal N,Kim SF,et al.S-nitrosylated GAPDH initiates apoptotic cell death by nuclear translocation following Siah1 binding[J].Nat Cell Biol,2005,7(7):665-674.
[16]Hara MR,Tomas B,Cascio MB,et al.Neuroprotection by pharmacologic blockade of the GAPDH death cascade[J].Proc Nat Acad Sci U S A,2006,103(10):3887-3889.
[17]Huang Q,Lan F,Zheng Z et al.Akt2 kinase suppresses glyceraldehyde-3-phosphate dehydrogenase(GAPDH)-mediated apoptosis in ovarian cancer cells via phosphorylating GAPDH at threonine 237 and decreasing its nuclear translocation[J].J Biol Chem,2011,286(49):42211-42220.
[18]Patterson RL,van Rossum DB,Kaplin AI,et al.Inositol 1,4,5-trisphosphate receptor/GAPDH complex augments Ca2+release via locally derived NADH[J].Proc Natl Acad Sci U S A,2005,102(5):1357-1359.
[19]Cho,Y.S,Lee SY,Kim KH,et al.Differential modulations of two glyceraldehyde 3-phosphate dehydrogenase mRNAs in response to bacterial and viral challenges in a marine teleost Oplegnathus fasciatus(Perciformes)[J].Fish Shellfish Immunol,2008,25(5):472-476.
[20]Kuravsky ML,Aleshin VV,Frishman D,et al.Testis-specific glyceraldehyde-3-phosphate dehydrogenase:origin and evolution[J].BMC Evol Biol,2011,11:160.
[21]Xiao X,M Li,Wang K,et al.Characterization of large yellow croaker(Pseudosciaena crocea)beta-actin promoter supports beta-actin gene as an internal control for gene expression modulation and its potential application in transgenic studies in fish.Fish Shellfish Immunol[J],2011.30(4-5):1072-1079.
[22]Li Z,Yang L,Wang J,et al.beta-actin is a useful internal control for tissue-specific gene expression studies using quantitative real-time PCR in the half-smooth tongue sole Cynoglossus semilaevis challenged with LPS or Vibrio anguillarum.Fish Shellfish Immunol[J],2010.29(1):89-93.
[23]Schlisser AE,Yan J,Hales BF.Teratogen-induced oxidative stress targets glyceraldehyde-3-phosphate dehydrogenase in the organogenesis stage mouse embryo[J].Toxicol Sci,2010,118(2):686-695.
