人胚肾293细胞中乙酰转移酶p300对二甲基精氨酸二甲胺水解酶2基因表达的调节*
2013-05-23李英慧李家亓孙陆初国铭孙志军
李英慧,李家亓,孙陆,初国铭,孙志军
一氧化氮(NO)具有舒张血管、抗血小板黏附与聚集等功能,同时它在肾单位的不同部位发挥促进尿钠排泄的作用[1-6],肾脏的一氧化氮生物效应降低是高血压的重要特征之一[7]。一氧化氮由三种一氧化氮合酶(NOS)催化合成,包括:神经型(nNOS)、诱导型(iNOS)和内皮型(eNOS)。非对称性二甲基精氨酸(ADMA)是三种一氧化氮合酶的共同内源性抑制剂,在体内ADMA主要由二甲基精氨酸二甲胺水解酶(DDAH)降解。多种心血管危险因素可通过降低DDAH活性影响一氧化氮合酶和一氧化氮作用,从而参与高血压发生和发展[8-10]。因此,NOS和DDAH/ADMA系统是调节组织一氧化氮水平从而参与血压调节的两个重要方面。DDAH分为两种亚型(DDAH1和DDAH2),DDAH2在调节ADMA代谢中发挥更为重要的作用。
乙酰化参与调节多种基因表达,p300是一种重要的乙酰转移酶。我们的研究及其他报道显示,p300介导的乙酰化参与三种一氧化氮合酶基因的表达调控[11,12],迄今为止尚少见有关乙酰化对 DDAH基因表达调节的报道,本研究旨在探讨p300是否亦参与调节DDAH2基因的表达。我们以人胚肾HEK293细胞为研究对象,通过转染野生型及乙酰转移酶(HAT)结构域缺失的突变型p300表达载体,检测DDAH2基因表达水平及启动子活性变化,从而探讨人胚肾HEK293细胞中乙酰化对DDAH2表达的调控作用。
1 材料和方法
细胞培养及转染:实验时间:2010-03至2011-06选取人胚肾HEK293细胞(来自中国科学院上海生命科学研究院)在DMEM培养基(含10%的胎牛血清,100 U/ml青霉素,100 μg/ml链霉素,美国 GIBCO 公司)、37℃、5%CO2及饱和湿度的条件下培养。0.25%的胰酶(生理盐水配制)消化传代。转染前将培养基更换为无血清无抗生素培养基,应用 LipofectamineTM2000(美国Invitrogen公司)转染试剂转染野生型或乙酰转移酶(HAT)结构域缺失的突变型p300 表达载体(Margottin-Goguet教授惠赠[13]),6 h 后更换为常规培养基培养细胞待用。
Western blot杂交:单去污裂解液方法提取细胞总蛋白,煮沸后上样至十二烷基磺酸钠(SDS)-聚丙烯酰胺凝胶进行电泳,电转至聚偏二氟乙烯(PVDF)膜,室温封闭。分别以1∶1000稀释的兔p300或β-肌动蛋白(βactin)多克隆抗体(购自美国Santa Cruz公司)为一抗进行杂交过夜,洗膜后加入1∶3000稀释的山羊抗兔IgG作为二抗,室温杂交2 h。化学发光法检测杂交信号。
实时定量聚合酶链式反应(real-time PCR):TRIzol试剂(美国Invitrogen公司)常规方法提取细胞核糖核酸(RNA),应用DNAase I消化残留 DNA,使用美国Promega公司反转录试剂盒应用随机引物法合成编码脱氧核糖核酸(cDNA)。应用 SYBR Green(日本TaKaRa公司)染料法,以β-actin为内参,采用相对定量方法进行real-time聚合酶链式反应(PCR)扩增。DDAH2特异性引物序列为:上游5'-TCCCTTCTCCACCAACTCTG-3',下游 5'-CAACCGCTCGGATTTCTTAG-3';β-actin特异性引物序列为:上游5'-CCCAGAGCAAGAGAGGCA-3',下游 5'-GGGAGCCACACGCAG-3'。在优化条件下应用AB公司7500型荧光定量PCR仪进行real-time PCR扩增,每个样品重复扩增三次,每次设置三复孔,取平均值作为相对表达量。
DDAH2动子结构分析及载体构建:应用TRANSFAC-TESS及 Alibaba软件分析 DDAH2启动子区593bp(-530~+63)序列,预测其中是否存在受乙酰化调控的转录因子结合位点。确定转录起始位点为+1,将+44~+63定为下游引物,上游引物分别于-530~-510,-171~151处,以人基因组DNA为模板,不同的PCR反应条件下进行扩增,胶回收纯化后,将片段克隆至pMD18-T克隆载体,酶切鉴定。使用HindIII和KpnI双酶切所得载体及荧光素酶报告基因载体pGL3-Basic(美国Promega公司),应用T4 DNA连接酶将酶切获得的不同长度DDAH2启动子序列连接于pGL3-Basic载体上,进行测序鉴定。所得载体分别命名为pGL530w和pGL171w应用美国Axygen公司质粒小量提取试剂盒提取质粒。
荧光素酶报告基因活性检测:24孔培养皿中接种 HEK293 细 胞,37℃ 培 养 24 h,应用LipofectamineTM2000将pGL530w DNA或pGL171w DNA及对照pRL-TK质粒DNA(美国Promega公司)转染至细胞,同时共转染野生型或突变型p300表达载体。应用Promega公司DUAL-GLOTM双荧光素酶检测系统检测启动子活性,将pGL530w或pGL171w与pRL-TK活性比值作为启动子相对活性。每个样品重复三次,取平均值。
统计分析:使用SPSS 13.0统计软件,应用t检验判断组间差异,以确定组间差异是否具有显著性。P<0.05表示差异具有统计学意义。
2 结果
p300对DDAH2 mRNA表达水平的影响:①应用Western blot鉴定转染效果,结果如图1所示,转染野生型和突变型p300表达载体的细胞中p300蛋白表达水平显著提高(P<0.05)。②应用real-time PCR方法检测了p300对DDAH2 mRNA表达水平的影响,结果显示野生型p300可显著提高DDAH2 mRNA表达,与对照比较差异有统计学意义(P<0.05),而转染HAT结构域缺失的突变型p300载体的细胞中DDAH2 mRNA表达,与对照比较差异无统计学意义(P>0.05)(图2)。
DDAH2启动子荧光素酶基因报告基因载体的构建:为鉴定DDAH2启动子活性,首先应用TRANSFACTESS及Alibaba软件分析了DDAH2启动子结构,发现其中存在多种潜在的受乙酰化调控的转录因子结合位点,如核因子-κB(NF-κB)、CCAAT/增强子结合蛋白(C/EBP)、特异性蛋白1(Sp1)等。
根据预测到的反应元件的位置,我们构建了两个DDAH2启动子荧光素酶报告基因载体,分别包含DDAH2启动子-530~+63及-171~+63区域,命名为pGL530w和pGL171w(二者结构如图3所示),并经测序鉴定。
p300对DDAH2启动子活性的作用:应用双荧光素酶检测系统,我们分析了DDAH2启动子活性。结果显示,基础条件下,pGL530w和pGL171w均存在较高的活性,转染野生型p300表达载体可显著提高二者活性,与对照(未处理细胞)相比差异有统计学意义(P<0.05),但突变型p300对二者活性的作用与对照比较差异无统计学意义(P>0.05)(图4)。
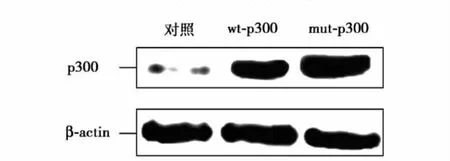
图1 Western blot结果显示表达载体转染后p300蛋白表达情况。β-actin:β-肌动蛋白 wt-p300:转染野生型 p300表达载体;mut-p300:转染突变型p300表达载体 对照:未处理细胞
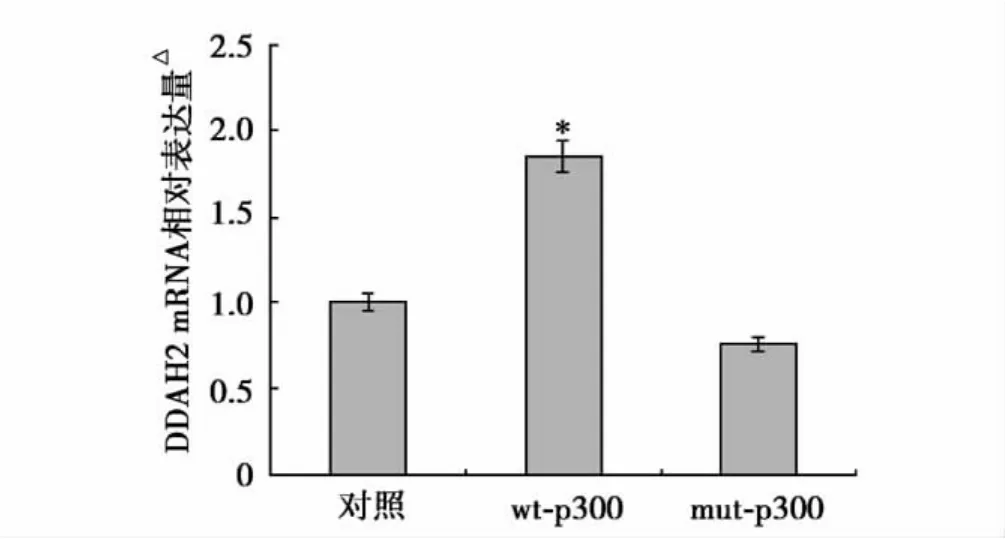
图2 实时定量聚合酶链式反应(real-time PCR)结果显示不同条件下DDAH2 mRNA表达水平。与对照(未处理细胞)比较*P<0.05。图示三次实验均值±标准差;△:以 DDAH2与β-actin mRNA表达量比值作为DDAH2 mRNA相对表达量,每个样品重复扩增三次,每次设置三复孔,取平均值。DDAH2:二甲基精氨酸二甲胺水解酶,余注见图1
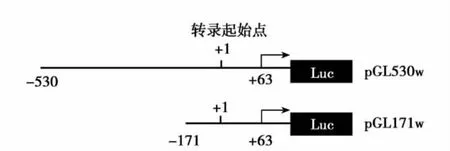
图3 两个DDAH2启动子荧光素酶报告基因载体结构示意图
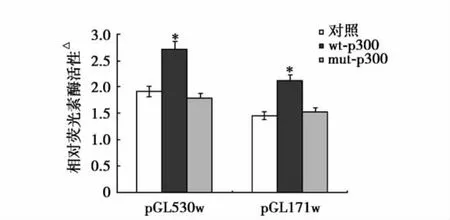
图4 荧光素酶结果显示不同条件下DDAH2启动子活性。与对照(未处理细胞)比较*P<0.05。图示三次实验均值±标准差。△:将pGL530w或pGL171w与pRL-TK活性比值作为相对荧光素酶活性,每个样品重复三次,取平均值,余注见图1
3 讨论
蛋白质乙酰化是一种生物体内广泛存在的表观遗传学修饰。多种蛋白质(主要包括组蛋白和转录因子)可进行乙酰化修饰,它们在转录水平调节基因表达。蛋白质的乙酰化水平主要受两类酶的调节,即组蛋白HAT和组蛋白去乙酰化酶(HDAC)。HAT将乙酰辅酶A的乙酰基团转移至蛋白质特定赖氨酸残基而引起蛋白质乙酰化,HDAC与其作用相反。目前已发现多种高血压相关基因受乙酰化的调节,例如WNK4(一种钠离子重吸收的调节因子)基因是一种重要的高血压候选基因,研究显示刺激β(2)肾上腺素受体可导致肾脏中AMP依赖的组蛋白去乙酰化酶8(HDAC8)活性的抑制,而引起组蛋白乙酰化,增强糖皮质激素受体与WNK4启动子的一个负性糖皮质激素受体反应元件结合,导致WNK4表达抑制,其可能在盐敏感性高血压发生中具有重要意义[14]。同时有研究显示乙酰化在神经系统对血压的调节中亦有重要意义,例如褪黑素在神经胶质细胞及神经干细胞中可引起组蛋白乙酰化,从而调节多种基因的表达,而脑干中血管舒张调节区表达高水平的褪黑素受体[15]。因此,乙酰化已被认为是一种重要的潜在的高血压治疗靶点。
一些转录辅激活因子已被证实具有乙酰转移酶的活性,包括 p300、PCAF、GCN5 等[16,17]。p300 是研究的最为深入的具有乙酰转移酶活性的辅激活因子之一,它是一种具有多个重要结构域的大分子蛋白质,其中包括一个重要的HAT结构域,它可以催化所有四种核心组蛋白N末端的赖氨酸残基和许多其他非组蛋白的乙酰化,并且这种乙酰化功能对p300在一些基因中的转录激活功能是必需的[18]。例如与野生型p300相比,HAT功能域缺失的p300不能使iNOS基因表达上调[10]。因此,为鉴定乙酰化对DDAH2基因表达的影响,我们分别转染了野生型及HAT结构域缺失的突变型p300表达载体,real-time PCR结果显示野生型p300显著上调DDAH2 mRNA表达水平,而突变型p300无此作用,提示p300对DDAH2的表达上调依赖于HAT结构域,说明p300可能通过乙酰化某些蛋白质而上调DDAH2 mRNA水平。同时我们注意到突变型p300可使DDAH2 mRNA水平轻度下调,这可能是由于外源的突变型p300竞争性抑制了内源性p300与某些转录相关蛋白的结合及其乙酰转移酶的功能,而影响了DDAH2的转录。
同时,为进一步鉴定乙酰化调节DDAH2表达的机制,我们应用软件分析了DDAH2启动子结构,结果发现启动子区存在多种受乙酰化调节的转录因子结合位点,包括 NF-κB、Sp1、C/EBP 等,提示 p300 可能通过乙酰化这些转录因子及组蛋白,而影响启动子活性,从而调节DDAH2基因表达。因此我们构建了两个DDAH2启动子荧光素酶报告基因载体,与p300表达载体共转染HEK293细胞后,检测荧光素酶活性。结果显示,野生型p300可显著上调启动子活性,而缺失HAT结构域的p300作用不明显,提示p300对DDAH2启动子的作用依赖于其HAT结构域,提示它通过调节蛋白质的乙酰化而调节启动子活性,进一步说明了乙酰化在DDAH2基因表达调控中的作用。
综上,我们的结果显示肾脏细胞中p300介导的乙酰化可通过调节DDAH2基因启动子活性,从而参与调节DDAH2基因表达。我们的结果及从前的报道证明p300—乙酰化途径同时调节NOS及DDAH/ADMA系统,因此其可能在组织NO生物合成种发挥重要作用,从而参与调节血压水平,这有可能为寻找新的高血压发生的分子机制提供一定的理论基础,并为其治疗提供新的分子靶标。
[1]Plato CF,Stoos BA,Wang D,et al.Endogenous nitric oxide inhibits chloride transport in the thick ascending limb.Am J Physiol Renal Physiol,1999,276:F159-163.
[2]Plato CF,Shesely EG,Garvin JL.eNOS mediates L-arginine induced inhibition of thick ascending limb chloride flux.Hypertension,2000,35:319-323.
[3]Ortiz PA,Hong NJ,Garvin JL.NO decreases thick ascending limb chloride absorption by reducing Na-K-2Cl cotransporter activity.Am J Physiol Renal Physiol,2001,281:F819-F825.
[4]Garvin JL,Hong NJ.Nitric oxide inhibits sodium/hydrogen exchange activity in the thick ascending limb.Am J Physiol Renal Physiol,1999,277:F377-F382.
[5]Stoos BA,Garcia NH,Garvin JL.Nitric oxide inhibits sodium reabsorption in the isolated perfused cortical collecting duct.J Am Soc Nephrol,1995,6:89-94.
[6]Garcia NH,Stoos BA,Carretero OA,et al.Mechanism of nitric oxide induced blockade of collecting duct water permeability.Hypertension,1996,27:679-683.
[7]Jaimes EA,Zhou MS,Pearse DD,et al.Upregulation of cortical COX-2 in salt-sensitive hypertension:role of angiotensin II and reactive oxygen species.Am J Physiol Renal Physiol,2008,294:F385-392.
[8]Ito A,Tsao PS,Adimoolam S,et al.Novel mechanism for endothelial dysfunction: dysregulation of dimethylarginine dimethylaminohydrolase.Circulation,1999,99:3092-3095.
[9]喜杨,孙宁玲,马旃等.气体信号分子硫化氢与一氧化氮在高血压患者中的变化探讨.中国循环杂志,2007,22:246-249.
[10]李世军,李长育,周素敏.原发性高血压病人颈动脉重构与内皮素、一氧化氮及二者比例变化关系的探讨.中国循环杂志,2002,17:102-104.
[11]Li Y,Zhao Y,Li G,et al.Regulation of neuronal nitric oxide synthase exon 1f gene expression by NF-κB acetylation in human neuroblastoma cells.JournalofNeurochemistry,2007,101:1194-1204.
[12]Deng WG,Wu KK.Regulation of inducible nitric oxide synthase expression by p300 and p50 acetylation.J Immunol,2003,171:6581-6588.
[13]Lassot I,Estrabaud E,Emiliani S,et al.p300 modulates ATF4 stability and transcriptional activity independently of its acetyltransferase domain.J Biol Chem,2005,280:41537-41545.
[14]Mu S,Shimosawa T,Ogura S,et al.Epigenetic modulation of the renal β-adrenergic-WNK4pathway in salt-sensitive hypertension.Nat Med,2011,17:573-580.
[15]Millis RM.Epigenetics and hypertension.Curr Hypertens Rep,2011,13:21-28.
[16]Chan HM,and La Thangue NB.p300/CBP proteins:HATs for transcriptional bridges and scaffolds.J Cell Sci,2001,114:2363-2373.
[17]GoodmanRH andSmolikS.CBP/p300 incellgrowth,transformation,and development.Genes Dev,2000,14:1553-1577.
[18]Gerd A,Blobel GA.CBP and p300:versatile coregulators with important roles in hematopoietic gene expression.J Leukoc Biol,2002,71:545-556.
