酵母蛋白酶A活性检测方法的比较
2013-05-18刘春凤李永仙王金晶
宋 群,刘春凤,李永仙,王金晶,李 崎,*
(1.江南大学教育部工业生物技术重点实验室,江苏无锡214122;2.江南大学酿酒科学与工程研究室,江苏无锡214122)
酵母蛋白酶A(EC3.4.23.6)是一种天冬氨酸族蛋白酶,由PEP4基因编码[1-3]。分泌到胞外的蛋白酶A可降解发酵液和成品啤酒中的泡沫活性蛋白,从而降低纯生啤酒的泡沫稳定性[4-7]。如何准确测定纯生啤酒中极微量的蛋白酶A一直是研究者所关注的问题。蛋白酶A的检测方法大致可分为两类:利用天然底物测定[8-11]和利用合成底物测定[12-14]。天然底物涉及酪蛋白、偶氮酪蛋白、变性血红蛋白、非折叠肌红蛋白、胰岛素A链及B链、核糖核酸酶等,一般使用紫外分光光度法(UV法)、福林酚法(Lowry法)或考马斯亮蓝法(Bradford法)检测。合成底物包括生色肽、荧光肽等,利用底物显色或释放出荧光素来反映蛋白酶A的活性。这些方法或多或少存在一些缺陷,利用天然底物检测灵敏度较低,利用合成底物可以提高检测的灵敏度,但是也存在操作繁琐,或者价格昂贵、底物不易获得等缺点。近年来新兴的共振光散射技术(Resonance light scattering technique,RLS)因其具有灵敏度高、简便、快速等优点而得到迅猛发展[15-17]。本研究组利用酪蛋白与三氯乙酸相互作用形成缔合微粒,在468nm波长处产生较强的共振散射峰,建立了一种测定蛋白酶A活性的新方法—RLS法。本文比较了不同蛋白酶A活性检测方法的线性范围、精密度、检测限以及实际样品的测定差异,结果发现,RLS法具有明显优势,更适用于啤酒发酵液和成品啤酒样品的检测。
1 材料与方法
1.1 材料与仪器
蛋白酶A荧光底物(MOCAc-Ala-Pro-Ala-Lys-Phe-Phe-Arg-Leu-Lys(Dnp)-NH2) 日 本Peptide Institute,INC;福林酚试剂、考马斯亮蓝染色剂、牛血清白蛋白 生工生物工程(上海)有限公司;干酪素、NaOH、HCl、Gly、K2HPO4、KH2PO4、Na2CO3、TCA、Na2HPO4、NaH2PO4、柠檬酸等 上海国药集团化学试剂公司。
荧光分光光度计(650-60) 日本HITACHI公司;单光束紫外/可见分光光度计(UV1102) 上海天美科学仪器有限公司;精密pH计(FE20) 梅特勒-托利多仪器有限公司;电热恒温水浴锅(HHS) 上海博迅实业有限公司;超声波破碎仪(KQ3200DB) 昆山市超声仪器有限公司;台式高速离心机(5804R) 德国Eppendorf公司。

表1 不同浓度酶液的配制Table 1 Preparation of enzyme solution with different concentrations
1.2 实验方法
1.2.1 试剂配制 酪蛋白溶液(0.1%):0.25g酪蛋白用60mL 6mol/L HCl加热、超声溶解,加Gly-HCl缓冲液,使其终浓度为0.1mol/L,用饱和NaOH溶液调节pH到3,定容到250mL,中速滤纸过滤。配制2.5mol/L TCA、10%TCA、0.4mol/L Na2CO3、K2HPO4-柠檬酸缓冲液(pH5.3)、PBS缓冲液(pH7.4)、各浓度牛血清白蛋白溶液。
酵母自溶液样品:将50g酵母泥用250mL Na2HPO4-KH2PO4缓冲液(pH6.5)室温下自溶24h后,在冰浴中用石英砂研磨自溶液,过滤,离心,取上清液为粗酶液。
发酵液样品离心取上清液;啤酒样品过滤除气。
1.2.2 UV法测定蛋白酶A活性[8]酶促反应:在10mL小试管中加入1mL酶液,再加入0.1%酪蛋白溶液1mL,混匀,40℃反应20min,加入2mL 10%TCA,终止反应。空白为在酶液中先加2mL 10%的TCA后,再加入酪蛋白溶液。
用10mm比色皿分别测定反应体系和空白体系在275nm处的吸光值A275反应和A275空白,蛋白酶A活性用吸光值差表示:△A275=A275反应-A275空白。
1.2.3 Lowry法测定蛋白酶A活性[9-10]酶促反应:同1.2.2。将反应体系和空白体系离心,分别取上清液1mL,加0.4mol/L Na2CO3溶液5mL、福林酚试剂1mL,振荡均匀,置于40℃水浴中显色20min,取出,用10mm比色皿分别测定它们在680nm处的吸光值A680反应和A680空白,蛋白酶A活性用吸光值差表示:△A680=A680反应-A680空白。
1.2.4 Bradford法测定蛋白酶A活性[11]酶促反应:同1.2.2。将反应体系和空白体系离心,分别取上清液0.1mL,加考马斯亮蓝染色剂3mL,室温放置5min,用10mm比色皿分别测定它们在595nm处的吸光值A595反应和A595空白,蛋白酶A活性用吸光值差表示:△A595=A595反应-A595空白。
1.2.5 RLS法测定蛋白酶A活性 酶促反应:在10mL小试管中加入0.1mL酶液,再加入0.1%酪蛋白溶液1mL,混匀,40℃反应20min,加入2mL 2.5mol/L TCA,加蒸馏水将体系体积补齐到5mL,混匀,缔合20min。空白为在酶液中先加2mL 2.5mol/L的TCA中止反应20min后,再加入酪蛋白溶液。
设定荧光分光光度计的发射光和激发光波长均为468nm,狭缝均为2nm,分别测定反应体系和空白体系的共振散射光强度I468反应和I468空白,蛋白酶A活性用光强差表示:△I468=I468空白-I468反应。
1.2.6 荧光底物法测定蛋白酶A活性[12-14]酶促反应:在10mL小试管中加入1500μL K2HPO4-柠檬酸缓冲液、1368μL蒸馏水、120μL酶液、12μL荧光底物,30℃反应30min,80℃灭活5min,快速冷却至室温。空白实验用蒸馏水代替酶液。
设定荧光分光光度计的发射光波长为393nm,激发光波长为328nm,狭缝均为5nm,分别测定反应体系和空白体系的荧光强度I反应和I空白,蛋白酶A活性用光强差表示:△I=I空白-I反应。
1.2.7 标准曲线的测定 用pH为7.4的PBS缓冲溶液配制不同浓度的牛血清白蛋白溶液(UV法:200~2000μg/mL,Lowry法:200~2000μg/mL,Bradford法:100~800μg/mL,RLS法:1~500μg/mL),分别按照上述1.2.2~1.2.5方法测定蛋白浓度与吸光值或光强值的关系,以蛋白浓度为横坐标,以吸光值或光强值为纵坐标绘制标准曲线。
1.2.8 RLS法的有效性验证 按照表1配制不同浓度的蛋白酶A溶液。分别用1.2.5和1.2.6的方法测定表1中10种酶液的酶活,以RLS法得到的△I468值为横坐标,以荧光底物法得到的△I值为纵坐标作图,比较两种方法的相关性。
2 结果与讨论
2.1 线性范围的比较
图1为UV法、Lowry法、Bradford法和RLS法的标准曲线。从线性范围来看,UV法和Lowry法适用于较高蛋白酶A浓度样品的检测,线性范围均为200~2000μg/mL;Bradford法适用的检测浓度较UV法略低,线性范围为100~800μg/mL;RLS法较其他3种方法灵敏度最高,标准蛋白浓度在1~500μg/mL之间时,标准曲线的线性良好(R2=0.9974)。四种方法的决定系数(R2)均较高,都大于0.9900,说明线性关系的拟合效果很好,线性回归模型可信。
2.2 精密度的比较
为了考察4种方法的精密度,实验中分别用4种方法对同一种酵母自溶液样品进行10次平行测定,计算不同方法的相对标准偏差,结果如表2所示。

表2 各方法的相对标准偏差Table 2 Relative standard deviation of four methods
从表2可以看出,Bradford法相对标准偏差较高,为3.15%,精密度略差。其他3种方法的相对标准偏差都比较低,UV法为0.52%,Lowry法为1.47%,RLS法为1.95%,均小于2.00%,精密度符合测定要求。

图1 标准曲线Fig.1 Standard curves
2.3 检测限的比较
按照国际纯粹与应用化学联合会(IUPAC)的规定,置信水平为99.86%时,方法的检测限由式(1)算出:

式中,δ空白为10次测定值的标准偏差。
根据公式(1)分别计算出的四种方法的检测限,结果见表3。
从表3可以看出,RLS法的检测限最低,为0.662μg/mL,大大低于其他3种方法,其他3种方法的检测限均高于10μg/mL。在实际的啤酒生产中,存在于发酵液和成品啤酒中的蛋白酶A都是极微量的,这就要求蛋白酶A活性测定方法具有足够低的检测限,所以RLS法具有明显优势。

表3 各方法检测限Table 3 Detection limit of four methods
2.4 啤酒样品测定的比较
为了比较不同测定方法在实际啤酒发酵过程中蛋白酶A活性检测方面的差异,实验选取3种成品啤酒样品和6种啤酒发酵液样品为研究对象,分别采用上述4种方法对不同样品中的蛋白酶A活性进行测定,结果如表4所示。其中,1~3号样品为三种生产日期接近的市售纯生啤酒;4~6号样品为相同发酵条件下3种不同菌种分别发酵6d后的样品;7~9号样品为相同发酵条件下上述3种不同菌种分别发酵10d后的样品。

表4 不同发酵液和成品啤酒中的蛋白酶A活性Table 4 Proteinase A activity of different fermentation broth and final beer samples
由表4可以看出,9种样品中的蛋白酶A活性均在UV法、Lowry法和Bradford法的检测限以下,因此这3种方法无法测定出实际样品中的蛋白酶A活性;而RLS可以检测到所有样品中的蛋白酶A活性。由于啤酒装瓶前都经过稀释,因此成品啤酒中的蛋白酶A活性均低于发酵液样品中的活性;发酵末期比发酵中期的蛋白酶A活性显著增强,但增强幅度因菌种不同而异。从测定结果可以看出,RLS法对于啤酒酿造过程中的蛋白酶A活性跟踪检测方面具有较强的适用性。
2.5 RLS法的有效性验证
荧光底物法是目前公认的检测蛋白酶A活性最准确的方法,实验中使用荧光底物法对共振光散射法的有效性进行验证。按1.2.8所述,配制不同浓度的蛋白酶A酶液,分别用上述两种方法检测酶活,考察两种方法的相关性(见图2)。结果显示,两种方法的相关性高,决定系数R2为0.9917,使用共振光散射法检测蛋白酶A活性具有较高可靠性。
尽管荧光底物法有很高的准确度和很低的检测限,但是这种方法要求的底物很难得到,且价格昂贵。另外,底物要求非常严格的保藏条件,开封后有效期短。所以,这种方法很难在工业和实验室中应用。相反,RLS法使用酪蛋白作为底物,酪蛋白价格低廉,容易获取。所以,RLS法可以应用到发酵液和成品啤酒中微量蛋白酶A活性的检测,不仅在实验室中,而且在工业上也有较大的应用潜力。
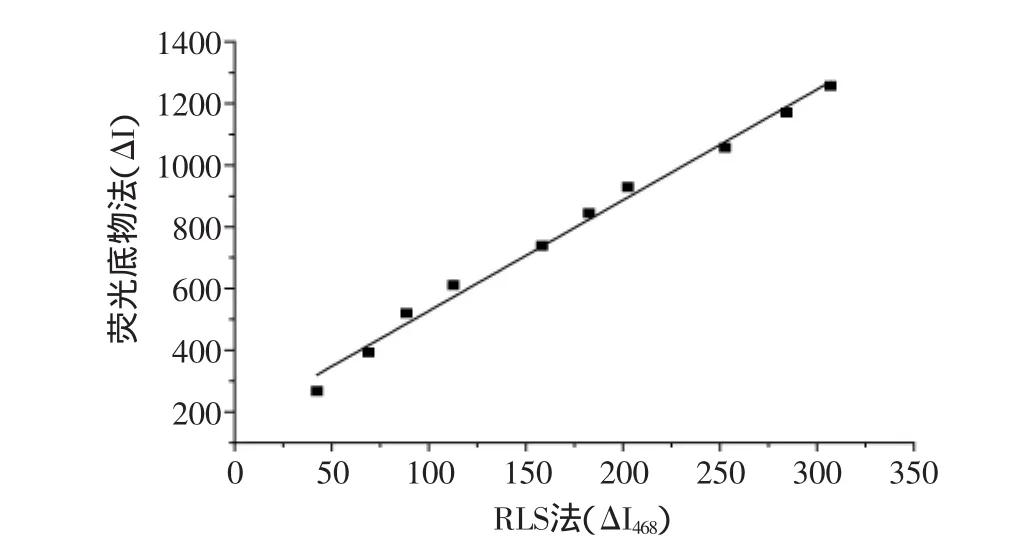
图2 RLS法和荧光底物法的相关性Fig.2 The correlation of RLS method and Fluorescent Substrate method
3 结论
本文从标准曲线、精密度、检测限、实际样品的测定等方面,对现有的蛋白酶A活性检测方法与本研究组建立的RLS法进行了比较。结果显示,与UV法、Lowry法、Bradford法相比,RLS法的精密度高(RSD=1.95%),标准蛋白浓度在1~500μg/mL之间时,标准曲线的线性良好(R2=0.9974),检测限可达到0.662μg/mL,并且在实际样品的检测中具有明显优势。对RLS法进行验证,结果显示,此方法的测定结果准确可靠,与荧光底物法测定结果之间的相关性系数为0.9917。因此,RLS法对啤酒发酵过程中蛋白酶A活性的测定优于其他方法,在实际啤酒生产过程中具有较大的应用潜力。
[1]Parr C L,Keates R A B,Bryksa B C,et al.The structure and function of saccharomyces cerevisiae proteinase A[J].Yeast,2007,24:467-480.
[2]Ammerer G,Hunter C P,Rothman J H,et al.PEP4 gene of saccharomyces cerevisiae encodes proteinase a,a vacuolar enzyme required for processing of vacuolar precursors[J].Molecular and Cellular Biology,1986(6):2490-2499.
[3]Dreyer T,Halkier B,Svendsen I,et al.Primary structure of the aspartic proteinase A from saccharomyces cerevisiae[J].Carlsberg Res Commun,1986,51:27-41.
[4]王肇悦,何国庆,刘中山,等.纯生啤酒存放过程中泡沫稳定性与酵母蛋白酶A以及蛋白含量与组成变化的研究[J].中国食品学报,2006,6(4):96-100.
[5]JonesE W.Three Proteolytic Systems In the yeast saccharomyces cerevisiae[J].BiologicalChemistry,1991,266:7963-7966.
[6]Wang Z Y,He G Q,Liu Z S,et al.Purification of yeast proteinase A from fresh beer and its specificity on foam proteins[J].International Journal of Food Science and Technology,2005,40(8):835-840.
[7]王德良,何春燕,李建飞,等.蛋白酶A与纯生啤酒泡沫稳定性的关系研究[J].啤酒科技,2008,12:44-48.
[8]Murphy J B,Kies M W.Note on spectrophotometric determination of proteins in dilute solutions[J].Biochimica et Biophysica Acta,1960,45:382-384.
[9]Lowry O H,Bessey O A.The adaptation of the Beckman spectrophotometer to measurements on minute quantities of biological materials[J].J Biol Chem,1946,163:633-639.
[10]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the folin phenol reagent[J].J Biol Chem,1951,193:265-275.
[11]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[12]Yokosawa H,Ito H,Murata S,et al.Purification and fluorometric assay of proteinase A from yeast[J].Analytical Biochemistry,1983,134(1):210-215.
[13]Yokoi S,Shigyo T,Tamaki T.A fluorometric assay for proteinase A in beer and its application for the investigation of enzymatic effects on foam stability[J].Journal of The Institute of Brewing,1996,102:33-37.
[14]Kondo H,Yomo H,Furukubo S,et al.Advanced method for measuing proteinase A in beer and application to brewing[J].Journal of the Institute of Brewing,1999,105(5):293-300.
[15]Zhong H,Wang K,Chen H-Y.Protein analysis with tetrasubstituted sulfonated cobalt phthalocyanine by the technique of Rayleigh light scattering[J].Analytical Biochemistry,2004,330(1):37-42.
[16]Wang F,Yang J,Wu X,et al.Study of the interaction of proteins with curcumin and SDS and its analytical application[J].Molecular and Biomolecular Spectroscopy,2005,61(11/12):2650-2656.
[17]Gao D,He N,Tian Y,et al.Determination of bovine serum albumin using resonance light scattering technique with sodium dodecylbenzenesulphonate-cetyltrimethylammonium bromide probe[J].Molecular and Biomolecular Spectroscopy,2007,68(3):573-577.
